利用表达嵌合抗原受体(chimeric antigen receptor, CAR)的T细胞治疗肿瘤患者,是一种十分有前景的根除肿瘤细胞的治疗方法。嵌合抗原受体通常是由胞外非信号区和胞内信号区两部分组成。胞外区包括来自单克隆抗体的单链可变区(ScFv)、铰链区(间隔区)及跨膜区,胞内区包括CD3ζ链或FcεRIγ,或同时引入一种或多种共刺激信号(如CD28、CD137、CD134)[1]。经CAR修饰的T细胞在受到特异抗原刺激后能被有效激活、扩增、产生细胞因子并特异地杀伤肿瘤细胞[2]。
前列腺干细胞抗原(prostate stem cell antigen, PSCA)是一个含123个氨基酸的糖蛋白,最初发现于前列腺癌中,具有较高的前列腺组织特异性[3],而后期研究发现其广泛过表达于多种实体瘤表面[4],例如胃癌[5-8]、胰腺癌[9]、膀胱癌[10-12]等,因此PSCA有望成为免疫治疗实体瘤的理想靶点[13]。2B3是靶向PSCA的人源化单克隆抗体,能与PSCA抗原特异性结合,可将其作为嵌合抗原受体的特异抗体[14]。
本研究以2B3单克隆抗体的可变区为单链抗体区、IgG4Fc为铰链区、CD28为跨膜区、CD28和4-1BB为共刺激信号,构建了靶向PSCA的第3代CAR慢病毒载体,并利用慢病毒将其导入人T淋巴细胞中,研究其表达情况及体内外抗肿瘤作用,为后续实体肿瘤的免疫治疗奠定了理论基础。
1 材料与方法 1.1 实验材料质粒PL-CD-19-28TM-28BBζ质粒由本实验室保存,质粒抽提试剂盒(Omega公司),大肠杆菌TOP10为本实验室保存,限制性内切酶(Thermo公司),DNA链接酶(TaKaRa公司),琼脂糖(上海生工生物公司),胶回收试剂盒(Promega公司),细胞系293T(ATCC),细胞系HeLa(ATCC),细胞系T24(ATCC), 稳定表达萤火虫荧光素酶(Fire Fly-Luciferase)的HeLa细胞系由本实验室构建并保存,DMEM培养基(Gibco公司),RPMI1640培养基(Gibco公司),胎牛血清(BI公司),xCELLigence RTCA(艾森生物有限公司),酶标仪(BioTek公司),离心机(Eppendorf),ELISA检测试剂盒(BD公司),NOG小鼠(北京维通利华),Protein L单克隆抗体(BD公司),羊抗鼠IgG-647(BD公司),活体成像仪(PerkinELmer公司),重组IL-2(山东金泰生物)。
1.2 重组慢病毒载体PL-PSCA-G4H-28TM-28BBζ的构建全基因合成2B3单克隆抗体ScFv序列(序列来源于专利:US8940871B2),并加上NheⅠ及XhoⅠ酶切位点。将合成的ScFv片段及慢病毒载体PL-CD19-28TM-28BBZ用NheⅠ及XhoⅠ酶切,分别切胶回收合成片段和载体片段,在16 ℃连接反应3 h(总体积10 μL,合成片段2 μL,载体1 μL,10×buffer 1 μL,T4 DNA Ligase 1 μL,ddH2O 5 μL),然后用感受态菌TOP10及氨苄青霉素抗性LB平板进行阳性菌落筛选,抽提质粒并酶切和测序鉴定重组载体PL-PSCA-G4H-28TM-28BBζ。
1.3 制备慢病毒及感染T淋巴细胞 1.3.1 病毒的包装培养293T细胞,待其生长状态良好时取1×106/孔的密度铺于1个10 cm的培养皿中,培养过夜于第2天用8 mL无血清的DMEM培养基换液,继续于CO2培养箱培养2 h。取1个1.5 mL离心管,分别加入13 μg包装质粒(2G :REV :RRE混合物)和20 μg表达质粒,轻柔混匀,然后加入补充到600 μL所需的水,再加入2.5 mol/L CaCl2 60 μL,最后逐滴加入2×HBSS 600 μL,边滴加边涡旋震荡,室温静置孵育20 min。将DNA与CaCl2混合液吹匀,培养箱里面孵育5 min左右,加到4.8 mL无血清的DMEM细胞培养液中,充分混匀,37 ℃孵育5min左右,加入培养皿中,3~5 h后换液成10 mL含5% FBS的DMEM培养基,之后正常培养,分别在48 h和72 h后收集细胞上清,采用PEG6000进行病毒纯化。
1.3.2 T淋巴细胞感染采用抗CD3单克隆抗体活化人外周血来源的PBMC细胞,24 h后,加入3 MOI的慢病毒载体,培养12~18 h后,用含有500 U/mL的重组人IL-2的完全培养基换液,于37 ℃、5%CO2培养箱继续培养12 d。
1.4 流式细胞术检测CAR表达分别在T细胞感染病毒第5天和第12天,取5×105个细胞,300×g离心去掉上清,加入100 μL含1%FBS的PBS溶液重悬细胞。加入FITC标记的小鼠抗人CD3单克隆抗体(BD公司)、小鼠protein L(BD公司),4 ℃孵育30 min,用PBS溶液洗2次后再加入Alexa Fluor 647标记羊抗鼠二抗(BD公司),4 ℃孵育30min后用PBS溶液洗2次,以未感染病毒的T细胞为对照,用流式细胞仪进行检测。
1.5 体外杀伤实验检测靶向PSCA的CAR-T细胞对PSCA阳性肿瘤细胞的杀伤作用分别以PSCA阳性的HeLa细胞与PSCA阴性的T24细胞为靶细胞。收集培养状态良好的靶细胞,调整浓度为1×105/mL, 铺于96孔E-plate中,每孔100 μL,置CO2培养箱培养过夜并用xCELLigence RTCA进行连续记录Cell Index值。次日收集CAR-T细胞,300×g离心去除上清,以不含IL-2的完全培养基重悬,调整细胞浓度后将其加入含有靶细胞的E-plate中。置培养箱中培养记录杀伤情况,并计算杀伤效率。
细胞杀伤率=(1-效应细胞与靶细胞共培养孔指数)/单独靶细胞培养孔指数×100%
1.6 体内动物实验验证PSCA-CAR-T细胞体内肿瘤抑制效果以稳定表达萤火虫荧光素酶(fire fly-luciferase)的HeLa细胞系皮下注射NOG小鼠建立小鼠移植瘤模型(1×106/只),将培养10d的PSCA-CAR-T细胞以效靶比10 :1尾静脉注射小鼠模型,并以未转染病毒的T细胞为对照组,每隔4d测量肿瘤体积,每周做1次小鼠活体成像。
肿瘤体积(mm3)=(长边×短边×短边)/2
1.7 统计学分析单因素计量资料以x±s表示,采用Graphpad 6.0软件进行方差分析及t检验。检验水准:α=0.05。
2 结果 2.1 重组慢病毒载体PL-PSCA-G4H-28TM-28BBZ构建与鉴定基因合成2B3单克隆抗体ScFv后,经酶切、连接等分子克隆技术,构建了重组慢病毒载体PL-PSCA-G4H-28TM-28BBζ,大小为8 591 bp,通过NheⅠ+XhoⅠ双酶切鉴定结果为784、7 807 bp, 并测序验证正确,成功获得克隆(图 1)。
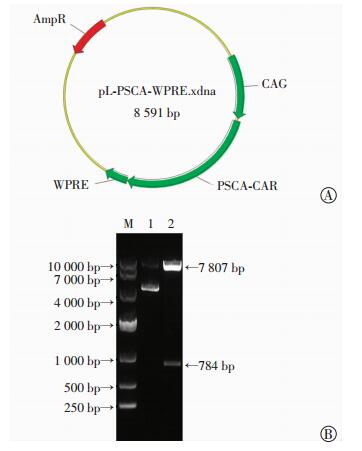
|
| A:慢病毒载体PL-PSCA-G4H-28TM-28BBζ结构示意图; B:重组载体的酶切鉴定1:质粒; 2: NheⅠ+XhoⅠ双酶切; M: DL 10 000标准 图 1 重组慢病毒载体PL-PSCA-G4H-28TM-28BBζ的构建与鉴定 |
2.2 T细胞感染慢病毒载体抗PSCA抗体表达阳性率及其细胞表型鉴定
感染PL-PSCA-G4H-28TM-28BBZ慢病毒载体的T细胞分别在第5、12天用流式细胞术检测CAR表达阳性率,分别为47.6%和53.9%,表明该嵌合抗原受体能在T细胞表面稳定表达。为了明确该T细胞的亚型组成,流式细胞术检测其CD4亚型与CD8亚型细胞的比例,结果表明CD4/CD8=3 :4(图 2)。该方法制备获得的CAR-T细胞(命名为PSCA-CAR-T)。
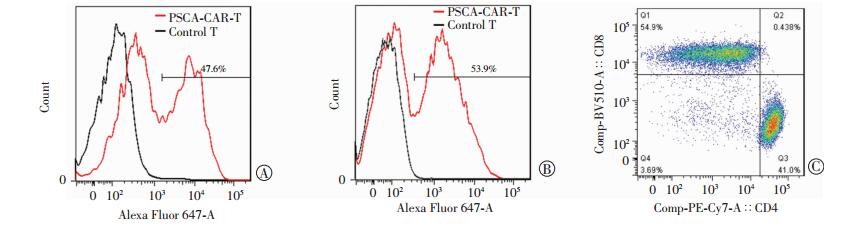
|
| A:慢病毒感染T细胞5 d后CAR表达阳性率; B:慢病毒感染T细胞12 d后CAR表达阳性率; C:慢病毒感染T细胞后CD4与CD8的比例 图 2 流式细胞术检测慢病毒感染T细胞后抗PSCA抗体表达阳性率及CD4与CD8的比例 |
2.3 PSCA-CAR-T细胞对肿瘤细胞系的体外杀伤效果
流式细胞术检测确定PSCA阳性与阴性细胞,并分别以PSCA阳性的HeLa细胞系和PSCA阴性的T24细胞系为靶细胞(图 3A、B),PSCA-CAR-T细胞作为效应细胞,依次从高到低设置4个效靶比(30 :1、10 :1、3 :1、1 :1)处理6 h。结果显示:PSCA-CAR-T细胞对HeLa细胞的杀伤成浓度依赖性,效靶比越高其杀伤作用越强,当效靶比达到10 :1以上时杀伤效率可超过50%,而对T24细胞的杀伤很弱,几乎没有杀伤(图 3C)。同时,在低效靶比(1 :1)的情况下延长处理时间后发现,随着时间的延长杀伤作用也逐渐增强,在16、24 h PSCA-CAR-T细胞对HeLa细胞杀伤作用也显著强于T24细胞(图 3D)。以上结果表明PSCA-CAR-T细胞对PSCA阳性肿瘤细胞有很好的杀伤作用,并且这种杀伤作用具有良好的抗原特异性(P < 0.01)。
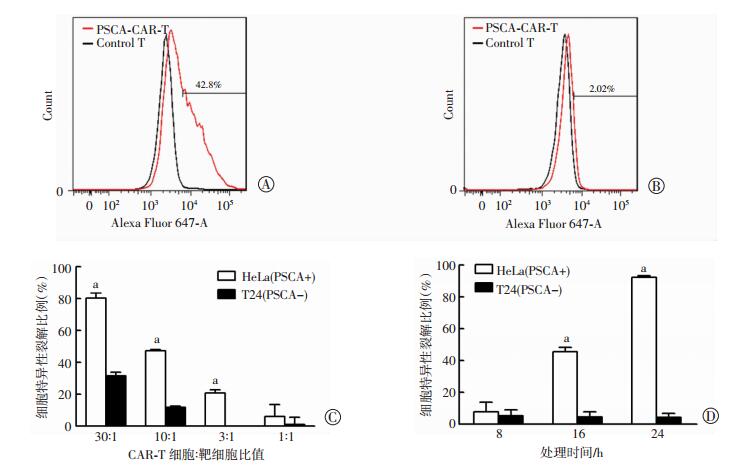
|
| A:靶细胞(HeLa)PSCA表达; B:靶细胞(T24)PSCA表达; C:不同效靶比PSCA-CAR-T细胞对靶细胞的杀伤作用; D:处理不同时间PSCA-CAR-T细胞对靶细胞的杀伤作用a:P < 0.01,与PSCA阴性靶细胞(T24)比较 图 3 PSCA-CAR-T细胞体外对肿瘤细胞系的特异性杀伤作用 |
2.4 PSCA-CAR-T细胞与肿瘤细胞共培养细胞因子IFN-γ、IL-2的分泌
T细胞在进行杀伤的过程中可以特异性释放细胞因子IFN-γ和IL-2,将效应细胞与靶细胞进行共培养,24 h后离心收集上清,ELISA检测结果显示:PSCA-CAR-T细胞在PSCA阳性的HeLa细胞刺激下,与对照组相比有较高的细胞因子IFN-γ分泌(P < 0.01),而在PSCA阴性的T24细胞刺激下,无细胞因子IFN-γ分泌(图 4A)。同时PSCA-CAR-T细胞在PSCA阳性的HeLa细胞刺激下,与对照组相比有较高的细胞因子IL-2分泌(P < 0.01),而在PSCA阴性的T24细胞刺激下,无细胞因子IL-2分泌(图 4B)。进一步表明我们构建的PSCA-CAR-T细胞有很好的特异性。
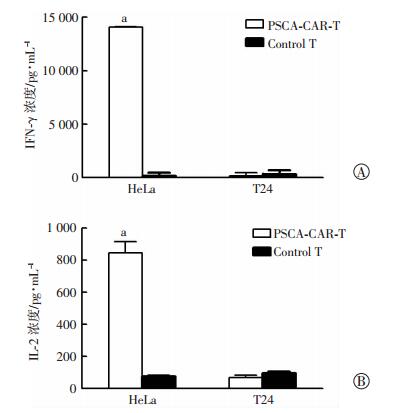
|
| A: IFN-Y的分泌量; B: IL-2的分泌量a:P < 0.01,与对照组(Control T)比较 图 4 ELISA检测PSCA-CAR-T细胞在靶细胞刺激后细胞因子IFN-Y、IL-2的分泌 |
2.5 PSCA-CAR-T细胞体内抗肿瘤效果
为了进一步检测PSCA-CAR-T的体内抗肿瘤效果,我们建立了HeLa细胞皮下移植瘤模型,在靶细胞注射后的第7天回输PSCA-CAR-T细胞,通过活体成像及肿瘤体积测量观察PSCA-CAR-T细胞的体内抗肿瘤作用。结果显示:注射PSCA-CAR-T细胞后的小鼠肿瘤体积明显小于对照组,肿瘤生长速度明显减慢(P < 0.05,图 5)。这表明该方法获得的PSCA-CAR-T细胞在体内具有良好的抗肿瘤作用,具有很好的应用前景。
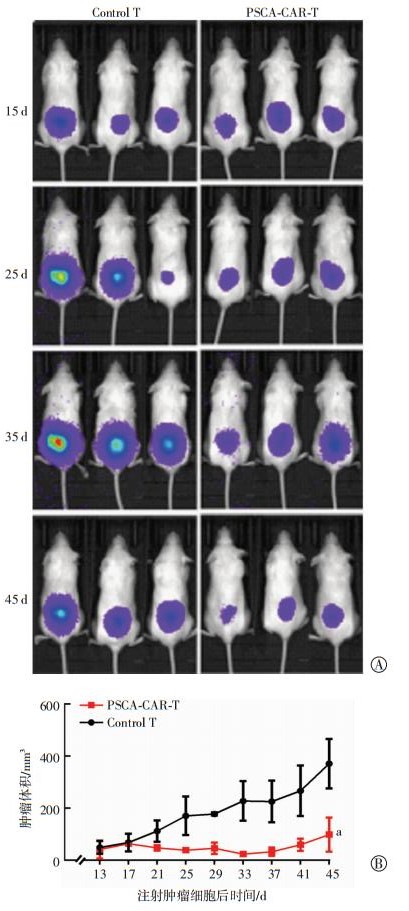
|
| A:活体成像检测小鼠肿瘤生长情况; B:小鼠肿瘤体积变化a:P < 0.05,与对照组(Control T)比较 图 5 PSCA-CAR-T细胞在小鼠体内对肿瘤的抑制作用 |
3 讨论
长期以来,肿瘤的免疫治疗受到肿瘤细胞免疫原性差,肿瘤患者免疫功能低下,自体对肿瘤反应的T细胞很难扩增的限制。近来,使用嵌合受体修饰的T淋巴细胞作为一种新的免疫治疗手段通过基因修饰的方法,使得T细胞表达靶向肿瘤特异性抗原的嵌合抗原受体,是一种极具吸引力的肿瘤免疫治疗方法[15]。该方法最主要的特点是可以使T细胞以HLA非限制的方式识别肿瘤靶点,因此可以根据不同肿瘤的组织学特点而设计相应的嵌合抗原受体,赋予T细胞对肿瘤的特异杀伤,克服了肿瘤细胞免疫逃逸的机制,从而达到对肿瘤治疗的目的[16]。目前该技术主要集中于对血液系统肿瘤的治疗,研究的靶点主要包括CD19、CD20、CD123、CD22、BCMA等,并取得了良好的临床效果[17-19]。
鉴于CAR-T细胞在血液肿瘤中取得的显著疗效,其治疗范围逐渐扩展到实体肿瘤中,而CAR-T细胞用于实体肿瘤的治疗仍处在初期研究阶段,且由于实体肿瘤缺乏真正特异的表面抗原,因此寻找有效的肿瘤细胞靶点具有十分重要的意义。PSCA属于肿瘤相关抗原,广泛高表达于包括前列腺癌、胰腺癌、膀胱癌等多种实体肿瘤中,且不成分泌形式,不易诱导机体产生免疫耐受,因此其可以肿瘤免疫治疗的作用靶点。研究表明,以PSCA为靶点的单克隆抗体能够特异性抑制小鼠体内移植瘤生长[20]。将PSCA作为嵌合抗原受体的靶点,以抗PSCA单抗为基础构建的嵌合抗原受体T细胞可使T细胞高效特异的杀伤肿瘤细胞,该方法可以广泛用于多种PSCA阳性实体肿瘤的治疗[21]。
CAR的发展目前已从1代发展到了4代:1代CAR由于对T细胞的激活不完整目前对其使用率已较低; 2代CAR由于共刺激信号的加入,改善了T细胞的增殖活性、细胞因子释放及细胞毒性等; 3代CAR通过引入了2个不同刺激号,有望在细胞杀伤及体内持久性方面得到较大提高; 4代CAR则是整合了如自杀基因、表达免疫因子等各种精准调控手段,以提高其特异性减少副作用。本研究专注于疗效较好的3代CAR, 成功构建了以PSCA为靶点的第3代CAR-T细胞,我们证实了其能被PSCA阳性肿瘤细胞激活,并通过体外杀伤及细胞因子分泌实验证实了其对肿瘤细胞杀伤的有效性及特异性。同时,通过小鼠移植瘤模型验证了其体内抗肿瘤作用,其有效地抑制了肿瘤的生长。因此,该研究为后期实体肿瘤的临床实验奠定了基础。
CAR-T细胞虽然明显抑制了实体肿瘤的生长但并未能完全清除肿瘤细胞,这也是目前该方法治疗实体肿瘤的不足之处。究其原因可能是:①由于实体肿瘤的微环境极其复杂,导致CAR-T不能有效进入肿瘤内部对肿瘤细胞进行有效杀伤; ②肿瘤微环境的免疫抑制细胞可能会保护肿瘤细胞免受抗肿瘤系统的攻击; ③一些抑制性免疫检查点如程序性细胞死亡蛋白1等,会关闭免疫细胞的杀肿瘤能力。针对这些问题,可以对嵌合抗原受体的结构进行进一步优化或是联合其他方法来提高其治疗的有效性,这也是我们今后研究努力的方向。
此外,CAR-T疗法虽然在肿瘤治疗中取得了振奋人心的效果,但由于培养过程中添加的辅料及CAR-T细胞本身的脱靶等原因造成的副作用也不可忽视。主要表现为:①肿瘤溶解综合征(tumor lysis syndrome,TLS); ②细胞因子风暴(cytokine release syndrome, CRS); ③移植物抗宿主病(graft versus host disease,GVHD); ④脱靶(on-target off-tumor toxicity)效应,这些副作用都需要我们在今后的研究中不断改进,逐步完善。
| [1] | KOWOLIK C M, TOPP M S, GONZALEZ S, et al. CD28 costimulation provided through a CD19-specific chimeric antigen receptor enhances in vivo persistence and antitumor efficacy of adoptively transferred T cells[J]. Cancer Res, 2006, 66(22): 10995–11004. DOI:10.1158/0008-5472.CAN-06-0160 |
| [2] | SADELAIN M, BRENTJENS R, RIVIRE I. The basic principles of chimeric antigen receptor design[J]. Cancer Discov, 2013, 3(4): 388–398. DOI:10.1158/2159-8290.CD-12-0548 |
| [3] | REITER R E, GU Z, WATABE T, et al. Prostate stem cell antigen: a cell surface marker overexpressed in prostate cancer[J]. Proc Natl Acad Sci U S A, 1998, 95(4): 1735–1740. DOI:10.1073/pnas.95.4.1735 |
| [4] | YANG X, GUO Z, LIU Y, et al. Prostate stem cell antigen and cancer risk, mechanisms and therapeutic implications[J]. Expert Rev Anticancer Ther, 2014, 14(1): 31–37. DOI:10.1586/14737140.2014.845372 |
| [5] | Study Group of Millennium Genome Project for Cancer, SAKAMOTO H, YOSHIMURA K, et al. Genetic variation in PSCA is associated with susceptibility to diffuse-type gastric cancer[J]. Nat Genet, 2008, 40(6): 730–740. DOI:10.1038/ng.152 |
| [6] | LOCHHEAD P, FRANK B, HOLD G L, et al. Genetic variation in the prostate stem cell antigen gene and upper gastrointestinal cancer in white individuals[J]. Gastroenterology, 2011, 140(2): 435–441. DOI:10.1053/j.gastro.2010.11.001 |
| [7] | LU Y, CHEN J, DING Y, et al. Genetic variation of PSCA gene is associated with the risk of both diffuse-and intestinal-type gastric cancer in a Chinese population[J]. Int J Cancer, 2010, 127(9): 2183–2189. DOI:10.1002/ijc.25228 |
| [8] | MATSUO K, TAJIMA K, SUZUKI T, et al. Association of prostate stem cell antigen gene polymorphisms with the risk of stomach cancer in Japanese[J]. Int J Cancer, 2009, 125(8): 1961–1964. DOI:10.1002/ijc.24519 |
| [9] | GRUBBS E G, ABDEL-WAHAB Z, TYLER D S, et al. Utilizing quantitative polymerase chain reaction to evaluate prostate stem cell antigen as a tumor marker in pancreatic cancer[J]. Ann Surg Oncol, 2006, 13(12): 1645–1654. DOI:10.1245/s10434-006-9029-5 |
| [10] | WU X, YE Y, KIEMENEY L A, et al. Genetic variation in the prostate stem cell antigen gene PSCA confers susceptibility to urinary bladder cancer[J]. Nat Genet, 2009, 41(9): 991–995. DOI:10.1038/ng.421 |
| [11] | WANG S, TANG J, WANG M, et al. Genetic variation in PSCA and bladder cancer susceptibility in a Chinese population[J]. Carcinogenesis, 2010, 31(4): 621–624. DOI:10.1093/carcin/bgp323 |
| [12] | MARRA E, UVA P, VITI V, et al. Growth delay of human bladder cancer cells by prostate stem cell antigen downregulation is associated with activation of immune signaling pathways[J]. BMC Cancer, 2010, 10: 129. DOI:10.1186/1471-2407-10-129 |
| [13] | DANNULL J, DIENER P A, PRIKLER L, et al. Prostate stem cell antigen is a promising candidate for immunotherapy of advanced prostate cancer[J]. Cancer Res, 2000, 60(19): 5522–5528. |
| [14] | MORGENROTH A, CARTELLIERI M, SCHMITZ M, et al. Targeting of tumor cells expressing the prostate stem cell antigen (PSCA) using genetically engineered T-cells[J]. Prostate, 2007, 67(10): 1121–1131. DOI:10.1002/pros.20608 |
| [15] | JENA B, DOTTI G, COOPER L J. Redirecting T-cell specificity by introducing a tumor-specific chimeric antigen receptor[J]. Blood, 2010, 116(7): 1035–1044. DOI:10.1182/blood-2010-01-043737 |
| [16] | PORTER D L, LEVINE B L, KALOS M, et al. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J]. N Engl J Med, 2011, 365(8): 725–733. DOI:10.1056/NEJMoa1103849 |
| [17] | GARFALL A L, MAUS M V, HWANG W T, et al. Chimeric antigen receptor T cells against CD19 for multiple myeloma[J]. N Engl J Med, 2015, 373: 1040–1047. DOI:10.1056/NEJMoa1504542 |
| [18] | TASIAN S K, KENDERIAN S S, SHEN F, et al. Optimized depletion of chimeric antigen receptor T cells in murine xenograft models of human acute myeloid leukemia[J]. Blood, 2017, 129(17): 2395–2407. DOI:10.1182/blood-2016-08-736041 |
| [19] | ORMH J M, BEDOYA F, FRIGAULT M J, et al. CARs in the lead against multiple myeloma[J]. Curr Hematol Malig Rep, 2017, 12(2): 119–125. DOI:10.1007/s11899-017-0373-2 |
| [20] | SAFFRAN D C, RAITANO A B, HUBERT R S, et al. Anti-PSCA mAbs inhibit tumor growth and metastasis formation and prolong the survival of mice bearing human prostate cancer xenografts[J]. Proc Natl Acad Sci U S A, 2001, 98(5): 2658–2663. DOI:10.1073/pnas.051624698 |
| [21] | WEI X, LAI Y, LI J, et al. PSCA and MUC1 in non-small-cell lung cancer as targets of chimeric antigen receptor T cells[J]. Oncoimmunology, 2017, 6(3): e1284722. DOI:10.1080/2162402X.2017.1284722 |



