急性髓细胞白血病(acute myeloid leukemia, AML)是一类由于造血祖细胞失去正常分化能力并异常增殖的造血系统的克隆性恶性疾病。AML是一个具有高度异质性的疾病群, 根据细胞形态学和组织化学特征将AML分为不同的类型, 如FAB分型和MIC分型[1]。除急性早幼粒白血病外, AML联合化疗的完全缓解(complete remission, CR)率仅为65%~75%, 长期无病生存率(leukemia-free survival, LFS)为20% ~30%[2]。年龄小于60岁的患者中, 超过5年的存活率只有40%[3]。鉴于目前AML治愈率低、存活率低、复发率高的特点[4], 寻找影响AML发生、发展的新的分子机制, 对其疾病诊断和靶向治疗具有重要意义。
长链非编码RNA(long non-coding RNA, LncRNA)是一类转录本超过200个核苷酸并且缺少编码蛋白能力的基因转录产物[5-6], 位于细胞核和细胞质中, 并且随着在细胞中的定位发挥不同的生物学功能[7-8]。LncRNA在正常生理以及许多疾病中发挥重要作用, 包括胚胎干细胞维持、器官发育和癌症进展[9-10]。本课题在前期工作基础上, 通过基因芯片筛选出在U937细胞中高表达的LncRNA LINC01140, 旨在探讨LncRNA LINC01140的表达对人白血病U937细胞增殖的影响。
1 材料与方法 1.1 细胞来源人白血病细胞系U937、Kasumi-1、NB4和人胚肾细胞系293FT购自于美国ATCC细胞库。2016年7-12月因急性髓系白血病住院患者20例骨髓标本和2017年5-6月在血液科进行骨髓检查提示为正常的10例骨髓标本。在获得知情同意后对标本进行检测。20例白血病患者年龄16~81(41.65±21.83)岁, 男性11例, 女性9例, 其中M1型2例, M2型3例, M4型10例, M5型2例, M6型1例, AML但未确定分型2例。10例正常者年龄27~70(45.60±12.16)岁, 男性3例, 女性7例。该项研究2018年获得陆军军医大学第一附属医院伦理委员会批准。
1.2 主要试剂RPMI1640培养基、DMEM培养基、opti-MEM培养基、0.25%胰蛋白酶(Gibco公司); 胎牛血清(康成公司); RNA提取、反转录及qRT-PCR试剂盒(TaKaRa公司); 嘌呤霉素、polybrene(Sigma公司); LipofectamineTM 3000转染试剂(Thermo Fisher公司); Cyclin E1抗体(Santa Cruz公司); GAPDH抗体(碧云天公司); p21抗体(Thermo Fisher公司); p27抗体(Proteintech公司); 引物和shRNA序列合成由上海生物工程公司提供。
1.3 细胞培养人白血病细胞U937、Kasumi-1和NB4培养于含10%胎牛血清的RPMI1640培养基中, 置于37 ℃、5% CO2培养箱中, 每2天细胞离心计数后传代。人胚肾细胞293FT培养于含10%胎牛血清的DMEM培养基中, 置于37 ℃、5% CO2培养箱中, 待细胞生长至90%左右时用0.25%胰蛋白酶消化离心后传代。
1.4 shRNA序列设计及合成根据GenBank人LINC01140 (NR_026989.1)序列信息, 以Invitrogen公司的RNAi在线网站设计2条RNA干扰靶点序列(表 1), 根据慢病毒载体构建说明书构建干扰载体。
| 序列名称 | 靶序列(5′→3′) | GC含量 |
| shLINC01140-1# | CAGATGCAATTAGCAGCCCAGAGAA | 48.00% |
| shLINC01140-2# | GCCCATCAGATTCCAAGAATC | 47.62% |
1.5 慢病毒包装、细胞转染及筛选
将干扰载体按照lipfectamineTM 3000说明书进行慢病毒包装。细胞转染时U937细胞按3×105/mL培养于10 cm培养盘中, 24 h后按照病毒和1640培养基2 :3比例转染, 并加入4 μL polybrene(4 μg/mL)提高转染效率。转染48 h后离心换液并用4 μL嘌呤霉素(0.4 μg/mL)筛选。
1.6 RNA提取及逆转录将U937、Kasumi-1和NB4细胞按照RNA提取和反转录试剂盒说明书, 分别提取RNA和反转录实验。反转录时每组加入1 μg RNA, 20 μL反应体系进行反转录成cDNA。加入20 μL DEPC水稀释模板进行后续实验。AML患者骨髓白细胞RNA提取及逆转录过程同上。RNA放至-80 ℃保存, cDNA放至-20 ℃保存。
1.7 qRT-PCR检测lncRNA LINC01140的干扰效果以β2-MG为内参, 采用Real-time PCR检测LINC01140的表达情况。LINC01140基因、内参β2-MG上下游引物见表 2。按照RT-qPCR试剂盒说明书进行检测。PCR反应条件为:解链, 95 ℃, 30 s, 1个循环; 变性, 95 ℃, 10 s; 退火, 64 ℃, 30 s; 39个循环。每组设置3个复孔。采用公式2-ΔΔCt计算LINC01140的干扰效果, 然后以3个复孔的均值和标准差作图, 即为LINC01140的相对表达量。
| 名称 | 序列(5′→3′) | 扩增长度(bp) |
| β2-MG | 上游:CCTTGAGGCTATCCAGCGT 下游:CCTGCTCAGATACATCAAACATG |
510 |
| LINC01140 | 上游:CCACTCAGGCGGATTCTTTC 下游:AATCATTCACATTGGCCCGG |
180 |
1.8 细胞计数法测定细胞增殖
将转染shRNA (shR-NC、shR-1、shR-2)的U937细胞种植于24孔板中, 每孔细胞为1×105, 1mL。每天用计数仪测量细胞数量, 在第4天时将后面未测孔中细胞转移至1.5 mL EP管中离心, 换液, 连续测量8 d, 每次3个复孔。最后绘制增殖曲线。
1.9 细胞克隆成球实验按照细胞克隆成球实验步骤分别配置Agar浓度为0.6%的下层胶和0.3%的上层胶于12孔板中。每孔加入1 000个shR-NC、shR-1、shR-2细胞, 每组3个复孔, 放置到恒温CO2培养箱中培养15~20 d, 待能肉眼可见细胞克隆球时, 每孔加入100 μL MTT溶液染色。最后计数克隆球数量。
1.10 流式细胞术检测将实验分为3组, 分别为U937 control、U937 shR-1和U937 shR-2, 取对数生长期的细胞于24孔板中, 每孔3×105细胞, 体积1 mL。置恒温CO2孵箱培养24 h。收集细胞于15 mL离心管中, 1 000 r/min, 离心5 min, 弃上清, 用3 mL PBS重悬细胞, 1 000 r/min, 离心5 min, 弃上清, 加入100 μL细胞周期染色液, 涡旋分散(每次2 s, 共10次), 冰上避光2 h, 最后转入1.5 mL EP管中, 流式细胞仪检测。
1.11 Western blot检测分别提取U937 control、U937 shR-1和U937 shR-2全细胞蛋白, 采用Western blot测定细胞周期G1期相关蛋白Cyclin E1、p27、p21的表达。
1.12 统计学分析采用SPSS 12.0统计软件进行独立样本t检验或单因素方差分析, 数据以x±s表示。检验水准:α=0.05。
2 结果 2.1 LINC01140在AML患者骨髓及细胞系中的表达采用qRT-PCR在正常人骨髓(10例)及白血病患者骨髓(20例)白细胞中检测LncRNA LINC01140的表达, 结果显示, LINC01140在白血病患者骨髓白细胞中的表达显著高于正常人骨髓白细胞(P < 0.01, 图 1A)。检测LINC01140在细胞株中的表达情况发现U937细胞的表达丰度最高(图 1B)。

|
| A:在正常骨髓及急性髓细胞白血病患者骨髓白细胞中的表达; B:在白血病细胞中的表达; a:P < 0.01, 与正常骨髓比较 图 1 LINC01140在急性髓细胞患者骨髓及细胞系中的表达 |
2.2 慢病毒感染对U937细胞的干扰效果
慢病毒感染U937细胞2 d后, 经嘌呤霉素筛选后, 通过qRT-PCR检测结果显示, 干扰后shR-1、shR-2 lncRNA表达量明显降低(P < 0.01, 图 2)。

|
| a:P < 0.01, 与shR-NC组比较 图 2 qRT-PCR检测细胞转染慢病毒载体后LINC01140的表达 |
2.3 干扰LINC01140表达后对U937细胞增殖的影响
相同条件下培养U937 shR-NC及U937 shR-1、U937 shR-2, 检测并统计不同时间点细胞数量, 绘制细胞生长曲线。结果显示, 与shR-NC组相比, shR-1、shR-2组细胞的增殖能力明显减弱, 差异具有统计学意义(P < 0.01, P < 0.05, 图 3)。
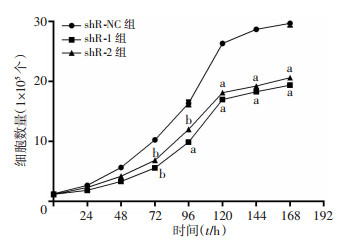
|
| a:P < 0.01, b:P < 0.05, 与shR-NC组比较 图 3 干扰LINC01140表达对各转染组U937细胞增殖的影响 |
2.4 干扰LINC01140表达后对U937细胞克隆成球能力的影响
干扰U937细胞中LINC01140表达后, 采用细胞克隆成球实验检测细胞增殖情况。结果显示, U937细胞成球数目变少(图 4A)且克隆球的体积变小(图 4B), 差异有统计学意义(P < 0.01, 图 4C), 进一步证明干扰LINC01140表达后, U937细胞增殖减弱。

|
| A:细胞克隆成球实验检测LINC01140对U937细胞成球能力的影响; B:显微镜观察细胞克隆球大小(×200);C:细胞克隆成球数量统计; a:P < 0.01, 与shR-NC组比较 图 4 干扰LINC01140表达对各转染组U937细胞克隆成球能力的影响 |
2.5 干扰LINC01140表达后对U937细胞周期的影响
流式细胞术检测结果显示, 干扰LINC01140表达后, 对照组G1期细胞所占比例为(46.25±1.06)%, shR-1和shR-2 G1期比例分别为(62.89±1.66)%和(59.03±1.00)%, 明显高于对照组, 差异有统计学意义(P < 0.01, 图 5)。
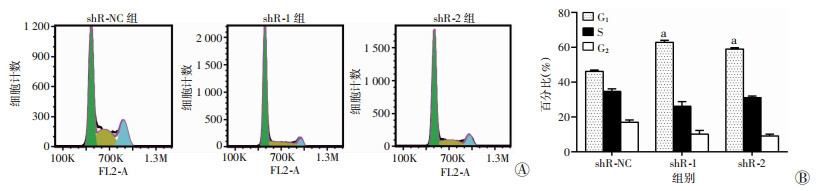
|
| A:流式细胞术检测干扰LINC01140表达对U937细胞周期的影响; B:细胞周期检测结果; a:P < 0.01, 与shR-NC组比较 图 5 流式细胞术检测干扰LINC01140表达对U937细胞周期的影响 |
2.6 Western blot检测结果
干扰U937细胞中LINC01140表达后, 可导致细胞G1期相关蛋白Cyclin E1的表达降低, p27和p21蛋白的表达升高(图 6)。
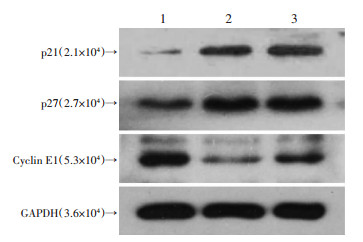
|
| 1:shR-NC组; 2:shR-1组; 3:shR-2组 图 6 Western blot检测干扰LINC01140表达对细胞蛋白表达的影响 |
3 讨论
目前研究表明, 多数LncRNA与mRNA类似, 都由RNA聚合酶Ⅱ转录而来, 具有相似的长度、加工方式和剪接信号[11], 但与mRNA相比, lncRNA表达量低且组织特异性高, 并且一级序列保守性低[12]。LncRNA参与调控多种生命进程, 如调节干细胞分化和自我更新[13], 调节免疫系统[14]等。同时lncRNA能够将蛋白质复合体、基因和染色体转移到合适的位置并进行适当的激活和失活, 其失调是由染色体缺失和易位引起的一些人类疾病的基础[15]。长链非编码RNA在白血病发生、发展过程中的作用也有较多探索。HIRANO等[16]发现, lncRNA CCDC26通过调节KIT表达来控制髓样白血病细胞的生长, KIT抑制剂可能是对CCDC26改变的AML患者的有效治疗药物。TRIMARCHI等[17]发现, lncRNA LUNAR1能够调控IGF1R基因的表达、IGF1信号转导和T-ALL的生长, 表明LUNAR1可以作为T-ALL的生物标志物和治疗靶点。GUO等[18]发现lncRNA-BGL3可以作为竞争性内源RNA结合miR-17、miR-93、miR-20a、miR-20b、miR-106a和miR-106b来交叉调节PTEN表达, 同时Bcr-Abl通过c-Myc依赖性DNA甲基化抑制lncRNA-BGL3表达。所有结果揭示了Bcr-Abl介导的细胞转化关键需要肿瘤抑制因子lncRNA-BGL3的沉默, 并且提出了用于治疗Bcr-Abl阳性白血病的潜在策略。综上可见, lncRNA在白血病的发生、发展中发挥重要作用, 是白血病诊断的潜在标志物, 也是白血病治疗的潜在靶标。
本研究探讨了lncRNA LINC01140在AML患者及细胞中的表达情况, 以及干扰其表达对U937细胞增殖和周期的影响。LncRNA LINC01140位于人类1号染色体上, 长度为1 419 bp(https://www.ncbi.nlm.nih.gov/nuccore/NR_026989.1)。目前有关LINC01140仅有1篇, 并且是数据挖掘后的生物信息学分析[19]。本研究发现LINC01140在AML患者骨髓白细胞及U937、NB4、Kasuni-1中高表达, 采用慢病毒感染U937细胞来下调LINC01140表达后, 通过检测细胞生长曲线和细胞克隆成球能力发现干扰其表达能够显著抑制细胞增殖, 表明该lncRNA在急性髓系白血病中能够促进肿瘤细胞增殖, 是潜在的诊断标志物和治疗靶标。
流式细胞术检测结果显示LINC01140能够导致U937细胞周期G1期阻滞, Western blot检测结果也发现与G1期阻滞相关蛋白Cyclin E1表达降低, p21和p27表达升高, 进一步验证了干扰LINC01140表达后细胞周期G1期阻滞, 从而抑制肿瘤细胞生长。
生物信息学分析发现, LINC01140可能与转录因子、mRNA、蛋白等相互作用, 如STAT1、c-MYC、HNRNPA1等。结合现有的研究结果, 猜测c-MYC可能作为LINC01140的靶标。c-MYC基因是一种常见的原癌基因, 能够多方面、多水平地调控细胞周期G1期。比如可以直接抑制p27和p16的细胞周期阻滞功能。也可以使DNA解链或断裂, 引发DNA损伤, 从而激活下游的ATM及其效益因子, 进一步引发p53活化, 导致细胞周期阻滞[20]。因此, 根据生物信息学分析和现有实验结果, 猜测可能的调控机制是LINC01140/c-MYC/p27或LINC01140/c-MYC/p53/p21途径引发细胞周期G1期阻滞, 从而抑制细胞增殖。
综上所述, 本研究证实了lncRNA LINC01140在AML患者中高表达, 并且发现了新的影响白血病细胞U937增殖的lncRNA, 干扰该lncRNA表达后明显阻断细胞G1期, 从而抑制细胞增殖。该发现提供了潜在疾病诊断新指标和药物治疗新靶点, 具有较好的应用前景, 但是具体机制仍需进一步深入研究。
| [1] | ESTEY E, DÖHNER H. Acute myeloid leukaemia[J]. Lancet, 2006, 368(9550): 1894–1907. DOI:10.1016/S0140-6736(06)69780-8 |
| [2] | TALLMAN M S, GILLILAND D G, ROWE J M. Drug therapy for acute myeloid leukemia[J]. Blood, 2005, 106(4): 1154–1163. DOI:10.1182/blood-2005-01-0178 |
| [3] | DOMBRET H, GARDIN C. An update of current treatments for adult acute myeloid leukemia[J]. Blood, 2016, 127(1): 53–61. DOI:10.1182/blood-2015-08-604520 |
| [4] | FORMAN S J, ROWE J M. The myth of the second remission of acute leukemia in the adult[J]. Blood, 2013, 121(7): 1077–1082. DOI:10.1182/blood-2012-08-234492 |
| [5] | PONTING C P, OLIVER P L, REIK W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009, 136(4): 629–641. DOI:10.1016/j.cell.2009.02.006 |
| [6] | WANG Y, HE L, DU Y, et al. The long noncoding RNA lncTCF7 promotes self-renewal of human liver cancer stem cells through activation of Wnt signaling[J]. Cell Stem Cell, 2015, 16(4): 413–425. DOI:10.1016/j.stem.2015.03.003 |
| [7] | LENNOX K A, BEHLKE M A. Cellular localization of long non-coding RNAs affects silencing by RNAi more than by antisense oligonucleotides[J]. Nucleic Acids Res, 2016, 44(2): 863–877. DOI:10.1093/nar/gkv1206 |
| [8] | SCHMITT A M, CHANG H Y. Long noncoding RNAs in cancer pathways[J]. Cancer Cell, 2016, 29(4): 452–463. DOI:10.1016/j.ccell.2016.03.010 |
| [9] | GONG C, LI Z, RAMANUJAN K, et al. A long non-coding RNA, LncMyoD, regulates skeletal muscle differentiation by blocking IMP2-mediated mRNA translation[J]. Dev Cell, 2015, 34(2): 181–191. DOI:10.1016/j.devcel.2015.05.009 |
| [10] | YANG X, SONG J H, CHENG Y, et al. Long non-coding RNA HNF1A-AS1 regulates proliferation and migration in oesophageal adenocarcinoma cells[J]. Gut, 2014, 63(6): 881–890. DOI:10.1136/gutjnl-2013-305266 |
| [11] | MARTENS-UZUNOVA E S, B TTCHER R, CROCE C M, et al. Long noncoding RNA in prostate, bladder, and kidney cancer[J]. Eur Urol, 2014, 65(6): 1140–1151. DOI:10.1016/j.eururo.2013.12.003 |
| [12] | QUINN J J, CHANG H Y. Unique features of long non-coding RNA biogenesis and function[J]. Nat Rev Genet, 2016, 17(1): 47–62. DOI:10.1038/nrg.2015.10 |
| [13] | FLYNN R A, CHANG H Y. Long noncoding RNAs in cell-fate programming and reprogramming[J]. Cell Stem Cell, 2014, 14(6): 752–761. DOI:10.1016/j.stem.2014.05.014 |
| [14] | ATIANAND M K, CAFFREY D R, FITZGERALD K A. Immunobiology of long noncoding RNAs[J]. Annu Rev Immunol, 2017, 35: 177–198. DOI:10.1146/annurev-immunol-041015-055459 |
| [15] | BATISTA P J, CHANG H Y. Long noncoding RNAs:cellular address codes in development and disease[J]. Cell, 2013, 152(6): 1298–1307. DOI:10.1016/j.cell.2013.02.012 |
| [16] | HIRANO T, YOSHIKAWA R, HARADA H, et al. Long noncoding RNA, CCDC26, controls myeloid leukemia cell growth through regulation of KIT expression[J]. Mol Cancer, 2015, 14: 90. DOI:10.1186/s12943-015-0364-7 |
| [17] | TRIMARCHI T, BILAL E, NTZIACHRISTOS P, et al. Genome-wide mapping and characterization of Notch-regulated long noncoding RNAs in acute leukemia[J]. Cell, 2014, 158(3): 593–606. DOI:10.1016/j.cell.2014.05.049 |
| [18] | GUO G, KANG Q, ZHU X, et al. A long noncoding RNA critically regulates Bcr-Abl-mediated cellular transformation by acting as a competitive endogenous RNA[J]. Oncogene, 2015, 34(14): 1768–1779. DOI:10.1038/onc.2014.131 |
| [19] | SONG P, JIANG B, LIU Z, et al. A three-lncRNA expression signature associated with the prognosis of gastric cancer patients[J]. Cancer Med, 2017, 6(6): 1154–1164. DOI:10.1002/cam4.1047 |
| [20] | DANG C V. MYC on the path to cancer[J]. Cell, 2012, 149(1): 22–35. DOI:10.1016/j.cell.2012.03.003 |



