肾细胞癌是一种较为常见、侵袭性强的恶性肿瘤,约30%的患者在首次就诊时已发生转移[1]。其中,透明细胞癌约占肾细胞癌的80%,其恶性程度高于乳头状癌和嫌色细胞癌[2]。目前CT、MRI等影像技术可较为准确地诊断直径≥10 mm的肾脏肿瘤,但对发现直径更小的肿瘤仍有一定的困难,且在良恶性肿瘤的鉴别方面仍存在一些不足,约20%影像学高度怀疑恶性肿瘤的患者术后病理证实为良性病变[3]。相关研究证实,具有高度特异性的靶向超声造影剂是超声分子显像的基础,能为肿瘤的早期准确诊断提供有效方法。其中,粒径小、穿透力强的纳米级超声造影剂可通过肿瘤的增强渗透和滞留效应(enhanced permeability and retention effect,EPR)穿过肿瘤血管壁进入肿瘤组织间隙中,实现肿瘤实质细胞的超声分子显像[4-5]。碳酸酐酶Ⅸ(carbonic anhydrase Ⅸ,CAⅨ)为碳酸酐酶家族成员,能可逆性催化CO2的水合生成HCO3-和H+,营造成胞内中性偏碱、胞外偏酸的微环境,其中胞内偏碱能促进肿瘤细胞的生存、生长,细胞外偏酸有利于肿瘤细胞的侵袭、转移。CAⅨ在肾透明细胞癌中高表达,而在正常肾脏组织中不表达,且其是肿瘤形成过程中的早期事件,已成为肾透明细胞癌早期诊断的特异性靶点。本课题组前期已经制备出粒径≤700 nm的靶向纳米泡,并通过体内外实验证实其能有效聚集于肾癌移植瘤组织中,实现肾癌的超声分子显像[6-7],但对其早期诊断肿瘤的能力、在肿瘤生长过程中的显像特征和规律缺乏深入探索。本研究拟应用携载CAⅨ多肽的靶向纳米泡动态监测肾癌皮下移植瘤的形成过程,深入探讨和研究肾癌移植瘤形成过程中的超声分子显像特点和规律,尤其是探寻靶向纳米泡早期诊断恶性肿瘤的能力。
1 材料与方法 1.1 材料和仪器 1.1.1 细胞和裸鼠肾透明细胞癌786-O细胞购于中国上海科学院细胞库,BLBA/c雄性裸鼠5只(购自北京华阜康生物科技股份有限公司),共4~5周龄,体质量(18.1±1.5) g,SPF条件下饲养[陆军军医大学(第三军医大学)第一附属医院中心实验室]。
1.1.2 试剂和仪器小鼠抗人CAⅨ单克隆抗体购于Abcam公司,胎牛血清购于BI公司,细胞培养基RPMI 1640购于Gibco公司;二苯基磷酰基叠氮化物(Diphenyl phosphory azide,DPPA)、二棕榈酰磷脂酰胆碱(1,2-Dipalmitoul-sn-glycero-3-phosphocholine,DPPC)、二棕榈酰磷脂酰乙醇胺(1,2-Dipalmitoyl -sn-glycero-3-hosphatidic ethanolamine,DPPE)、二棕榈酰磷脂酰甘油(1,2-Dipalmitoyl-sn-glycero-3-phosphoglycerol,DPPG)购于Corden Pharma,二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-生物素(biotin-modified 1,2-distearoyl-sn-glyc-ero-3-phosphoethanolamine,DSPE-PEG 2000-biotin)购于NANOCS;SonoVue购于Bracco公司,vevo2100小动物成像仪、麻醉系统购于FujiFilm Visualsonics。
1.2 方法 1.2.1 细胞培养肾透明细胞癌786-O细胞培养于含有10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素的RPMI1640培养液中,在含有5% CO2的37 ℃细胞培养箱中培养,每2~3天传代。
1.2.2 模型建立用0.25%胰酶将融合达80%~90%的786-O细胞消化制成单细胞悬液,调整细胞至1×107/mL,取0.2 mL细胞悬液与等量基质胶混匀后接种于雄性BLBA/c裸鼠背部皮下,并饲养于SPF环境中。
1.2.3 纳米泡的制备前期课题组制备的靶向纳米泡和空白纳米泡的粒径分别为(503.7±78.5) nm和(428.1±41.8) nm[7]。具体制备方法如下:将DPPA、DPPC、DPPG、DPPE及生物素化的DSPE-PEG(2000)按一定比例融于甘油与PBS混合液中(比例为1 :9),振荡过夜后移至西林瓶中,用全氟丙烷置换瓶中上层空气,ST银汞胶囊调和器振荡后,于4 ℃冰箱中静置过夜,分别以300×g和300 r/min离心2次,3 min/次,去除脂质残渣和上层微米泡后获得空白纳米泡,依次加入一定比例的亲和素及生物素化CAⅨ多肽后获得靶向纳米泡。
1.2.4 体内成像实验将裸鼠置于高浓度异氟烷麻醉诱导箱中快速麻醉,取出后以俯卧位固定于操作台上,采用低剂量异氟烷持续吸入麻醉。充分暴露裸鼠背部注射部位后,使用vevo2100小动物超声成像仪和S250高频探头(中心频率20 MHz)进行扫查。在皮下种植后第1天行二维超声扫查,观察注射部位、范围和回声特点。皮下种植后第7天和第14天分别行二维、彩色多普勒血流显像(color doppler flow imaging,CDFI)和超声造影检查,包括携载CAⅨ多肽的靶向纳米泡、空白纳米泡及临床用微米级超声造影剂SonoVue,粒径为2~5 μm(Bracco,意大利),监测移植瘤种植部位回声的变化特点。常规采集二维及CDFI图像,并测量肿瘤各径的大小。调节至超声造影模式,用1 mL注射器经裸鼠尾静脉随机注射200 μL 5×108/mL的靶向、空白纳米泡或微米泡超声造影剂,同时连续动态采集造影图像。采用随机顺序注射3种造影剂,待第一种造影剂回声基本消退后,启动仪器burst键爆破残余造影剂,待其回声完全消退后1 h,同法注射另一种造影剂。将采集的图像使用vevo2100小动物超声成像仪自带定量软件对时间强度曲线进行分析,从中提取达峰时间、峰值强度、峰值降半时间、峰值降半曲线下面积4个指标进行比较。
1.2.5 HE染色超声造影显像结束后第2天,颈椎脱臼处死裸鼠,取出移植瘤组织,在4%多聚甲醛中固定48 h,经梯度酒精脱水、二甲苯透明、组织块石蜡包埋、切片、HE染色、脱水透明等步骤后中性树胶封片。
1.2.6 肿瘤组织CAⅨ蛋白表达检测取出移植瘤组织和癌旁组织经常规固定、包埋、切片、脱蜡、抗原修复、血清封闭后加入抗CAⅨ抗体,4 ℃孵育过夜,磷酸盐缓冲液冲洗,加入HRP标记的山羊抗小鼠二抗,37 ℃孵育30 min,磷酸盐缓冲液冲洗,DAB显色后清水充分冲洗,复染,脱水透明,中性树胶封片。
1.3 统计学处理使用SPSS 22.0统计软件对数据进行分析,计量资料用x±s表示,对3种造影剂造影数据进行单因素方差分析。
2 结果 2.1 动态监测皮下移植瘤的形成过程及其超声图像特征皮下移植瘤种植后第1天,二维超声图像显示移植瘤种植部位为均匀稍低回声,种植部位平均体积见表 1。移植瘤种植后第7天,种植部位的回声未见明显改变,但范围缩小;CDFI:低回声内及周边均无血流信号;分别应用微米泡、空白纳米泡和靶向纳米泡超声造影显示,种植部位周边均呈高增强,内部呈无增强,3种造影剂的模式无明显差异。移植瘤种植后第14天,种植部位可见稍凸包块,种植部位的二维超声图像仍为均匀稍低回声,但范围减小,5个移植瘤的各径均<1.5 mm,其中最大径为1.4 mm;CDFI:稍低回声内可见少许血流信号,分别应用微米泡、空白纳米泡、及靶向纳米泡超声造影显示,3种造影剂在移植瘤种植部位均呈均匀高增强,且靶向纳米泡的显像效果明显优于空白纳米泡和微米泡。见图 1。
| 种植时间 | 长(mm) | 宽(mm) | 体积(mm3) |
| 1 d | 3.67±0.15 | 2.52±0.11 | 12.25±1.50 |
| 7 d | 2.69±0.20 | 1.63±0.14 | 3.75±0.76 |
| 14 d | 1.41±0.04 | 1.38±0.11 | 1.43±0.26 |

|
| A:种植后第1天超声二维图像;B~F:皮下种植后第7天的二维、CDFI、靶向纳米泡、空白纳米泡、微米泡超声造影图像;G~K:第14天的二维、CDFI、靶向纳米泡、空白纳米泡和微米泡超声造影图像;L:第14天移植瘤解剖标本 图 1 裸鼠肾癌皮下移植瘤形成过程 |
2.2 移植瘤的超声造影图像特征及其定量分析
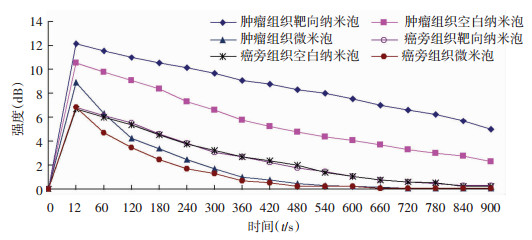
超声造影显示,裸鼠肿瘤种植部位与周围组织相比,3种造影剂动脉和静脉期均呈均匀高增强,使用vevo2100内置图像定量分析软件,将移植瘤组织和癌旁组织勾勒为感兴趣区,分别比较两个部位中靶向纳米泡、空白纳米泡和微米泡的显像特点。在移植瘤组织中,靶向纳米泡、空白纳米泡和微米泡的达峰时间差异无统计学意义(P>0.05),但靶向纳米泡的峰值强度、峰值降半时间、峰值降半曲线下面积明显大于空白纳米泡和微米泡(P < 0.05),空白纳米泡的峰值强度、峰值降半时间和峰值降半曲线也显著高于微米泡(P < 0.05)。在癌旁组织中,靶向和空白纳米泡的达峰时间、峰值强度、峰值降半时间和峰值降半曲线下面积差异均无统计学意义(P>0.05)。靶向纳米泡和空白纳米泡的达峰时间和峰值强度与微米泡差异无统计学意义(P>0.05),但二者的峰值降半时间和峰值降半曲线下面积明显大于微米泡(P < 0.05)。见表 2、图 2。
| 组织 | 造影剂 | 达峰时间(s) | 峰值强度(dB) | 峰值降半时间(s) | 峰值降半曲线下面积(dB·s) |
| 肿瘤 | 靶向纳米泡 | 11.86±1.98 | 12.18±0.39ab | 801.4±87.84ab | 967.25±44.17ab |
| 空白纳米泡 | 11.83±2.38 | 10.53±0.96b | 476.35±90.35b | 554.25±162.37b | |
| 微米泡 | 11.77±1.65 | 8.94±0.67 | 116.8±35.42 | 248.40±62.15 | |
| 癌旁 | 靶向纳米泡 | 11.85±1.98 | 6.85±0.45 | 264.20±90.26b | 351.62±86.90b |
| 空白纳米泡 | 11.82±2.16 | 6.69±0.78 | 273.55±92.51b | 368.27±72.97b | |
| 微米泡 | 11.80±1.74 | 6.88±0.34 | 118.4±43.26 | 190.20±31.53 | |
| a:P < 0.05,与空白纳米泡比较;b:P < 0.05,与微米泡比较 | |||||
|
| 图 2 裸鼠肾癌皮下移植瘤及癌旁组织超声造影时间-强度曲线 |
2.3 肾癌皮下移植瘤鉴定
超声造影结束后,取出皮下移植瘤进行鉴定。5只裸鼠全部建模成功,瘤体未与皮肤粘连,表面光滑,质地稍硬,呈灰白色(图 3A)。HE染色鉴定,光镜下可见大量梭性、多角形细胞,细胞异型性大,细胞核较大,核型不规则,可见核仁和核分裂现象(图 3B)。

|
| A:大体观察;B:HE染色观察(LM ×200) 图 3 裸鼠肾癌皮下移植瘤组织学鉴定结果 |
2.4 CAⅨ的表达情况
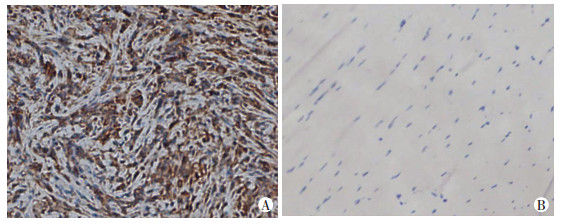
免疫组织化学染色显示,786-O移植瘤组织中CAⅨ阳性反应细胞达90%以上,均匀分布于整个移植瘤组织内,且棕褐色颗粒主要分布于细胞膜上(图 4A)。癌旁组织中未见CAⅨ阳性反应细胞(图 4B)。
|
| A:移植瘤组织;B:癌旁组织 图 4 裸鼠肾癌皮下移植瘤组织免疫组化管检测CAⅨ的表达(二步法×200) |
3 讨论
肿瘤TNM分期与术后生存率密切相关,T1期肾癌患者手术后5年生存率可高达95%,因此早期诊断和及早治疗决定了肾癌患者的预后[8]。超声造影技术可清晰显示良恶性肿瘤不同的微循环特征,已在多种恶性肿瘤的诊断和鉴别诊断中发挥重要的临床价值[9]。由于目前临床用超声造影剂的直径为微米级,是一种血池内造影剂,仅能通过肿瘤新生血管特点来鉴别肿块的良恶性,对于一些肿瘤的早期诊断和鉴别诊断仍有一定的局限性[10]。相关研究显示,粒径在700 nm以下的靶向纳米泡可穿过肿瘤血管壁,特异性结合肿瘤实质细胞,理论上能在分子水平实现恶性肿瘤的早期诊断。由于CAⅨ是一种跨膜蛋白,在肾癌、乳腺癌、宫颈癌等多种肿瘤的生长和转移过程中发挥着重要作用[11-12]。我们的前期研究已经证实,靶向纳米泡能穿过肿瘤血管进入到肿瘤组织间隙中,实现肿瘤的特异性超声分子显像[7]。但与空白纳米泡、微米泡相比,靶向纳米泡早期诊断肿瘤的能力、在肿瘤生长过程中的显像特征和规律尚不清楚,需要进一步探讨。因裸鼠缺乏胸腺组织,可避免供体与受体之间组织相容抗原不同而引起的免疫排斥反应,显著提高肿瘤种植的成功率。相关研究显示人类肿瘤细胞在裸鼠上异种移植能保持原有肿瘤的形态学、生物学、生物化学特征,较好地模拟人类原发肿瘤的生长过程和行为[13]。因此,本研究拟在前期研究的基础上,分别应用携载CAⅨ多肽的靶向纳米泡、空白纳米泡和临床用微米泡动态监测裸鼠肾癌皮下移植瘤的形成过程,对比研究和分析3种超声造影剂在肾癌移植瘤形成过程中的显像特点和规律,探讨靶向纳米泡在诊断微小恶性肿瘤中的能力。
本研究结果显示,皮下移植瘤种植后第1、7、14天,二维灰阶图像上种植部位均为均匀的稍低回声,难以准确判断肿瘤是否形成,可能与细胞悬液浓度较大、仪器分辨率高有关。超声造影显示,皮下移植瘤种植后第7天,种植部位的周边可见明显灌注增强,但其内部无明显增强,提示注射部位细胞悬液的周边先形成移植瘤组织,而其内部未形成移植瘤组织,仍为未吸收的细胞悬液。皮下移植瘤种植后第14天,移植瘤组织的长径均<1.5 mm,超声造影示3种造影剂均能显著均匀增强全部皮下移植瘤组织的显像强度,提示注射的细胞悬液被完全吸收,皮下移植瘤组织已完全形成。HE染色进一步证实移植瘤组织切片的形态和超微结构为典型肾透明细胞癌表现。定量分析3种超声造影剂动态图像显示,靶向纳米泡、空白纳米泡和微米泡在肾癌皮下移植瘤组织中具备不同的显像特点,在峰值强度、峰值降半时间、峰值降半曲线下面积指标中,靶向纳米泡组>空白纳米泡组>微米泡组,差异均有统计学意义。由于本研究显示肾癌移植瘤组织高表达CAⅨ,前期研究结果证实,针对CAⅨ构建的靶向纳米泡能够穿过肿瘤血管进入肿瘤组织间隙中,靶向聚集在CAⅨ表达阳性移植瘤组织中[7],分析其原因可能是肾癌移植瘤组织内的CAⅨ蛋白对靶向纳米泡的吸附作用,使其大量聚集、结合于肾癌细胞周围,而CAⅨ蛋白对空白纳米泡无特异性吸附结合作用,尽管其能通过肿瘤血管内皮壁进入肿瘤组织间隙内,但数量远小于靶向纳米泡。微米泡为血池造影剂,不能进入肿瘤组织间隙,且因其粒径较大,在血液循环中的稳定性不如纳米泡,所以其峰值强度特别是持续时间最低。由于癌旁正常组织不表达CAⅨ,且其血管内皮间隙正常,因此3种造影剂信号皆为癌旁组织血液循环内信号,并在达峰时间和峰值强度差异无统计学意义。在峰值降半时间和峰值降半曲线下面积,靶向纳米泡和空白纳米泡差异无统计学意义;微米泡因粒径较大,稳定性不如纳米泡,所以其峰值降半时间较2种纳米泡短,峰值降半曲线下面积较2种纳米泡小。通过定量分析3种造影剂在移植瘤组织和癌旁组织不同超声增强显像特点,进一步证明携载CAⅨ多肽的靶向纳米泡稳定性好,对直径<1.5 mm的微小肿瘤具有特异性增强显像效果。
总之,本研究应用携载CAⅨ多肽靶向纳米泡、空白纳米泡和临床用微米泡动态监测裸鼠肾癌移植瘤的形成过程,对比分析3种造影剂在直径<1.5 mm皮下移植瘤组织中的显像特征和规律。与空白纳米泡和临床用微米泡相比,携载CAⅨ多肽的靶向纳米泡的显像效果具有特征性改变,即其峰值强度、峰值降半时间和峰值降半曲线下面积明显大于空白纳米泡和微米泡,表明靶向纳米泡有利于微小肿瘤的特异性超声分子显像。
| [1] | LAM J S, LEPPERT J T, FIGLIN R A, et al. Role of molecu-lar markers in the diagnosis and therapy of renal cell carcinoma[J]. Urology, 2005, 66(5): 1–9. DOI:10.1016/j.urology.2005.06.112 |
| [2] | TOSTAIN J, LI G, GENTIL-PERRET A, et al. Carbonic anhydrase 9 in clear cell renal cell carcinoma: a marker for diagnosis, prognosis and treatment[J]. Eur J Cancer, 2010, 46(18): 3141–3148. DOI:10.1016/j.ejca.2010.07.020 |
| [3] | NISHIKAWA M, MIYAKE H, KITAJIMA K, et al. Preoperative differentiation between benign and malignant renal masses smaller than 4 cm treated with partial nephrectomy[J]. Int J Clin Oncol, 2015, 20(1): 150–155. DOI:10.1007/s10147-014-0673-7 |
| [4] | IYER A K, KHALED G, FANG J, et al. Exploiting the permeability and retention effect for tumor targeting[J]. Drug Discovery Today, 2006, 11(17-18): 812–818. DOI:10.1016/j.drudis.2006.07.005 |
| [5] | FAN X, WANG L, GUO Y, et al. Experimental investigation of the penetration of ultrasound nanobubbles in a gastric cancer xenograft[J]. Nanotechnology, 2013, 24(32): 325102. DOI:10.1088/0957-4484/24/32/325102 |
| [6] |
朱连华, 郭燕丽, 范校周, 等. 抗CAⅨ蛋白多糖区多肽的合成及其寻靶能力[J].
第三军医大学学报, 2016, 38(17): 1905–1909.
ZHU L H, GUO Y L, FAN X Z, et al. Synthesis of anti-CAⅨ proteoglycan-like region peptide and evaluation of its target binding ability[J]. J Third Mil Med Univ, 2016, 38(17): 1905–1909. DOI:10.16016/j.1000-5404.201601172 |
| [7] | ZHU L, GUO Y, WANG L, et al. Construction of ultrasonic nanobubbles carrying CAⅨ polypeptides to target carcinoma cells derived from various organs[J]. J Nanobiotechnol, 2017, 15(1): 63. DOI:10.1186/s12951-017-0307-0 |
| [8] | FIORI E, DE A C, CROCETTI D, et al. Good results of surgery for renal cell carcinoma depend on early diagnosis. The need for an extensive screening program[J]. Annali Italiani Di Chirurgia, 2016, 87: 41–44. |
| [9] |
戴晴, 姜玉新. 超声造影的临床应用[J].
中国医学科学院学报, 2008, 30(1): 1–4.
DAI Q, JIANG Y X. Clinical applications of contrast-enhanced ultrasound[J]. Acta Acad Med Sine, 2008, 30(1): 1–4. DOI:10.3321/j.issn:1000-503X.2008.01.001 |
| [10] | BZYL J, PALMOWSKI M, RIX A, et al. The high angiogenic activity in very early breast cancer enables reliable imaging with VEGFR2-targeted microbubbles (BR55)[J]. Eur Radiol, 2013, 23(2): 468–475. DOI:10.1007/s00330-012-2594-z |
| [11] | TAFRESHI N K, LLOYD M C, BUI M M, et al. Carbonic anhydrase Ⅸ as an imaging and therapeutic target for tumors and metastases[M]// Carbonic Anhydrase: mechanism, regulation, links to disease, and industrial applications. Springer Netherlands, 2014: 221-254. DOI: 10.1007/978-94-007-7359-2_12. |
| [12] | MAHON B P, PINARD M A, MCKENNA R. Targeting carbonic anhydrase Ⅸ activity and expression[J]. Molecules, 2015, 20(2): 2323–2348. DOI:10.3390/molecules20022323 |
| [13] | KYRIAZIS A P, KYRIAZIS A A, RD M C W, et al. Biological behavior of human malignant tumors grown in the nude mouse[J]. Cancer Res, 1981, 41(10): 3995–4000. |



