2. 400014 重庆, 重庆市药品技术审评认证中心
2. Food and Drug Administration, Chongqing, 400014, China
高能量创伤常常会引起复杂的四肢损伤和较大节段的骨缺损[1]。在骨缺损重建治疗方面, 近年来, 诱导膜技术深受医学界的重视。诱导膜技术又称Masquelet技术[2], 最早由法国学者MASQUELET[3]提出, 其主要方法为一期行PMMA骨水泥填充缺损, 二期取出骨水泥, 在诱导膜包壳中植入自体松质骨, 实现缺损重建[4]。Masquelet技术的核心是应用PMMA骨水泥在骨缺损部位达到有效的占位, 其一方面的作用可以阻止纤维组织侵入骨缺损区域, 另一方面是在其周围通过异物反应而形成诱导膜组织[5]。诱导膜是为包裹在其中的移植骨提供血供来源的关键[2], 与此同时它也提供了成骨相关生长因子, 比如BMP-2、VEGF、TGF-β1[6-8]。在诱导膜的一系列作用下, 移植骨才能有效的实现骨传导、骨诱导和骨形成功能[9]。大量临床数据表明, Masquelet技术在处理创伤后骨缺损、慢性骨髓炎、骨不连和肿瘤切除遗留骨缺损治疗方面确有疗效[1-2, 10], 特别是对处理长度大于20 cm的骨缺损都能实现有效重建[11]。近期关于诱导膜技术临床研究的Meta分析指出, 诱导膜技术可以使89.7%病例实现骨愈合, 感染清除率达到91.1%[10]。临床结果令人振奋, 但我们对诱导膜特性和作用机制的理解仍有局限, 需要更进一步的基础实验研究。目前, 限制基础研究深入开展的重要原因是尚未成功构建较为可行、易重复、应用范围广泛的小动物实验模型。
标准化的动物模型对于组织工程实验研究至关重要。为了深入研究诱导膜成骨机制, 近几年有科研团队分别采用白兔、大鼠等动物建立了相关的动物模型[6, 12-15]。已有的动物诱导膜模型虽然成功构建了诱导膜组织, 但在实验动物选择上仍有诸多问题:新西兰大白兔、大鼠等作为模型动物, 繁殖周期较长, 不易饲养, 骨缺损模型制造相对较为困难, 模型动物在分子生物学和免疫学领域应用相对较少, 不利于深入研究诱导膜的形成及作用机制的研究。相比之下, 小鼠作为模型动物, 来源广泛, 价格低廉, 生长周期短, 易于围术期管理, 耐受手术和抗感染能力强, 是进行诱导膜实验研究极为理想的模型动物。
迄今为止, 还没有文献报道标准的小鼠骨缺损诱导膜模型构建方法。为统一评价标准, 提高实验的可靠性和重复性, 本研究选取C57BL/6品系小鼠作为实验模型动物, 建立了成年小鼠股骨骨缺损诱导膜模型并评估其效果, 报告如下。
1 材料与方法 1.1 实验动物选择2~3月龄C57BL/6品系的健康成年小鼠(SPF级)18只, 雌性, 体质量(30.0±2.8)g, 饲养温度(25±2)℃, 相对湿度40%~70%, 购自陆军军医大学实验动物中心[使用许可证号:SYXK(渝)20170002]。本研究经过陆军军医大学实验动物伦理委员会审核, 符合动物伦理和动物福利要求(2017-10-08)。
1.2 解剖参数分析将6只小鼠颈椎脱臼法处死后分离解剖双侧股骨, 共收集12条股骨样本, 用游标卡尺测量股骨长度, 股骨干中部和小转子平面的相关解剖参数, 用于指导选择髓内针直径。
1.3 小鼠股骨骨缺损诱导膜模型的构建取12只2~3月龄的C57BL/6品系小鼠, 术前禁食4~6 h, 3%戊巴比妥钠(1.5 mL/kg)腹腔注射麻醉, 右侧股骨常规备皮并固定于手术台, 常规消毒铺巾, 采用侧卧位将小鼠固定于操作台上, 于大腿外侧作一长约1.5 cm皮肤切口, 沿股骨外侧白线钝性分离周围肌肉及软组织, 显露股骨。应用0.22 mm线锯在股骨中段处制造3 mm骨缺损; 截取合适长短的0.5 mm医用不锈钢钢丝作为髓内针; 将PMMA骨水泥制作成直径2 mm, 长度3 mm圆柱形占位器, 将髓内针穿入骨水泥占位器; 将髓内针从骨缺损处插入股骨远端后, 再将其插入股骨近端; 检查股骨固定满意后, 逐层缝合手术切口, 无菌敷料包扎。术后连续3 d碘伏消毒切口, 腹腔注射青霉素20万U/kg, 1次/d。小鼠苏醒后单独置于笼中饲养, 室温维持在(25±2)℃, 可进行自由活动以及进食和饮水。
1.4 X线片观察全部实验小鼠于术后1周拍摄X线片(Kodak自动活体成像设备, 柯达医疗公司), 观察PMMA骨水泥髓内钉系统有无断钉、滑脱、移位以及骨缺损段有无成角畸形等情况。
1.5 组织学观察4周后, 所有实验鼠存活良好, 采用颈椎脱臼法处死小鼠。
获取诱导膜切片:离断右下肢, 分离股骨周围肌群, 完整游离股骨, 显露股骨骨水泥表面诱导膜, 完整剥离诱导膜, 置于PBS溶液中保存。用4%的多聚甲醛溶液固定诱导膜组织, 石蜡包埋后制作4 μm厚度组织切片, 每个诱导膜组织切取5张石蜡切片, 行HE染色。
获取正常骨膜切片:离段左下肢, 分离股骨周围肌群, 完整游离股骨, 显露股骨表面骨膜, 将股骨连同表面骨膜置于PBS溶液中保存。用4%的多聚甲醛溶液固定72 h, 置于5%硝酸溶液中浸泡5 h脱钙, 石蜡包埋后制作4 μm厚度组织切片, 每个股骨组织切取5张石蜡切片, 进行HE染色。
2 结果 2.1 股骨标本解剖参数测量结果小鼠股骨标本测量结果如下:股骨长度为(14.96± 0.82)mm; 股骨中部:横径(1.26±0.28)mm, 矢状径为(1.96±0.24)mm, 髓腔直径为(0.82±0.16)mm; 小转子平面:髓腔直径为(0.61±0.12)mm, 骨髓腔在股骨颈起始横断面接近封闭, 大转子位于该平面上(2.31±0.23)mm。
2.2 手术情况本次实验选取12只小鼠进行手术, 1只因麻醉过深、1只因手术损伤股动脉分别于术中死亡, 后予以补齐。术后小鼠进食良好, 3 d内小鼠术侧由于疼痛成保护性活动, 可在笼内自由活动; 手术伤口愈合良好, 无感染等征象。
2.3 X线片观察结果术后1周拍摄X线片确认内固定情况, 1只小鼠因髓内钉选取长度过短, 从断端退出, 出现股骨成角畸形, 近端髓内钉位于髓腔外侧; 其余11只实验鼠内固定牢靠, 未出现移位、滑脱征象。内固定成功率91.7%。见图 1。

|
| B图为A图局部放大 图 1 小鼠PMMA骨水泥股骨髓内钉固定术后X线片表现 |
2.4 组织学染色结果
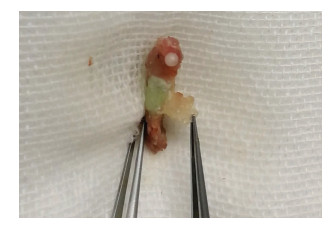
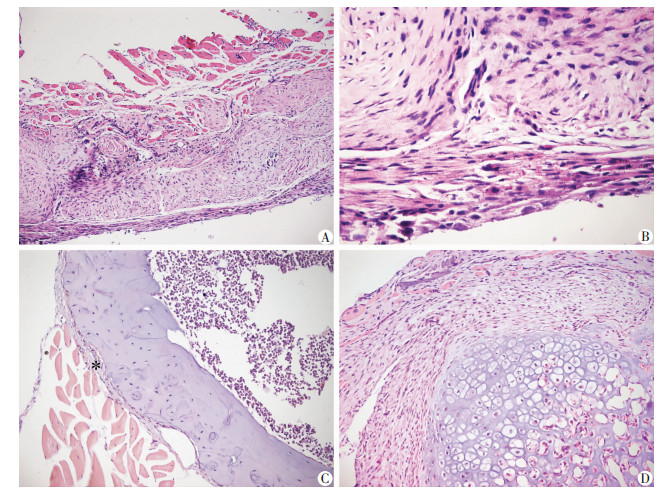
术后4周获取手术侧股骨:股骨骨水泥接触端膨大, 周围大量纤维软组织包裹; 骨水泥表面覆盖滑膜样组织; 切取并展开该组织, 其面积大小(16.1±2.3)mm2 (图 2), 厚度为200~700 μm。HE染色结果显示:诱导膜和骨膜均有分界明显的两层, 内层含丰富的新生血管组织, 外层为成纤维细胞和胶原组织; 诱导膜组织中可见处于不同时期的新生软骨组织以及大量炎症细胞浸润(图 3); 炎症细胞主要聚集在诱导膜近骨水泥缘。股骨骨缺损断端与骨水泥接触间隙可见大量软骨形成。
|
| 图 2 小鼠骨水泥表面诱导膜大体观 |
|
| A:诱导膜组织(×100);B:诱导膜组织(×400);C:正常骨膜(×100);D:诱导膜与正常骨交界区(×100);*:骨膜区域 图 3 小鼠术后4周诱导膜组织病理学变化(HE) |
3 讨论 3.1 模型动物的选择
近几年来, 有多位学者相继报道了骨缺损诱导膜模型的动物实验研究。国内谢肇团队构建了白兔桡骨骨缺损诱导膜模型, 通过该模型研究了诱导膜成骨、成血管相关细胞因子含量随时间的变化情况, 探索了最佳的二期膜内植骨时间[15]。MONTIJO团队[16-17]应用AO大鼠髓内钉固定系统建立了大鼠股骨骨缺损诱导膜模型, 通过该模型研究了诱导膜的成骨、成软骨和成血管的基因组学特点; HENRICH团队[8]应用小动物股骨钢板系统建立了大鼠诱导膜模型, 并通过免疫组化手段揭示了不同部位诱导膜的细胞因子成分特点。白兔、大鼠作为模型动物, 由于体积庞大, 具备容易获取和观察诱导膜组织学特性的优势。然而, 由于其在分子生物学和免疫学领域应用相对较少, 不利于深入研究诱导膜的形成及作用机制, 而这也是导致相当一部分诱导膜动物实验研究止步于组织学研究层面的重要原因。鉴于此, 本研究选取C57BL/6品系小鼠作为模型动物。作为分子生物学各个研究领域中最常见的研究动物, C57BL/6品系小鼠测试条件成熟, 测试试剂全面, 便于应用多种实验手段深入开展诱导膜成骨相关机制的研究。
3.2 内固定材料及植入方法的选择股骨尺寸过小是建立小鼠骨缺损模型过程中面临的一大困难。既往有学者分别运用特制的大鼠、小鼠股骨钉板系统进行相关实验研究[8, 14, 18]。用钉板系统作为固定装置, 具备可承重、固定牢靠的优点。但操作较为复杂, 需要术者具备扎实的显微外科手术基础, 对模型的重复和推广有一定的限制。为此, 本研究创造性选取骨水泥髓内钉系统作为股骨骨缺损固定装置。此种固定装置能够重建小鼠股骨稳定性, 便于骨水泥植入, 极大降低了操作难度, 同时保证了股骨缺损后的解剖对位和正常承重。实验结果证明, 用骨水泥髓内钉作为小鼠股骨内固定材料, 具备足够的安全性和高效性, 建模成功率为91.7%, 每只动物模型构建可在15 min之内操作完成。
3.3 本实验模型构建的意义目前, 诱导膜技术已经成功应用于临床上大段骨缺损的治疗。然而, 关于诱导膜如何促进成骨相关机制以及其中的免疫细胞发挥作用却很少有学者深入研究, 大部分研究结果仅止步于组织学研究层面的报道。本实验成功构建了小鼠股骨骨缺损诱导膜模型, 解决了诸多实验技术难题, 为未来通过分子生物学和免疫学实验方法, 深入研究诱导膜的形成及作用机制提供了前期基础。
| [1] | OLESEN U K, ECKARDT H, BOSEMARK P, et al. The masquelet technique of induced membrane for healing of bone defects.a review of 8 cases[J]. Injury, 2015, 46(Suppl 8): S44–S47. DOI:10.1016/S0020-1383(15)30054-1 |
| [2] | GIANNOUDIS P V, FAOUR O, GOFF T, et al. Masquelet technique for the treatment of bone defects:tips-tricks and future directions[J]. Injury, 2011, 42(6): 591–598. DOI:10.1016/j.injury.2011.03.036 |
| [3] | MASQUELET A C, FITOUSSI F, BEGUE T, et al. Reconstruction of the long bones by the induced membrane and spongy autograft[J]. Ann Chir Plast Esthet, 2000, 45(3): 346–353. |
| [4] | APARD T, BIGORRE N, CRONIER P, et al. Two-stage reconstruction of post-traumatic segmental tibia bone loss with nailing[J]. Orthop Traumatol Surg Res, 2010, 96(5): 549–553. DOI:10.1016/j.otsr.2010.02.010 |
| [5] | PELISSIER P, MASQUELET A C, BAREILLE R, et al. Induced membranes secrete growth factors including vascular and osteoinductive factors and could stimulate bone regener-ation[J]. J Orthop Res, 2004, 22(1): 73–79. DOI:10.1016/S0736-0266(03)00165-7 |
| [6] | HULSART-BILLSTRÖM G, BERGMAN K, ANDERSSON B, et al. A uni-cortical femoral defect model in the rat:evaluation using injectable hyaluronan hydrogel as a carrier for bone morphogenetic protein-2[J]. J Tissue Eng Regen Med, 2015, 9(7): 799–807. DOI:10.1002/term.1655 |
| [7] | GRUBER H E, ODE G, HOELSCHER G, et al. Osteogenic, stem cell and molecular characterisation of the human induced membrane from extremity bone defects[J]. Bone Joint Res, 2016, 5(4): 106–115. DOI:10.1302/2046-3758.54.2000483 |
| [8] | HENRICH D, SEEBACH C, NAU C, et al. Establishment and characterization of the Masquelet induced membrane technique in a rat femur critical-sized defect model[J]. J Tissue Eng Regen Med, 2016, 10(10): E382–E396. DOI:10.1002/term.1826 |
| [9] | DIMITRIOU R, MATALIOTAKIS G I, ANGOULES A G, et al. Complications following autologous bone graft harvesting from the iliac crest and using the RIA:a systematic review[J]. Injury, 2011, 42(Suppl 2): S3–S15. DOI:10.1016/j.injury.2011.06.015 |
| [10] | MORELLI I, DRAGO L, GEORGE D A, et al. Masquelet technique:myth or reality? a systematic review and meta-analysis[J]. Injury, 2016, 47(Suppl 6): S68–S76. DOI:10.1016/S0020-1383(16)30842-7 |
| [11] | MOGHADDAM A, ZIETZSCHMANN S, BRUCKNER T, et al. Treatment of atrophic tibia non-unions according to 'diamond concept':results of one-and two-step treatment[J]. Injury, 2015, 46(Suppl 4): S39–S50. DOI:10.1016/S0020-1383(15)30017-6 |
| [12] | GRUBER H E, RILEY F E, HOELSCHER G L, et al. Osteogenic and chondrogenic potential of biomembrane cells from the PMMA-segmental defect rat model[J]. J Orthop Res, 2012, 30(8): 1198–1212. DOI:10.1002/jor.22047 |
| [13] | BOSEMARK P, PERDIKOURI C, PELKONEN M, et al. The masquelet induced membrane technique with BMP and a synthetic scaffold can heal a rat femoral critical size defect[J]. J Orthop Res, 2015, 33(4): 488–495. DOI:10.1002/jor.22815 |
| [14] | MANASSERO M, DECAMBRON A, HUU THONG B T, et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis[J]. J Vis Exp, 2016(116): 52940. DOI:10.3791/52940 |
| [15] | WANG X H, WEI F D, LUO F, et al. Induction of granulation tissue for the secretion of growth factors and the promotion of bone defect repair[J]. J Orthop Surg Res, 2015, 10: 147. DOI:10.1186/s13018-015-0287-4 |
| [16] | GRUBER H E, GETTYS F K, MONTIJO H E, et al. Genomewide molecular and biologic characterization of biomembrane formation adjacent to a methacrylate spacer in the rat femoral segmental defect model[J]. J Orthop Trauma, 2013, 27(5): 290–297. DOI:10.1097/BOT.0b013e3182691288 |
| [17] | MONTIJO H E, KELLAM J F, GETTYS F K, et al. Utilization of the AO LockingRatNail in a novel rat femur critical defect model[J]. J Invest Surg, 2012, 25(6): 381–386. DOI:10.3109/08941939.2012.655370 |
| [18] |
靳慧勇, 侯天勇, 罗飞, 等. 小鼠股骨临界骨缺损模型的构建及评估[J].
第三军医大学学报, 2011, 33(22): 2331–2334.
JIN H Y, HOU T Y, LUO F, et al. Establishment and evaluation of mouse femur critical bone defect model[J]. J Third Mil Med Univ, 2011, 33(22): 2331–2334. |



