2. 621000 四川 绵阳,绵阳市中心医院放射科
2. Department of Radiology, Mianyang Central Hospital, Mianyang, Sichuan Province, 621000, China
干细胞活体示踪是分子影像学领域的重要研究内容之一[1-3]。目前利用磁共振成像(magnetic resonance imaging, MRI)对干细胞示踪主要有两种方法,即磁标记直接成像和报告基因间接成像。其中,后者由于报告基因在细胞内持续表达而能实现对细胞的长期示踪[4-5]。本课题组利用铁蛋白重链(ferritin heavy chain 1,FTH1)报告基因标记干细胞,并在其增殖分化过程中进行MRI显像,结果显示报告基因在干细胞及其分化的神经元样细胞内均有明显表达并引起MRI信号改变[6]。然而,在实际应用中,该方法并不能对干细胞及其分化的神经元样细胞进行有效地区分显示,即无法根据MRI信号的变化来判断干细胞何时分化为神经元样细胞。利用组织特异性启动子控制报告基因在特定组织或细胞内表达,有可能实现报告基因成像对干细胞神经分化的监测[7-8]。本研究通过构建神经元特异性烯醇化酶(neuron-specifc enolase,NSE)启动子控制FTH1基因(NSE-FTH1)表达的慢病毒载体并转染骨髓间充质干细胞(bone marrow mesenchymal stem cells, MSCs),检测其在成神经分化过程中报告基因的表达情况,观察MRI信号改变,探讨NSE启动子报告基因成像监测MSCs成神经分化的可行性。
1 材料与方法 1.1 材料 1.1.1 细胞选择体质量约50 g的4周龄SD大鼠(重庆医科大学实验动物中心提供),采用细胞贴壁筛选法提取原代细胞,传代培养至第3代备用。
1.1.2 NSE启动子、FTH1基因、慢病毒载体及包装系统CMV-FTH1、CMV-LV慢病毒来自于上海吉凯基因化学技术有限公司,其余委托重庆威斯腾生物医药科技有限责任公司合成。
1.1.3 主要试剂引物合成和测序由重庆威斯腾生物医药科技有限责任公司完成,胎牛血清、DMEM培养基购自Gibco公司,枸橼酸铁铵(ferric ammonium citrate, FAC)购自Sigma公司,荧光定量PCR试剂购自威斯腾生物医药科技有限责任公司,CCK-8试剂盒购自Beyotime公司,普鲁士蓝染色试剂盒购自广州凯秀贸易有限公司,细胞全蛋白提取试剂盒购自凯基公司,Western blot:一抗兔单抗FTH1、鼠单抗β-actin购自Abcam公司,二抗羊抗兔、羊抗鼠购自Sigma公司;免疫荧光:一抗鼠单抗NSE、兔单抗巢蛋白、兔单抗微管相关蛋白-2(microtubule associated protein-2,MAP-2)、二抗羊抗兔、羊抗鼠购自Proteintech公司。
1.2 方法 1.2.1 重组慢病毒载体质粒的构建连接NSE启动子、FTH1基因cDNA序列,与载体LV5进行酶切、连接、转化,获得重组慢病毒载体质粒LV5-NSE-FTH1-GFP-Puro,通过鉴定成功后转染293T细胞,48 h后浓缩并收集病毒,标记为NSE-FTH1。采用逐孔稀释滴度测定法测定病毒滴度,同时构建空载病毒NSE-LV作为对照。
1.2.2 MSCs干性鉴定胰酶消化并收集第3代细胞,PBS清洗2次,各管依次加入单克隆抗体CD34、CD45、CD29、CD73、CD90和等量PBS。避光孵育,流式细胞仪上机检测。
1.2.3 MSCs感染及筛选实验分为实验组(MSCs- CMV-FTH1、MSCs-NSE-FTH1)、空载组(MSCs-CMV-LV、MSCs-NSE-LV)、空白对照组(MSCs);其中实验组、空载组转染相应重组慢病毒,空白对照组加入等量PBS同法培养。48 h后显微镜下观察细胞荧光表达情况,嘌呤霉素筛选获得稳定细胞株。
1.2.4 MSCs体外成神经诱导分化按文献[6]的方法对各组细胞(MSCs-CMV-FTH1、MSCs-NSE-FTH1、MSCs-CMV-LV、MSCs-NSE-LV、MSCs)进行成神经诱导分化,所得细胞分别命名为Neurons-CMV-FTH1、Neurons-NSE-FTH1、Neurons-CMV-LV、Neurons-NSE-LV、Neurons,免疫荧光分别检测各组细胞NSE、巢蛋白以及MAP-2的表达。
1.2.5 Western blot检测FTH1表达提取各组细胞全蛋白,使用BCA法测定蛋白浓度,电泳,封闭,孵育FTH1一抗(1 :1 000)和β-actin一抗(1 :1 000)、二抗,利用ECL发光试剂显影。
1.2.6 普鲁士蓝染色使用0.5 mmol/L FAC培养细胞48 h,按文献[9]的方法对各组细胞进行普鲁士蓝染色,观察细胞内铁颗粒分布。
1.2.7 透射电镜观察使用0.5 mmol/L FAC培养细胞48 h,按文献[9]的方法制备细胞标本,透射电镜下观察细胞内铁颗粒分布。
1.2.8 体外细胞MRIFAC培养细胞,漂洗3次,消化、离心,每组细胞量约4×107个,多聚甲醛混匀对细胞沉淀进行固定,30 min后用ddH2O清洗,重悬液低速离心机离心约1 min(离心半径5.1 cm,4 000 r/min),3.0 T MRI(Ingenia, Philips)行自旋回波(SE)T2WI扫描,TR 2 200 ms,TE 80 ms,FOV 150 mm× 150 mm,层厚1 mm, 层间距0.2 mm。
1.2.9 CCK-8试剂检测细胞增殖活性将MSCs、MSCs-NSE-FTH1接种于96孔板内,分为FAC(+)、FAC(-)组,设多个复孔,48 h后加CCK-8试剂进行孵育,使用酶标仪对光密度值进行检测(波长分别是450、650 mm)。
1.2.10 HE染色将细胞分为FAC(+)、FAC(-)组进行培养,待细胞融合度约80%,使用PBS洗净,多聚甲醛固定,爬片上滴加适量苏木精溶液于细胞面染色,洗净后自然晾干,再滴加适量伊红染液进行染色,冲洗晾干,封片观察。
1.3 统计学方法计量资料以x±s表示,采用SPSS 19.0统计软件,多组间差异行单因素方差分析,两组间比较行独立样本t检验。检验水准:α=0.05。
2 结果 2.1 NSE-FTH1重组慢病毒载体的构建与鉴定成功构建NSE-FTH1重组慢病毒载体,重组质粒选择的插入酶切位点是XbaⅠ和BamHⅠ,结果显示1 500~2 000 bp出现1条片段(图 1)。
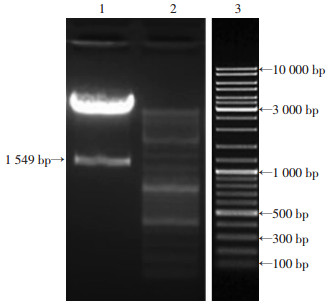
|
| 1:LV5-NSE-FTH1重组质粒XbaⅠ和BamHⅠ双酶切产物;2:标准;3:Marker Fermentas SM0331 图 1 LV5-NSE-FTH1重组质粒双酶切电泳 |
2.2 MSCs形态观察及鉴定
MSCs形态呈三角形、纺锤形,呈鱼群状排列生长。流式细胞术检测第3代MSCs表达表面标志物,其中CD34、CD45阳性表达率为0.6%、0.6%,CD29、CD73、CD90阳性率分别为99.9%、98.6%、98.7%(图 2)。

|
| A:CD34;B:CD45;C:CD29;D:CD73;E:CD90 图 2 流式细胞术检测第3代MSCs表面标志物阳性率 |
2.3 荧光显微镜观察细胞绿色荧光的表达
将含CMV-FTH1、NSE-FTH1基因的重组慢病毒和空载病毒CMV-LV、NSE-LV分别转染MSCs,48 h后荧光显微镜下观察各组细胞,实验组MSCs内可见明显绿色荧光(图 3),表明重组慢病毒成功转染MSCs。

|
| A:MSCs-CMV-FTH1组;B:MSCs-NSE-FTH1组 图 3 荧光显微镜观察慢病毒转染MSCs 48 h后绿色荧光的表达 |
2.4 神经元样细胞形态学观察及免疫细胞学鉴定
MSCs无折光性,经成神经诱导后部分细胞透光性增强,形成次级甚至多级突起相连邻近细胞。MSCs经染色后均未检测到相应荧光,神经元样细胞内NSE、巢蛋白、MAP-2蛋白表达呈现强阳性(图 4)。
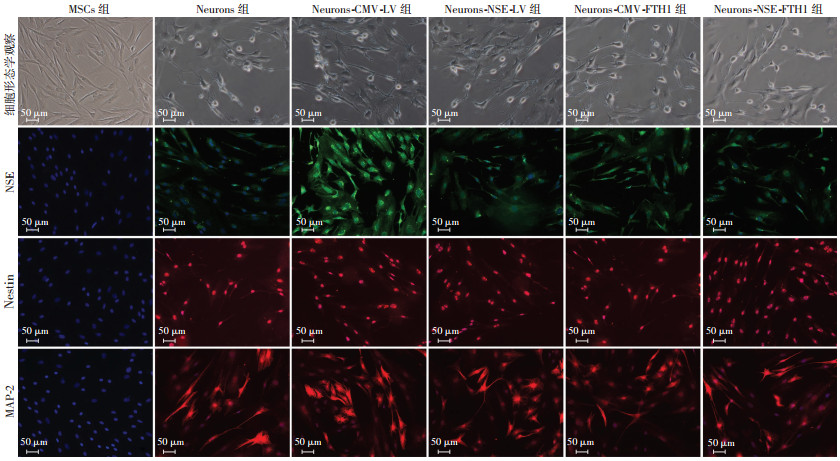
|
| 图 4 神经元样细胞形态学观察及免疫细胞学鉴定 |
2.5 Western blot检测MSCs成神经分化前后FTH1的表达
不含FTH1基因的细胞在成神经分化前后无目的条带显示,MSCs-NSE-FTH1组可见目的条带,MSCs-CMV-FTH1、Neurons-CMV-FTH1、Neurons-NSE-FTH1组细胞组均显示明显目的条带,MSCs-CMV-FTH1、MSCs-NSE-FTH1、Neurons-CMV-FTH1、Neurons-NSE-FTH1组灰度比值分别为(1.41±0.13)、(0.17±0.01)、(1.39±0.09)、(1.42±0.11),MSCs-CMV-FTH1、Neurons-CMV-FTH1、Neurons-NSE-FTH1组比较差异无统计学意义(P>0.05),MSCs-NSE-FTH1、Neurons-NSE-FTH1组比较差异有统计学意义(P<0.01,图 5)。这说明含NSE启动子的MSCs诱导成神经元样细胞后,FTH1基因表达量显著增加,表达量与CMV启动子组无明显差异。
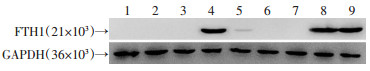
|
| 1: MSCs组;2:MSCs-CMV-LV组;3:MSCs-NSE-LV组;4:MSCs-CMV-FTH1组;5:MSCs-NSE-FTH1组;6:Neurons-CMV-LV组;7:Neurons-NSE-LV组;8:Neurons-CMV-FTH1组;9:Neurons-NSE-FTH1组 图 5 Western blot检测MSCs成神经分化前后FTH1基因的表达 |
2.6 普鲁士蓝染色
MSCs-CMV-FTH1、Neurons-CMV-FTH1、Neurons-NSE-FTH1组细胞质内均可见较多蓝染颗粒,MSCs-NSE-FTH1组可见少量蓝染颗粒,而MSCs、MSCs-CMV-LV、MSCs-NSE-LV、Neurons、Neurons-CMV-LV、Neurons-NSE-LV组未见明显蓝染颗粒(图 6)。这说明MSCs诱导成神经元样细胞内FTH1基因依旧能够诱导表达并向细胞内转铁,含NSE启动子的MSCs成神经诱导后,聚铁效应明显增加。

|
| A: MSCs组;B:MSCs-CMV-LV组;C:MSCs-NSE-LV组;D:MSCs-CMV-FTH1组;E:MSCs-NSE-FTH1组;F:Neurons组;G:Neurons-CMV-LV组;H:Neurons-NSE-LV组;I:Neurons-CMV-FTH1组;J:Neurons-NSE-FTH1组↑:示蓝染颗粒 图 6 普鲁士蓝染色观察各组细胞聚铁情况 |
2.7 透射电镜
MSCs-CMV-FTH1、Neurons-CMV-FTH1、Neurons-NSE-FTH1组细胞的胞质内可见较多的黑色电子致密颗粒,MSCs-NSE-FTH1组细胞内可见少量的黑色电子致密颗粒,而MSCs、MSCs-CMV-LV、MSCs-NSE-LV、Neurons、Neurons-CMV-LV、Neurons-NSE-LV组细胞内未见明显电子致密颗粒(图 7)。
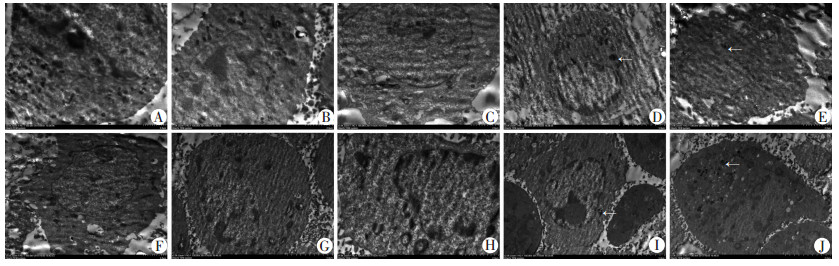
|
| A:MSCs组;B:MSCs-CMV-LV组;C:MSCs-NSE-LV组;D:MSCs-CMV-FTH1组;E:MSCs-NSE-FTH1组;F:Neurons组;G:Neurons-CMV-LV组;H:Neurons-NSE-LV组;I: Neurons-CMV-FTH1组;J: Neurons-NSE-FTH1组↑:示黑色电子致密颗粒 图 7 透射电镜观察各组细胞聚铁效应(×2 000) |
2.8 体外细胞MRI
10组细胞添加0.5 mmol/L FAC培养48 h,以SE序列对其进行T2WI扫描,结果显示:MSCs-CMV-FTH1、Neurons-CMV-FTH1、Neurons-NSE-FTH1组较MSCs、MSCs-CMV-LV、MSCs-NSE-LV、MSCs-NSE-FTH1、Neurons、Neurons-CMV-LV、Neurons-NSE-LV组细胞沉淀信号明显降低(图 8)。这证明含NSE启动子载体的MSCs在分化成神经元样细胞后,细胞内NSE启动子能驱动FTH1基因大量表达,细胞摄铁量能引起MRI信号明显降低,而含CMV启动子载体的MSCs在分化成神经元样细胞前后均会启动FTH1基因表达引起MRI信号明显降低。

|
| A:MSCs组;B:MSCs-CMV-LV组;C:MSCs-NSE-LV组;D:MSCs-CMV-FTH1组;E:MSCs-NSE-FTH1组;F:Neurons组;G:Neurons-CMV-LV组;H:Neurons-NSE-LV组;I:Neurons-CMV-FTH1组;J:Neurons-NSE-FTH1组 图 8 MRI成像观察各组细胞沉淀在T2WI上信号改变 |
2.9 CCK-8检测细胞增殖活性
MSCs组、MSCs-NSE-FTH1组、MSCs+FAC处理组、MSCs-NSE-FTH1+FAC处理组的光密度值分别为(1.08±0.03)、(0.99±0.01)(0.76±0.02)、(0.61±0.02)。MSCs-NSE-FTH1组、MSCs+FAC处理组、MSCs-NSE-FTH1+FAC处理组较MSCs组细胞增殖活性降低,而MSCs-NSE-FTH1+FAC处理组较MSCs-NSE-FTH1组、MSCs+FAC处理组增殖活性也明显降低(P<0.05)。结果表明,感染带目的基因的慢病毒或添加FAC培养MSCs后,细胞增殖活性均降低,两种因素共同作用对降低细胞增殖活性更显著。
2.10 HE染色各组细胞在表达FTH1及聚铁的情况下,细胞形态学观察尚未出现异常改变(图 9)。

|
| A:MSCs组;B:MSCs-CMV-LV组;C: Neurons组;D: Neurons-CMV-FTH1组;E: Neurons-NSE-FTH1组;F:MSCs+FAC处理组;G: MSCs-CMV-LV+FAC处理组;H: Neurons+FAC处理组;I: Neurons-CMV-FTH1+FAC处理组;J:Neurons-NSE-FTH1+FAC处理组 图 9 HE染色观察各组细胞形态变化 |
3 讨论
干细胞具有成神经分化的特性,通过干细胞的增殖及分化有可能达到修复或替代病变组织的目的,为神经系统疾病的治疗提供新策略。临床上干细胞治疗时往往需要对移植细胞的分布及增殖情况、是否分化及如何转归等生物学行为进行有效的活体示踪,以一种无创的方式判断治疗效果并指导治疗方案的调整和优化[10-12]。目前MRI报告基因成像已经实现了对细胞的纵向、连续示踪[13-15],但不能实时判断干细胞分化事件的发生。本研究通过基因改造,利用神经组织特异性启动子NSE来控制FTH1的表达,赋予报告基因自动开关功能,使报告基因在干细胞内处于沉默状态,而在分化为神经元样细胞时通过NSE的活化来启动报告基因的表达,从而实现报告基因成像对干细胞分化事件的特异性显示,旨在为干细胞体内成神经分化的MRI活体示踪研究奠定基础。
NSE是一种糖酵解酶的亚型,在神经元内的特异性高水平表达与NSE启动子的作用有关,目的基因在NSE启动子驱动下可在神经元细胞内持续稳定的表达[16]。本研究Western blot检测结果显示,MSCs-NSE-FTH1成神经诱导后铁蛋白表达量明显增加,且与MSCs-CMV-FTH1成神经诱导前后表达量比较,差异无统计学意义,说明NSE启动子能在神经元样细胞内启动FTH1基因特异性高水平表达,且表达量与CMV启动子组相似[8, 17];普鲁士蓝染色及透射电镜均可见含NSE启动子的MSCs成神经分化后胞质内铁颗粒明显增加,聚铁效应与CMV启动子组相似;MRI显示在0.5 mmol/L FAC培养下Neurons-NSE-FTH1组细胞较MSCs-NSE-FTH1组细胞信号明显降低,与普鲁士蓝染色及透射电镜基本符合。以上结果证明含NSE启动子的FTH1基因能够成功整合到靶细胞基因组,并且能够在神经元样细胞内特异性启动FTH1基因高表达,引起足够的MRI信号改变。这一特性对移植细胞分化成特定类型细胞的检测非常重要。
本实验虽然证实了NSE启动子报告基因成像用于监测干细胞成神经分化的可行性,但仍存在以下问题需要进一步解决:首先,Western blot检测结果显示MSCs-NSE-FTH1组细胞内仍有少量铁蛋白表达,考虑启动子表达的组织交叉性,可能是散在重复序列区域的转录元件影响了细胞特异性启动子的功能,通过基因改造有望进一步提高启动子表达的组织特异性。其次,体外实验时细胞培养过程中采用在培养基中加入FAC来实现FTH1基因的聚铁效应,在体内FTH1基因主要依靠对周围组织中铁离子的摄取发挥聚铁作用,体内环境较体外实验环境复杂得多,FTH1基因表达所产生的聚铁效应能否引起足够的MRI信号改变,尚需进一步研究;另外,由于启动子的组织特异性,本实验所用的NSE启动子只能用于成神经分化的监测,而干细胞其他方向分化的监测则需采用其他相应的启动子。
总之,本研究证实了NSE启动子在神经元样细胞内特异性启动报告基因FTH1高表达以及通过MRI来显示报告基因表达的可行性,有望在临床干细胞治疗过程中利用MRI发现干细胞是否发生成神经分化,并判断成神经分化的具体位置,对评估干细胞治疗效果有一定的帮助,该手段可拓展应用于干细胞向其他方向分化甚至瘤变的监测,也可与启动子靶向基因治疗相结合用于治疗效果的动态监测。
| [1] | DAI H Y, HE R, ZHANG Y, et al. Adenoviral vector mediated ferritin over-expression in mesenchymal stem cells detected by 7T MRI in vitro[J]. PLoS ONE, 2017, 12(9): e0185260. DOI:10.1371/journal.pone.0185260 |
| [2] | STEPHEN P P, RODRIGUES T B, KETTUNEN M I, et al. Development of Timd2 as a reporter gene for MRI[J]. Magn Reson Med, 2016, 75(4): 1697–1707. DOI:10.1002/mrm.25750 |
| [3] | PEREIRA S M, WILLIAMS S R, MURRAY P, et al. MS-1 magA: revisiting its efficacy as a reporter gene for MRI[J]. Mol Imaging, 2016, 15: 1–9. DOI:10.1177/1536012116641533 |
| [4] | WATADA Y, YAMASHITA D, TOYODA M, et al. Magnetic resonance monitoring of superparamagnetic iron oxide (SPIO)-labeled stem cells transplanted into the inner ear[J]. Neurosci Res, 2015, 95: 21–26. DOI:10.1016/j.neures.2015.01.010 |
| [5] | CHO I K, MORAN S P, PAUDYAL R, et al. Longitudinal monitoring of stem cell grafts in vivo using magnetic resonance imaging with inducible maga as a genetic reporter[J]. Theranostics, 2014, 4(10): 972–989. DOI:10.7150/thno.9436 |
| [6] |
钟毅, 蔡金华, 贺小娅, 等. 骨髓间充质干细胞成神经分化中的FTH1基因表达[J].
第三军医大学学报, 2016, 38(19): 2121–2127.
ZHONG Y, CAI J H, HE X Y, et al. Expression of ferritin heavy chain 1 in neural differentiation of bone marrow mesenchymal stem cells[J]. J Third Mil Med Univ, 2016, 38(19): 2121–2127. |
| [7] | SONG C, WANG J, MO C, et al. Use of ferritin expression, regulated by neural cell-specific promoters in human adipose tissue-derived mesenchymal stem cells, to monitor differentiation with magnetic resonance imaging in vitro[J]. PLoS ONE, 2015, 10(7): e0132480. DOI:10.1371/journal.pone.0132480 |
| [8] | HWANG D W, KANG J J, CHUNG J, et al. Noninvasive in vivo monitoring of neuronal differentiation using reporter driven by a neuronal promoter[J]. Eur J Nucl Med Mol Imaging, 2008, 35(1): 135–145. DOI:10.1007/s00259-007-0561-8 |
| [9] |
贺小娅, 蔡金华, 秦勇, 等. 磁共振报告基因FTH1慢病毒载体构建及其在人神经母细胞瘤细胞中的表达[J].
第三军医大学学报, 2014, 36(23): 2338–2342.
HE X Y, CAI J H, QIN Y, et al. Construction of recombinant lentivirus vector carrying FTH1 as an endogenous MRI reporter gene and its expression in SK-N-SH cells[J]. J Third Mil Med Univ, 2014, 36(23): 2338–2342. |
| [10] | JANOWSKI M, WALCZAK P, KROPIWNICKI T, et al. Long-term MRI cell tracking after intraventricular delivery in a patient with global cerebral ischemia and prospects for magnetic navigation of stem cells within the CSF[J]. PLoS ONE, 2014, 9(2): e97631. DOI:10.1371/journal.pone.0097631 |
| [11] | DASH R, KIM P J, MATSUURA Y, et al. Manganese-enhanced magnetic resonance imaging enables in vivo confirmation of peri-infarct restoration following stem cell therapy in a porcine ischemia-reperfusion model[J]. J Am Heart Assoc, 2015, 4(7): e002044. DOI:10.1161/JAHA.115.002044 |
| [12] | NGEN E J, WANG L, KATO Y, et al. Imaging transplanted stem cells in real time using an MRI dual-contrast method[J]. Sci Rep, 2015, 5: 13628. DOI:10.1038/srep13628 |
| [13] | HE X, CAI J, LI H, et al. In vivo magnetic resonance imaging of xenografted 3 tumors using FTH1 reporter gene expression controlled by a tet-on switch[J]. Oncotarget, 2016, 7(48): 78591. DOI:10.18632/oncotarget.12519 |
| [14] | PEREIRA S M, MOSS D, WILLIAMS S R, et al. Over-expression of the MRI reporter genes ferritin and transferrin receptor affect iron homeostasis and produce limited contrast in mesenchymal stem cells[J]. Int J Mol Sci, 2015, 16(7): 15481–15496. DOI:10.3390/ijms160715481 |
| [15] | GAUDET J M, RIBOT E J, CHEN Y, et al. Tracking the fate of stem cell implants with fluorine-19 MRI[J]. PLoS ONE, 2015, 10(3): e0118544. DOI:10.1371/journal.pone.0118544 |
| [16] | SHINOHARA Y, OHTANI T, KONNO A, et al. Viral vector-based evaluation of regulatory regions in the neuron-specific enolase (NSE) promoter in mouse cerebellum in vivo[J]. Cerebellum, 2017, 16(5/6): 913–922. DOI:10.1007/s12311-017-0866-5 |
| [17] | KLEIN R L, HAMBY M E, GONG Y, et al. Dose and promoter effects of adeno-associated viral vector for green fluorescent protein expression in the rat brain[J]. Exp Neurol, 2002, 176(1): 66–74. DOI:10.1006/exnr.2002.7942 |



