2. 00047 重庆,重庆师范大学教育科学学院:特殊教育系;
3. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院输血科;
4. 400038 重庆,陆军军医大学(第三军医大学):基础医学院生物化学与分子生物学教研室
2. Faculty of Education for Children with Special Needs, College of Education Science, Chongqing Normal University, Chongqing, 400047;
3. Department of Blood Transfusion, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
4. Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
孤独症(autism),又称自闭症,是严重的神经发育障碍性疾病。孤独症的患病率为儿童人口的2~5/万人,男女比例为3 :1~4 :1。孤独症患者交际障碍,言语困难,行为刻板,兴趣局限。研究表明,孤独症患者的皮质结构紊乱,皮质下细胞结构异常,小脑与脑干区的蒲肯野细胞萎缩或丢失,边缘系统的神经元发育异常且数量减少[1],提示神经元成熟的延迟及异常可能是导致孤独症发病的重要原因。尤其是在脑发育的关键时期,一些环境因素可能通过影响神经细胞中的关键信号通路而导致神经元的成熟异常。
在影响孤独症发病的环境因素中,丙戊酸钠(sodium valproate,VPA)暴露是一种重要的危险因素。VPA是一种不含氮的广谱抗癫痫药。对人的各型癫痫如各型小发作、肌阵挛性癫痫、局限性发作、大发作和混合型癫痫均有效。但VPA的产前暴露会导致发育障碍与畸形[2]。一项大规模人群调查显示,VPA的产前暴露显著增加了胎儿患孤独症的风险[3]。同时,VPA一次性药物注射也是目前公认的一种制备孤独症动物模型标准方法。但VPA究竟是通过何种机制导致孤独症发病尚不完全清楚,VPA能否改变神经细胞中与孤独症发病相关的信号通路值得深入研究。
Bcl-2是Bcl-2蛋白家族中一种重要的抗凋亡蛋白,它通过与促凋亡蛋白Bax、Bak结合而促进细胞存活[4]。有研究表明,在孤独症患者的脑组织中Bcl-2表达水平显著降低[5-6]。但导致Bcl-2表达水平降低的原因及机制尚不清楚。本课题组在前期实验中发现,VPA暴露可导致神经细胞中Bcl-2表达下降,为进一步探讨VPA暴露引起神经细胞中Bcl-2表达下调的相关机制,本课题组开展了本研究。
1 材料与方法 1.1 细胞株及培养人神经母细胞瘤细胞(SH-SY5Y)购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。细胞培养基为含10%胎牛血清的DMEM培养液,于37 ℃、5% CO2条件下静置培养。
1.2 药品及试剂丙戊酸钠(sodium valproate,VPA)为Sigma公司产品,DMEM培养基为美国Invitrogen公司产品,胎牛血清为美国HyClone公司产品,胰蛋白酶为美国Invitrogen公司产品,蛋白定量试剂盒为碧云天公司产品,定量PCR试剂盒为TaKaRa公司产品,miRNA提取试剂盒为天根公司产品,双荧光素酶报告基因检测试剂盒为Promega公司产品,miR-34a模拟物与抑制剂为Thermo公司产品,Bcl-2、GAPDH抗体为Cell Signaling公司产品,蛋白分子量标准为北京中衫公司产品,PVDF膜为Bio-Rad公司产品。
1.3 细胞分组与处理常规细胞培养后分为3组:①对照组,加入对照溶剂PBS;②VPA低剂量组:加入终浓度为0.3 mmol/L的VPA;③VPA高剂量组:加入终浓度为0.6 mmol/L的VPA。所有细胞处理后继续培养24 h,然后收集细胞进行检测。
1.4 定量PCR检测待处理结束后收集细胞,TRIzol提取总RNA,用M-MLV反转录酶对提取到的总RNA进行反转录,然后使用定量PCR检测试剂盒(SYBR法)进行检测,检测数据采用2-ΔΔCt法分析后作图。
1.5 Western blot检测待处理结束后收集细胞,加入RIPA裂解液于冰上裂解15 min。12 000 r/min于4 ℃离心10 min,收集上清,对蛋白进行定量并标准化后进行电泳分析。电泳时上样量为每孔40 μg,分离胶浓度为12%,电泳结束后将蛋白用半干转法从凝胶中转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h, 然后用鼠单克隆抗体Bcl-2 (1 :1 000稀释)及兔多克隆抗体GAPDH(1 :5 000稀释)4 ℃孵育过夜,经PBST洗膜3次后,分别用山羊抗小鼠二抗(1 :10 000稀释)、山羊抗兔二抗(1 :10 000稀释)室温孵育1 h,PBST洗膜后用化学发光法进行显影曝光。
1.6 microRNA提取与检测microRNA提取按照北京天根生物技术有限公司提供的试剂盒说明书进行,并利用GeneCopoeia公司的qRT-PCR检测系统进行检测,以U6基因作为内参照。microRNA的相对表达量通过2-△△Ct方法进行计算。
1.7 双荧光素酶报告基因实验将细胞接种于48孔板中,待细胞密度长至80%左右时,将pRL-TK质粒与pGL3-Bcl-2进行共转染,同时以pRL-TK/pGL3-Basic共转染为对照。转染36 h后,用1×PLB裂解液裂解细胞,裂解产物冰浴20 min后,12 000 r/min,4 ℃离心15 min。每个样品取20 μL上清与50 μL萤火虫荧光素酶底物混匀,置于报告基因检测系统中进行荧光素酶活性检测后,再加入50 μL反应终止液,然后继续检测海肾荧光素酶活性。各组均以二者活性的比值进行量化后作图,以组间t检验进行统计学差异分析。
1.8 mRNA稳定性实验将细胞接种于48孔板中,待细胞密度长至80%左右时,每孔加入6 mmol/L的VPA,同时加入5 μg/mL的放线菌素D(转录抑制剂),然后分别在加药前、加药后2、4、6、8 h收取细胞,提取RNA并分别通过RT-PCR及定量PCR测定Bcl-2 mRNA的含量。
1.9 细胞凋亡分析VPA处理结束后,收集细胞并用PBS洗涤2次,然后用Annexin V/PI标记溶液重悬细胞,室温下避光孵育10 min,再经流式细胞仪进行分析。以重复3次的实验数据进行统计学分析并作图处理。
1.10 统计学分析采用SPSS 20.0统计软件进行数据统计分析,所有数据均采用x±s表示,统计方法为单因素方差分析。检验水准α=0.05。
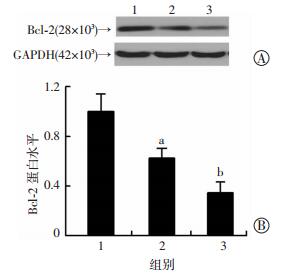
2 结果 2.1 VPA下调了SH-SY5Y细胞中Bcl-2的表达用不同浓度的VPA处理SH-SY5Y细胞,然后用定量PCR检测细胞中Bcl-2 mRNA水平变化,如图 1所示,VPA剂量依赖性地下调了SH-SY5Y细胞中Bcl-2 mRNA水平,进一步用Western blot检测结果显示,VPA同样显著下调了细胞中Bcl-2的蛋白水平(图 2)。

|
| 1:对照组;2:0.3 mmol/L的VPA处理组;3:0.6 mmol/L的VPA处理组;a: P < 0.05,b: P < 0.01,与对照组比较 图 1 VPA下调了SH-SY5Y细胞中Bcl-2的mRNA水平 |
|
|
1:对照组;2:0.3 mmol/L的VPA处理组;3:0.6 mmol/L的VPA处理组 A:Western blot检测结果;B:半定量分析结果a:P < 0.05,b: P < 0.01,与对照组比较 图 2 VPA下调了SH-SY5Y细胞中Bcl-2的蛋白水平 |
2.2 VPA对SH-SY5Y细胞中Bcl-2转录的影响
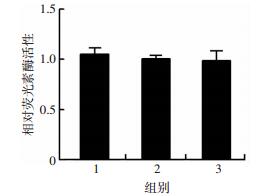
为探讨VPA下调Bcl-2表达的原因,我们构建了包含Bcl-2启动子的报告质粒,然后利用报告基因系统进行启动子活性分析,结果显示,与对照组相比,VPA处理并不能降低Bcl-2启动子的活性,说明VPA不能在转录水平抑制Bcl-2的表达(P < 0.05,图 3)。
|
| 1:对照组;2:0.3 mmol/L的VPA处理组;3:0.6 mmol/L的VPA处理组 图 3 双荧光素酶报告基因系统分析SH-SY5Y细胞中Bcl-2启动子活性 |
2.3 VPA降低了SH-SY5Y细胞中Bcl-2 mRNA的稳定性
mRNA水平降低的另外一个原因可能是降解加快,稳定性减弱,为证明这一机制是否发挥作用,用转录抑制剂联合VPA,然后利用RT-PCR与定量PCR在不同时间点检测Bcl-2 mRNA水平变化,结果显示,与对照组相比,VPA可以显著降低SH-SY5Y细胞中Bcl-2 mRNA的稳定性(P < 0.01,图 4)。

|
| 1:对照组;2:VPA处理2 h组;3:VPA处理4 h组;4:VPA处理6 h组;5:VPA处理8 h组;a: P < 0.01,与放线菌素D+ VPA比较 图 4 Bcl-2 mRNA的稳定性分析 |
2.4 VPA上调了SH-SY5Y细胞中miR-34a的表达水平
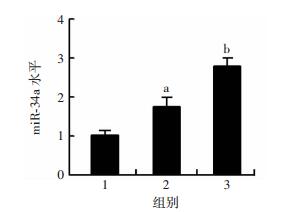
mRNA稳定性降低的一个重要原因是microRNA调控的结果。为进一步证实miR-34a是否在这一过程中起作用,我们首先检测了VPA作用下细胞中miR-34a水平的变化。与对照组相比,VPA显著升高了SH-SY5Y细胞中miR-34a的表达水平(P < 0.05,P < 0.01,图 5),说明miR-34a可能在这一过程中发挥作用。
|
| 1:对照组;2:0.3 mmol/L的VPA处理组;3:0.6 mmol/L的VPA处理组;a: P < 0.05,b: P < 0.01,与对照组比较 图 5 定量PCR分析SH-SY5Y细胞中miR-34a的表达水平 |
2.5 miR-34a的抑制剂可逆转VPA对SH-SY5Y细胞中Bcl-2表达的下调
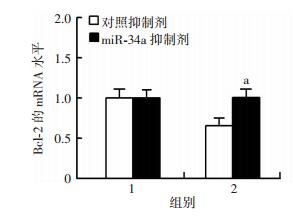
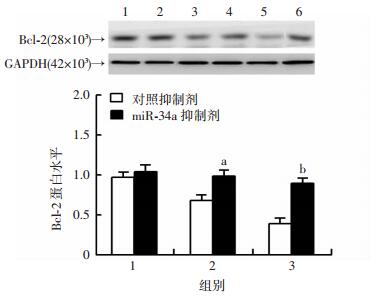
为进一步证实miR-34a在VPA下调Bcl-2表达过程中的作用,我们使用miR-34a的抑制剂与VPA联合处理细胞,然后分别从mRNA和蛋白水平检测Bcl-2表达变化。结果显示,与VPA单独处理相比,miR-34a抑制剂联合处理显著逆转了VPA对Bcl-2 mRNA(图 6)与蛋白水平(图 7)的下调作用,说明VPA可能通过上调miR-34a表达来达到下调Bcl-2表达的目的。
|
| 1:对照组;2:0.6 mmol/L的VPA处理组;a:P < 0.05,与对照抑制剂+VPA处理组比较 图 6 miR-34a抑制剂逆转VPA对SH-SY5Y细胞中Bcl-2 mRNA的下调 |
|
| A:Western blot检测结果1:对照组;2:miR-34a抑制剂单独处理组;3:0.3 mmol/L的VPA处理组;4:0.3 mmol/L的VPA联合miR-34a抑制剂处理组;5:0.6 mmol/L的VPA处理组;6:0.6 mmol/L的VPA联合miR-34a抑制剂处理组;B:半定量分析结果1:对照组;2:0.3 mmol/L的VPA处理组;3:0.6 mmol/L的VPA处理组;a: P < 0.05,b: P < 0.01,与对照抑制剂+对应剂量的VPA处理组比较 图 7 miR-34a抑制剂逆转VPA对SH-SY5Y细胞中Bcl-2蛋白水平的下调 |
2.6 miR-34a的抑制剂可减轻VPA对SH-SY5Y细胞凋亡的诱导
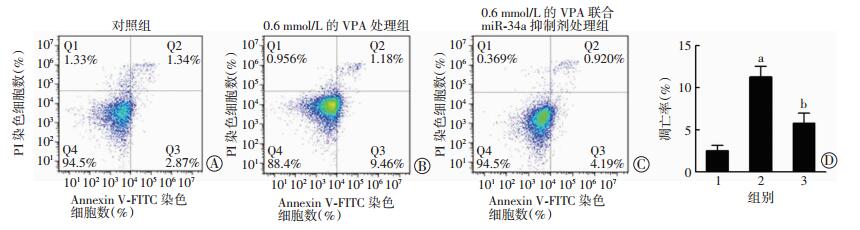
由于Bcl-2是一种重要的抗凋亡蛋白,VPA对它的下调是否影响SH-SY5Y细胞的凋亡水平,以及miR-34a抑制剂能否具有改善作用值得深入研究。通过流式细胞术检测结果显示,VPA单独处理可以增加SH-SY5Y细胞的凋亡率,而联合使用miR-34a抑制剂后细胞的凋亡率明显减少(图 8),说明VPA对Bcl-2表达的下调作用能够促进SH-SY5Y细胞的凋亡,而miR-34a抑制剂具有改善作用。
|
| A~C:流式细胞术检测各组细胞凋亡水平;D:统计分析结果1:对照组;2:0.6 mmol/L的VPA处理组;3:0.6 mmol/L的VPA联合miR-34a抑制剂处理组;a: P < 0.05,与对照组比较;b: P < 0.01,与0.6 mmol/L的VPA处理组比较 图 8 miR-34a抑制剂减轻VPA对SH-SY5Y细胞凋亡的诱导 |
3 讨论
VPA的产前暴露是目前公认的孤独症重要发病原因。VPA一次性注射药物模型也是目前公认的一种较理想的孤独症动物模型。该模型可以在行为上模拟孤独症的刻板、重复等行为特征,且脑组织中的神经形态变化也与孤独症尸检报告也相似[7]。但VPA暴露导致孤独症发病的机制尚未阐明。研究表明,VPA暴露可能影响小脑、前额叶、海马等脑组织的发育[8],机制可能涉及mTOR信号通路[9]、AKT激酶信号通路等[10]。但究竟VPA暴露是否能够引起神经细胞中Bcl-2表达的下调尚少见报道。本研究发现,VPA暴露显著下调SH-SY5Y细胞中Bcl-2的mRNA和蛋白水平,在一定程度上表明,VPA暴露可能是导致神经细胞中Bcl-2表达的下调重要原因。
Bcl-2是脑组织中主要表达的一种抗凋亡蛋白,且它的表达具有发育调控的特点[11-12]。Bcl-2在胚胎发育期的脑组织中高表达,但其水平在出生后逐渐降低[13]。在胚胎发育期,Bcl-2的表达水平可能决定了神经细胞的命运[14],如在小鼠中通过转基因过表达Bcl-2可保护神经细胞免于凋亡[15],而一些影响脑发育的环境因素如化合物、病毒感染等如干扰了神经细胞中Bcl-2的正常表达,则可能导致发生如孤独症类的神经性疾病。研究表明,在孤独症患者的前额叶、小脑等组织中Bcl-2表达水平显著降低[5-6]。但导致Bcl-2表达水平降低的原因及机制尚不清楚。本研究发现,VPA暴露会导致SH-SY5Y细胞中Bcl-2表达在mRNA和蛋白水平均显著下降。mRNA水平的下调机制主要涉及转录抑制和mRNA稳定性降低。报告基因实验证实,VPA暴露并不会抑制Bcl-2基因启动子活性,表明转录抑制并不是导致mRNA水平下调的原因。进而,本课题组发现,VPA暴露导致SH-SY5Y细胞中Bcl-2的mRNA稳定性降低。由于影响mRNA稳定性的因素有多种,结合前期报道miR-34a可在不同细胞中影响Bcl-2 mRNA的稳定性[16],本实验结果也进一步证实miR-34a的水平升高确实是导致SH-SY5Y细胞中Bcl-2 mRNA及蛋白水平降低的关键因素,使用miR-34a的抑制剂则可逆转VPA暴露导致的Bcl-2表达下调。同时,Bcl-2的下调还导致SH-SY5Y细胞的凋亡率显著上升。这些结果提示,miR-34a/Bcl-2信号通路的改变可能是VPA暴露致神经细胞凋亡及发育障碍的重要原因。
VPA暴露引起神经细胞中miR-34a水平上调的机制可能与它对组蛋白去乙酰化酶活性的抑制相关[17]。组蛋白去乙酰化酶活性的抑制将增加组蛋白的乙酰化水平,乙酰化的组蛋白通过重塑染色质结构而调节基因的表达。VPA暴露引起microRNA表达谱的改变已被报道。例如,丙戊酸钠暴露可显著上调miR-30d和miR-181c的表达[9]。因此,VPA暴露引起的miR-34a水平上调可能导致神经细胞中某些关键基因如Bcl-2的表达变化,从而引起神经细胞发育异常。
总之,本研究证实VPA暴露可以显著下调SH-SY5Y细胞中Bcl-2的表达,机制可能与上调miR-34a水平相关,相关结果可能为阐明VPA暴露所引起的神经细胞发育异常及孤独症提供一定的理论依据。
| [1] | CAREAGA M, MURAI T, BAUMAN M D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates[J]. Biol Psychiatry, 2017, 81(5): 391–401. DOI:10.1016/j.biopsych.2016.10.020 |
| [2] | CHOMIAK T, TURNER N, HU B. What we have learned about autism spectrum disorder from valproic acid[J]. Patholog Res Int, 2013, 2013: 712758. DOI:10.1155/2013/712758 |
| [3] | ROULLET F I, LAI J K, FOSTER J A. In utero exposure to valproic acid and autism—a current review of clinical and animal studies[J]. Neurotoxicol Teratol, 2013, 36: 47–56. DOI:10.1016/j.ntt.2013.01.004 |
| [4] | ZHENG J H, VIACAVA FOLLIS A, KRIWACKI R W, et al. Discoveries and controversies in BCL-2 protein-mediated apoptosis[J]. FEBS J, 2016, 283(14): 2690–2700. DOI:10.1111/febs.13527 |
| [5] | MALIK M, TAUQEER Z, SHEIKH A M, et al. NF-κB signaling in the brain of autistic subjects[J]. Mediators Inflamm, 2011, 2011: 785265. DOI:10.1155/2011/785265 |
| [6] | Crider A, Ahmed A O, Pillai A, et al. Altered expression of endoplasmic reticulum stress-related genes in the middle frontal cortex of subjects with autism spectrum disorder[J]. Mol Neuropsychiatr, 2017, 3(2): 85–91. DOI:10.1159/000477212 |
| [7] | CHO H, KIM C H, KNIGHT E Q, et al. Changes in brain metabolic connectivity underlie autistic-like social deficits in a rat model of autism spectrum disorder[J]. Sci Rep, 2017, 7(1): 13213. DOI:10.1038/s41598-017-13642-3 |
| [8] | GAO J, WANG X, SUN H, et al. Neuroprotective effects of docosahexaenoic acid on hippocampal cell death and learning and memory impairments in a valproic acid-induced rat autism model[J]. Int J Dev Neurosci, 2016, 49: 67–78. DOI:10.1016/j.ijdevneu.2015.11.006 |
| [9] | HU G W, MCQUISTON T, BERNARD A, et al. A conserved mechanism of TOR-dependent RCK-mediated mRNA degradation regulates autophagy[J]. Nat Cell Biol, 2015, 17(7): 930–942. DOI:10.1038/ncb3189 |
| [10] | YANG E J, AHN S, LEE K, et al. Correction: early behavioral abnormalities and perinatal alterations of PTEN/AKT pathway in valproic acid autism model mice[J]. PLoS ONE, 2016, 11(6): e0157202. DOI:10.1371/journal.pone.0157202 |
| [11] | TONG J, FURUKAWA Y, SHERWIN A, et al. Heterogeneous intrastriatal pattern of proteins regulating axon growth in normal adult human brain[J]. Neurobiol Dis, 2011, 41(2): 458–468. DOI:10.1016/j.nbd.2010.10.017 |
| [12] | COX E T, BRENNAMAN L H, GABLE K L, et al. Developmental regulation of neural cell adhesion molecule in human prefrontal cortex[J]. Neuroscience, 2009, 162(1): 96–105. DOI:10.1016/j.neuroscience.2009.04.037 |
| [13] | LIU M E, HUANG C C, HWANG J P, et al. Effect of Bcl-2 rs956572 SNP on regional gray matter volumes and cognitive function in elderly males without dementia[J]. Age (Dordr), 2013, 35(2): 343–352. DOI:10.1007/s11357-011-9367-5 |
| [14] | PARK H A, LICZNERSKI P, ALAVIAN K N, et al. Bcl-xL is necessary for neurite outgrowth in hippocampal neurons[J]. Antioxid Redox Signal, 2015, 22(2): 93–108. DOI:10.1089/ars.2013.5570 |
| [15] | YUN Y C, JANG D, YOON S B, et al. Laser acupuncture exerts neuroprotective effects via regulation of creb, bdnf, Bcl-2, and bax gene expressions in the hippocampus[J]. Evid Based Complement Alternat Med, 2017, 2017: 7181637. DOI:10.1155/2017/7181637 |
| [16] | TAKAHASHI M, ISHIDA M, SAITO T, et al. Valproic acid downregulates Cdk5 activity via the transcription of the p35 mRNA[J]. Biochem Biophys Res Commun, 2014, 447(4): 678–682. DOI:10.1016/j.bbrc.2014.04.072 |
| [17] | JONAS S, IZAURRALDE E. Towards a molecular understanding of microRNA-mediated gene silencing[J]. Nat Rev Genet, 2015, 16(7): 421–433. DOI:10.1038/nrg3965 |



