急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是临床常见的急危重症,发病率和病死率一直居高不下,且缺乏十分有效的治疗药物。严重肺内外感染、创伤、休克等引起的失控性炎症反应是其发生、发展的主要机制。炎症引起弥漫性肺泡-肺毛细血管膜损伤,进而引起肺水肿,严重影响通气功能[1]。早期有效地减轻炎症反应、防止疾病进展一直是临床治疗ARDS关注的焦点问题之一。
ARDS发生时,人体内会释放大量细胞因子、趋化因子和选择素等炎性递质,中性粒细胞募集浸润到肺实质和肺泡腔内,毛细血管壁通透性增加,肺泡上皮细胞破坏。肺泡-肺毛细血管膜损伤导致细胞凋亡、坏死[2-3]。近期的研究还表明,中性粒细胞在受到病原微生物、炎症细胞因子、致炎化学物等刺激时会形成一种网状结构并释放至胞外,这种结构称为中性粒细胞胞外诱捕网(neutrophil extracellular traps, NETs)[4],这个过程称为NETosis,是一种独立于凋亡、坏死的细胞死亡方式。这种纤维网状结构由DNA、组蛋白和多种胞浆颗粒蛋白[如髓过氧化物酶(myeloperoxidase, MPO)、弹性蛋白酶等]组成,其中DNA是其骨架成分。NETs的大量形成,细胞凋亡、坏死会导致DNA片段的释放。最近的研究表明,细胞凋亡释放至胞外的DNA能够上调炎症细胞因子表达,参与炎症反应,来源于细胞破坏或NETs形成的胞外DNA在缺血再灌注损伤中发挥作用[5-6]。因此,我们推测胞外DNA可能在ARDS炎症和损伤中发挥重要的作用。
脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNaseⅠ)是一种核酸内切酶,可特异性作用于DNA的磷酸二酯键,催化单链DNA或双链DNA降解[7]。ARDS发生时是否会产生胞外DNA,其是否参与ARDS炎症反应及组织损伤,有待进一步明确。因此,本研究通过建立脂多糖(lipopolysaccharide, LPS)诱导ARDS小鼠模型,采用DNaseⅠ中和肺部胞外DNA,观察胞外DNA在ARDS炎症及组织损伤中的作用,其结果可能为临床减轻炎症反应和组织损伤提供新的思路。
1 材料与方法 1.1 实验动物8~10周龄健康雄性C57BL/6小鼠,体质量20~25 g,购自陆军军医大学第三附属医院(野战外科研究所)实验动物中心。饲养于SPF级动物房,室内温度为22~25 ℃,光照为12 h :12 h明暗循环,给予充足的水和食物。
1.2 主要试剂和仪器LPS(Escherichia coli O55 :B5)购自美国Sigma公司,DNaseⅠ购自罗氏Roche公司,小鼠白介素-6(interleukin 6, IL-6)ELISA试剂盒购自深圳欣博盛公司,小鼠肿瘤坏死因子α(tumor necrosis factor α, TNF-α) ELISA试剂盒购自深圳欣博盛公司,小鼠MPO ELISA试剂盒购自武汉博士德公司,Quant-iTTM PicoGreenTM dsDNA Assay Kit购自美国Invitrogen公司,多功能酶标仪购自瑞士Tecan公司,光学显微镜购自江南光学公司,照相系统购自日本Olympus公司,低温离心机购自美国Thermo Fisher Scientific。
1.3 模型制备、DNaseⅠ干预和标本采集将小鼠按照随机数字表法分为4组(n=10)。①LPS诱导ARDS模型组(LPS组):采用LPS鼻内滴注方法[8]制备ARDS模型,LPS溶液和DNaseⅠ溶液浓度参照文献[9]并进行适当调整。称取小鼠质量后,左手抓小鼠,头部垂直向上,右手用移液器将LPS溶液按6 mg/kg剂量经鼻缓慢滴注至肺内,滴注过程中可见小鼠鼻孔处有气泡产生,且口腔内无液体流出,表明LPS溶液经过呼吸道到达小鼠肺内。滴注后0、4 h滴注等体积生理盐水。②DNaseⅠ治疗组(LPS+ DNaseⅠ组):LPS溶液6 mg/kg气管滴注,之后0、4 h分别滴注6 mg/kg DNaseⅠ溶液。③DNaseⅠ组和对照组:鼻内滴注生理盐水,之后0、4 h分别滴注等体积DNaseⅠ溶液(6 mg/kg)或生理盐水。模型建立24 h后采用水合氯醛麻醉后腹主动脉放血处死。22G留置针气管置管并用棉线结扎。每次抽取0.8 mL预冷的PBS溶液缓慢注入肺内,然后缓慢抽出,抽注3次后收集支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)置于冰上,重复1次,共计灌注1.6 mL PBS溶液。BALF立即离心10 min(1 500 r/min),将上清液分离并保存于-80 ℃待检,细胞沉淀用于细胞计数。统一取小鼠右肺下叶组织进行病理学分析。
1.4 组织病理学检查统一取小鼠右下叶肺,4%多聚甲醛固定后常规酒精脱水,石蜡包埋切片,切片厚度4 μm。采用德国Leica全自动染色封片一体机进行HE染色。肺组织病理改变采用美国胸科协会制定的动物肺损伤评分方法[10]进行评分。
1.5 BALF上清细胞计数收集小鼠BALF于EP管中,离心分离上清液,于-80 ℃保存待检,细胞沉淀用100 μL PBS液重悬,细胞计数板计数4个大方格细胞总数,再计算出BALF中细胞的数量。
1.6 BALF上清双链DNA检测经离心分离的BALF上清从-80 ℃冰箱取出复溶后,采用超敏荧光核酸染料Quant-iTTM Pico GreenTM dsDNA Assay Kit试剂盒和荧光光度计,按照试剂盒说明书检测BALF上清中双链DNA浓度。
1.7 BALF上清IL-6、TNF-α和MPO蛋白浓度检测经离心分离的BALF上清液,分别采用小鼠IL-6、TNF-α和MPO ELISA检测试剂盒,按照试剂盒说明书检测BALF上清中的IL-6、TNF-α和MPO的浓度。
1.8 统计学分析采用SPSS 19.0统计软件进行数据分析,计量资料以x±s表示,多组间数据比较采用单因素方差分析,组间两两比较行LSD-t检验。检验水准:α=0.05。
2 结果 2.1 LPS诱导ARDS小鼠BALF中胞外DNA浓度升高为了明确LPS诱导ARDS小鼠中胞外DNA的生成情况,采用超敏荧光核酸染料和荧光光度计检测BALF中的双链DNA浓度。与对照组比较,LPS组BALF中DNA浓度显著升高(P<0.05);与LPS组比较,LPS+ DNaseⅠ组BALF中的DNA浓度明显降低(P<0.05,表 1)。这提示LPS诱导小鼠ARDS发生后BALF中胞外DNA浓度明显升高,而通过加入DNaseⅠ溶液可以降解胞外DNA。
| 组别 | BALF中DNA浓度/ng·mL-1 | 肺组织损伤评分 | 细胞数/×104 |
| 对照组 | 322.23±52.30 | 0.23±0.09 | 7.14±2.22 |
| DNaseⅠ组 | 458.93±261.66 | 0.28±0.08 | 7.38±3.50 |
| LPS组 | 3 107.12±1 220.53a | 0.82±0.25a | 24.17±2.91a |
| LPS+DNaseⅠ组 | 689.68±495.04b | 0.38±0.07b | 8.14±4.04b |
| a: P<0.05, 与对照组比较;b: P<0.05, 与LPS组比较 | |||
2.2 DNaseⅠ减少ARDS小鼠肺组织损伤
采用HE染色观察各组小鼠肺组织形态变化(图 1)。光学显微镜下可见正常对照组小鼠肺组织结构正常,肺泡结构清晰,肺泡壁薄,肺泡壁及间质内无明显炎性细胞浸润。LPS组小鼠肺组织肺泡结构破坏、肺出血、肺间隔增厚及大量炎性细胞浸润,证明经鼻气管滴注LPS诱导小鼠ARDS模型构建成功。与LPS组相比,LPS+DNaseⅠ组肺泡结构较完整,炎症细胞浸润减少,肺间隔稍微增宽。这说明DNaseⅠ能够减轻LPS诱导的ARDS小鼠肺损伤程度。与对照组比较,LPS组肺损伤评分明显升高(P<0.05),而DNaseⅠ可明显降低LPS诱导的ARDS小鼠肺损伤评分(P<0.05,表 1)。
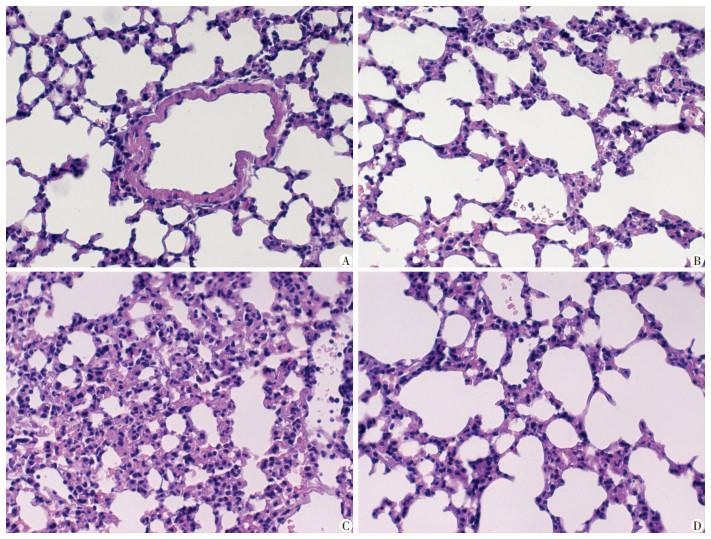
|
| A:对照组;B:DNaseⅠ组;C:LPS组;D:LPS+DNaseⅠ组 图 1 DNaseⅠ对LPS诱导ARDS小鼠肺部病理改变的影响(LM ×400) |
2.3 DNaseⅠ减少ARDS小鼠细胞浸润
与对照组相比,LPS组小鼠BALF中细胞总数明显升高(P<0.05),而与LPS组比较,LPS+DNaseⅠ组细胞总数明显减少(P<0.05,表 1)。
2.4 DNaseⅠ降低ARDS小鼠BALF中细胞因子和MPO浓度与对照组比较,LPS组小鼠BALF中TNF-α、IL-6和MPO蛋白浓度均明显升高(P<0.05);与LPS组比较,LPS+DNaseⅠ组BALF中TNF-α、IL-6、MPO浓度均显著下降(P<0.05,表 2)。
| 组别 | IL-6 | TNF-α | MPO |
| 对照组 | 53.98±24.29 | 93.31±29.00 | 855.18±135.84 |
| DNase Ⅰ组 | 68.56±24.36 | 95.97±25.33 | 1 150.11±185.37 |
| LPS组 | 493.20±141.12a | 515.00±148.77a | 169 215.78±60 014.61a |
| LPS+DNase Ⅰ组 | 57.09±25.28b | 146.37±66.26b | 7 204.00±6 780.11b |
| a:P<0.05, 与对照组比较; b: P<0.05, 与LPS组比较 | |||
3 讨论
本研究探索了LPS诱导小鼠ARDS模型BALF中胞外DNA浓度的改变及其在ARDS肺部炎症损伤中的作用,结果显示采用LPS直接气管滴注法诱导的小鼠ARDS模型BALF中的胞外DNA浓度显著升高;通过DNaseⅠ降解DNA,可以明显减轻ARDS小鼠肺部氧化应激、炎症损伤,表现为肺组织病理改变减轻、肺损伤评分减少,BALF中细胞总数下降,TNF-α、IL-6和MPO浓度下降。以上结果证明了胞外DNA参与了ARDS模型中肺部炎症损伤,DNaseⅠ降解DNA可有效减轻肺部炎症损伤。
胞外DNA泛指一切存在于胞外环境中的DNA。其来源可以是损坏或死亡细胞释放的线粒体DNA和核DNA[11-12],也可来源于NETs的形成[4, 13]。研究发现胞外DNA能够刺激单核细胞表达炎症细胞因子[5]。IIDA等[14]发现血清中的游离DNA浓度高低与丙肝病毒相关肝细胞癌患者炎症细胞因子基因水平呈正相关,提示胞外DNA升高与炎症持续状态有关。有研究还发现NETs通过促进炎症细胞因子的表达和降解气道内皮细胞紧密连接蛋白在严重哮喘气道炎症反应中发挥作用[15]。本研究通过降解胞外DNA,减少了炎症细胞因子生成,引起肺泡内浸润的炎性细胞减少,氧化应激程度降低,减少了血管内皮和肺泡上皮的损伤。
动物实验结果表明,在输血相关急性肺损伤、机械通气相关肺损伤和LPS诱导急性肺损伤等多种肺损伤模型中NETs形成增加[9, 16-17]。BRINKMANN等[18]首先描述了中性粒细胞能形成NETs结构。NETs指的是中性粒细胞受到炎症刺激后组蛋白与DNA主链解聚,胞浆颗粒蛋白(如MPO、弹性蛋白酶等)转移并粘附至DNA纤维上,最后附着有组蛋白、胞浆颗粒蛋白及少量胞浆蛋白的DNA纤维网状结构释放至细胞外的过程。LPS诱导ARDS模型中,大量中性粒细胞浸润到肺组织,而炎性细胞因子的生成无疑对中性粒细胞形成强烈的刺激,肺内生成的胞外DNA极有可能与NETs的形成密切相关。需要注意的是,有体外实验发现,NETs的组织损伤效应主要在于蛋白成分(如组蛋白和MPO)的细胞毒作用[19],而另外的实验发现通过加入抗MPO、抗弹性蛋白酶抗体仅能部分抑制NETs对内皮细胞的细胞毒作用[15]。故我们推测胞外DNA在ARDS中的促炎作用可能来自于DNA的直接作用以及粘附在DNA网状结构上的蛋白成分的作用。由于DNaseⅠ能够降解任何来源的DNA,因此在本研究中检测到的BALF中胞外DNA的来源还需要进一步的实验加以明确。
ARDS一直以来是临床上的治疗难题,其病理过程的机制也十分复杂,目前尚无有效的治疗手段。本研究为LPS诱导ARDS模型的发病机制提供了新的线索,针对胞外DNA治疗减轻肺部炎症损伤可为ARDS的治疗提供新思路。
| [1] | STANDIFORD T J, WARD P A. Therapeutic targeting of acute lung injury and acute respiratory distress syndrome[J]. Transl Res, 2016, 167(1): 183–191. DOI:10.1016/j.trsl.2015.04.015 |
| [2] | MATTHAY M A, ZEMANS R L. The acute respiratory distress syndrome: pathogenesis and treatment[J]. Annu Rev Pathol, 2011, 6: 147–163. DOI:10.1146/annurev-pathol-011110-130158 |
| [3] | MARTIN T R, HAGIMOTO N, NAKAMURA M, et al. Apoptosis and epithelial injury in the lungs[J]. Proc Am Thorac Soc, 2005, 2(3): 214–220. DOI:10.1513/pats.200504-031AC |
| [4] | VOROBJEVA N V, PINEGIN B V. Neutrophil extracellular traps: mechanisms of formation and role in health and disease[J]. Biochemistry (Mosc), 2014, 79(12): 1286–1296. DOI:10.1134/S0006297914120025 |
| [5] | ATAMANIUK J, KOPECKY C, SKOUPY S, et al. Apoptotic cell-free DNA promotes inflammation in haemodialysis patients[J]. Nephrol Dial Transplant, 2012, 27(3): 902–905. DOI:10.1093/ndt/gfr695 |
| [6] | BOETTCHER M, ESCHENBURG G, MIETZSCH S, et al. Therapeutic targeting of extracellular DNA improves the outcome of intestinal ischemic reperfusion injury in neonatal rats[J]. Sci Rep, 2017, 7(1): 15377. DOI:10.1038/s41598-017-15807-6 |
| [7] |
郭九叶, 王建华, 牛勃. DNaseⅠ在临床中的应用[J].
临床与病理杂志, 2009, 29(2): 125–129.
GUO J Y, WANG J H, NIU B. Clinical applications of DNaseⅠ[J]. Inter J Pathol Clin Med, 2009, 29(2): 125–129. |
| [8] | DING R, ZHAO D, LI X, et al. Rho-kinase inhibitor treatment prevents pulmonary inflammation and coagulation in lipopolysaccharide-induced lung injury[J]. Thromb Res, 2017, 150: 59–64. DOI:10.1016/j.thromres.2016.12.020 |
| [9] | LIU S, SU X, PAN P, et al. Neutrophil extracellular traps are indirectly triggered by lipopolysaccharide and contribute to acute lung injury[J]. Sci Rep, 2016, 6: 37252. DOI:10.1038/srep37252 |
| [10] | MATUTE-BELLO G, DOWNEY G, MOORE B B, et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals[J]. Am J Respir Cell Mol Biol, 2011, 44(5): 725–738. DOI:10.1165/rcmb.2009-0210ST |
| [11] | ZITVOGEL L, KEPP O, KROEMER G. Decoding cell death signals in inflammation and immunity[J]. Cell, 2010, 140(6): 798–804. DOI:10.1016/j.cell.2010.02.015 |
| [12] | CHOI J J, REICH C F 3RD, PISETSKY D S. Release of DNA from dead and dying lymphocyte and monocyte cell lines in vitro[J]. Scand J Immunol, 2004, 60(1/2): 159–166. DOI:10.1111/j.0300-9475.2004.01470.x |
| [13] | MARGRAF S, LÖGTERS T, REIPEN J, et al. Neutrophil-derived circulating free DNA (cf-DNA/NETs): a potential prognostic marker for posttraumatic development of inflammatory second hit and sepsis[J]. Shock, 2008, 30(4): 352–358. DOI:10.1097/SHK.0b013e31816a6bb1 |
| [14] | IIDA M, IIZUKA N, SAKAIDA I, et al. Relation between serum levels of cell-free DNA and inflammation status in hepatitis C virus-related hepatocellular carcinoma[J]. Oncol Rep, 2008, 20(4): 761–765. |
| [15] | PHAM D L, BAN G Y, KIM S H, et al. Neutrophil autophagy and extracellular DNA traps contribute to airway inflammation in severe asthma[J]. Clin Exp Allergy, 2017, 47(1): 57–70. DOI:10.1111/cea.12859 |
| [16] | CAUDRILLIER A, KESSENBROCK K, GILLISS B M, et al. Platelets induce neutrophil extracellular traps in transfusion- related acute lung injury[J]. J Clin Invest, 2012, 122(7): 2661–2671. DOI:10.1172/JCI61303 |
| [17] | YILDIZ C, PALANIYAR N, OTULAKOWSKI G, et al. Mechanical ventilation induces neutrophil extracellular trap formation[J]. Anesthesiology, 2015, 122(4): 864–875. DOI:10.1097/ALN.0000000000000605 |
| [18] | BRINKMANN V, REICHARD U, GOOSMANN C, et al. Neutrophil extracellular traps kill bacteria[J]. Science, 2004, 303(5663): 1532–1535. DOI:10.1126/science.1092385 |
| [19] | SAFFARZADEH M, JUENEMANN C, QUEISSER M A, et al. Neutrophil extracellular traps directly induce epithelial and endothelial cell death: a predominant role of histones[J]. PLoS ONE, 2012, 7(2): e32366. DOI:10.1371/journal.pone.0032366 |



