2. 重庆 400014,重庆医科大学附属儿童医院检验科
2. Department of Clinical Laboratory, Children's Hospital of Chongqing Medical University, Chongqing, 400014, China
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是医院感染的常见条件致病菌之一,随着抗菌药物的广泛使用,铜绿假单胞菌出现多重耐药的现象日趋严重,甚至出现多重耐药铜绿假单胞菌(multi-drug resistant Pseudomonas aeruginosa, MDR-PA)在医院ICU病房爆发流行的情况,给临床抗感染治疗带来极大的困难。MDR-PA具有传播途径广、致病性强等特点,MDR-PA的克隆性流行一直是医院感染控制工作的监测重点,通常使用分子生物学分型方法对分离菌株进行监测[1-2]。常用方法有多位点序列分析(MLST)、脉冲场凝胶电泳分析(PFGE)等等[3-4],这些方法主要是根据细菌的染色体大小差异进行分型及同源性分析,稳定性和准确性均较好,但同时存在耗时较长,操作复杂等缺点,不适用于临床快速检测,且不是实验室具备的常规仪器设备和技术,难以在临床实验室进行推广运用,不宜作为常规监测手段。基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)作为目前临床微生物实验室中的一项新技术,除鉴定细菌外,还可以利用Clin ProTools、SARAMIS等分析软件对细菌蛋白图谱进行聚类分析,及时为医院感染控制和流行病学调查研究提供实验室证据。MALDI-TOF MS同源性分析具有快速、价格低廉、准确等优点,且目前国内外均有研究报道将MALDI-TOF MS技术应用于病原菌同源性分析[5-8],因此MALDI-TOF MS在该领域的研究也逐渐成为大家关注的热点。本研究旨在明确ICU病房是否存在MDR-PA克隆传播,评价MALDI-TOF MS技术用于MDR-PA同源性分析的可行性。
1 材料与方法 1.1 菌株来源收集2017年1-12月陆军军医大学第三附属医院临床分离ICU非重复MDR-PA菌株20株。大肠埃希菌ATCC8739为质谱鉴定试验质控菌株,为本实验室保存。
1.2 仪器与试剂GNP29270型恒温培养箱(上海精宏实验室设备有限公司),VITEK MS质谱仪(法国生物梅里埃公司),恒温摇床(上海世平实验设备有限公司),电泳胶制作模具(美国BIO-RAD公司),脉冲场凝胶电泳仪(美国BIO-RAD公司),凝胶成像仪(美国BIO-RAD公司),菌栅胶制作模具(美国BIO-RAD公司)。试剂:VITEK MS CHCA基质液(法国生物梅里埃公司),血琼脂平皿(OXOID公司),甲酸、乙腈、无水乙醇(重庆川东化工有限公司)。溶菌酶(Biosharp公司),蛋白酶K(Sigma公司),限制性内切酶XbaⅠ(大连宝生生物有限公司),低熔点胶粉AgaroseB、AgaroseⅢ和十二烷基肌氨酸钠(上海生工生物有限公司)。
1.3 耐药表型分析方法根据VITEK-2 Compact高级专家系统提供的数据进行分析判断,将20株MDR-PA分为4种耐药表型模式:结合抗生素敏感性结果划分为不同的耐药模式,用小写的英文字母a,b,c,d表示,其中a型为泛耐药(对所有抗生素全耐药);b型为仅对喹诺酮类抗生素敏感,其余抗生素耐药;c型为仅对三代头孢类抗生素敏感,其余抗生素耐药;d型为对喹诺酮类和三代头孢类抗生素敏感,其余抗生素耐药。
1.4 PFGE分析将MDR-PA菌株分别接种于血平板,37 ℃培养18~24 h。挑取新鲜菌落溶于细胞悬浮缓冲液中,悬浮菌体,制成4个麦氏浊度的菌悬液,制备菌栅胶,再通过裂解、洗胶块、酶切、制作电泳胶上样、电泳获取图像。应用BioNumerics软件对图像进行分析[9],选择UPGMA (un-weighted pair group method using arithmetic averages)方法,条带位置差异容许度为2%,优化值0.5%,电泳条带完全一致判断为同一基因型株菌;相似度>80%为同一亚型,代表同一克隆株;<80%者为不同的亚型,代表不同的克隆株,用大写的英文字母A~F表示不同的基因型。
1.5 MALDI-TOF MS分析将MDR-PA菌株接种于哥伦比亚血琼脂平板,放置于35 ℃、5% CO2培养箱中培养24 h。用灭菌的取菌环挑取适量细菌放入1.5 mL EP管,加入300 μL纯水混匀,再加入900 μL无水乙醇震荡混匀,静置15 min后离心(13 000 r/min, 2 min),弃上清后重复离心,以彻底弃去上清。再向EP管内加入50 μL 70%浓度的甲酸,震荡混匀后再加入50 μL乙腈,再震荡混匀,静置1 min后高速离心(13 000 r/min)2 min,吸出上清蛋白提取液备用,做好标记及编号。取1 μL处理好的上清液点加在MALDI-TOF MS的样品靶上,在室温条件下自然晾干(5~10 min),其上滴加1 μL CHCA基质溶液均匀覆盖其表面,待自然晾干后上机检测。每一个样品的蛋白质谱峰通过不同位置100次的激光点击而获得,仪器可检测的蛋白质质量范围为2 000~20 000 Da,得到的蛋白质谱峰信息经软件校正,然后与仪器内的微生物数据库图谱进行比对,从而得到鉴定结果。通过VITEK MS SARAMIS软件查看分析鉴定结果,并导入图谱数据库进行聚类分析,相似度<70%者为不同的质谱型别[10],用Ⅰ~Ⅲ表示不同的型别。
2 结果 2.1 耐药表型分析20株MDR-PA中对所有抗菌药物全耐药为a型,有7株;对所有抗菌药物仅喹诺酮类抗生素敏感的为b型,有8株;对所有抗菌药物仅对三代头孢类抗生素敏感的为c型,有2株;对所有抗菌药物仅对喹诺酮类和三代头孢类抗生素敏感的为d型,有2株。分离的克隆株最早是2017年1月7日分离出的901号,最晚是2017年11月5日分离出的919号,其耐药模式不全相同。见表 1。
| 菌株编号 | 分离日期 | 抗性表现型 | PFGE型 | MALDI型 |
| 911 | 20170624 | b | A | Ⅲ |
| 912 | 20170807 | b | A | Ⅰ |
| 920 | 20170420 | b | B | Ⅰ |
| 914 | 20170913 | d | B | Ⅰ |
| 904 | 20170214 | b | B | Ⅰ |
| 906 | 20170419 | b | C | Ⅰ |
| 916 | 20171012 | b | C | Ⅰ |
| 919 | 20171105 | b | C | Ⅰ |
| 903 | 20170208 | a | C | Ⅰ |
| 901 | 20170107 | c | D | Ⅰ |
| 909 | 20170526 | c | D | Ⅰ |
| 917 | 20171017 | a | D | Ⅰ |
| 902 | 20170119 | d | F | Ⅰ |
| 915 | 20171002 | a | E | Ⅰ |
| 905 | 20170315 | b | E | Ⅱ |
| 910 | 20170601 | a | E | Ⅱ |
| 913 | 20170829 | a | E | Ⅱ |
| 918 | 20171023 | a | E | Ⅱ |
| 908 | 20170505 | a | E | Ⅱ |
| 907 | 20170428 | b | E | Ⅱ |
2.2 PFGE同源性分析结果
由图 1可见,菌株906、916、919具有相同的PFGE带型为同一基因型菌株,菌株913、918具有相同的PFGE带型为同一基因型株菌;菌株911、912相似度83.7%,为同一亚型,代表同一克隆株,描述为A型;菌株920、914、904相似度84.1%,描述为B型;菌株906、916、919、903相似度89.5%,描述为C型;菌株901、909、917相似度80.9%,描述为D型;菌株905、910、913、918、908、907、915相似度85.2%,描述为E型;菌株902与其他亚型相似度<80%为不同的亚型,代表不同的克隆株,描述为F型。见表 1。
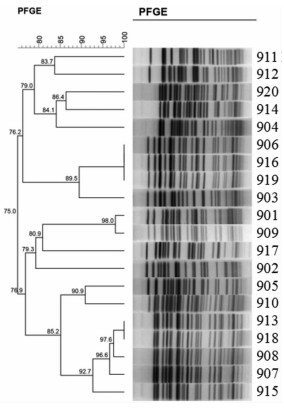
|
| 图 1 MDR-PA同源性聚类图(PFGE) |
2.3 MALDI-TOF MS同源性分析结果
通过VITEK MS SARAMIS分析软件对20株MDR-PA的蛋白指纹图谱进行聚类分析,并构建发育树。从聚类分析图(图 2)可发现:通过不同菌株质谱间相似度>70%为同一质谱型别进行划分,20株MDR-PA大致分为三大簇(Ⅰ型13株,Ⅱ型6株,Ⅲ型1株),其中菌株906、919、916、903、912、904、920、914、901、909、917、902、915为Ⅰ型,菌株913、918、910、905、907、908为Ⅱ型,菌株911为Ⅲ型。
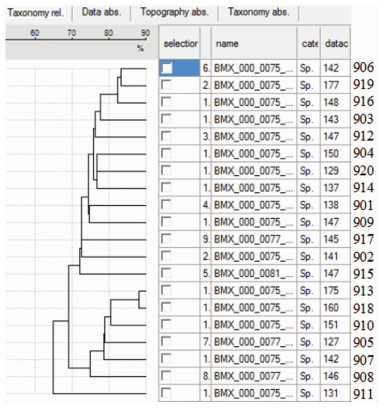
|
| 图 2 MDR-PA同源性聚类图(MALDI-TOF MS) |
2.4 PFGE和MALDI-TOF MS结果一致性比较
MALDI-TOF MS同源性分析结果与PFGE同源性分析结果比较显示,20株MDR-PA通过MALDI-TOF MS聚类分析将其分为三大簇(Ⅰ型13株,Ⅱ型6株,Ⅲ型1株),而依据PFGE分型结果则将其分为6种亚型(A型2株,B型3株,C型4株,D型3株,E型7株,F型1株),其中有C型和E型中具有相同基因型菌株间,其MALDI-TOF MS亲缘性关系也较近,而其余4种亚型菌株间亲缘性比较,发现PFGE分型结果与MALDI-TOF MS聚类分析结果不完全相符,见表 1。
3 讨论PA是临床上最常见的条件致病菌之一,以呼吸系统感染为主,已成为医院感染的主要病原菌之一,而我院ICU病房出现MDR-PA医院感染流行趋势。为确定病原菌与疾病的发生,传播和流行之间的关系,现比较公认的同源性分析方法为PFGE同源性分析。该方法准确性和可靠性被广泛认同,但是由于其对临床工作的指导意义受限,不是实验室所具备的常规设备和技术且存在操作繁琐,耗时较长等不足,难以在临床实验室推广运用[11]。MALDI-TOF MS作为目前临床微生物实验室中的一项新技术,除鉴定细菌外,还可以利用SARAMIS等分析软件对细菌蛋白指纹图谱进行聚类分析,及时为医院感染控制和流行病学调查研究提供实验室证据。
本研究以PFGE作为细菌同源性分析的金标准,通过PFGE分型得出906、916、919为同一株菌,耐药表型一致,913、918为同一菌株,耐药表型一致,提示这两株菌出现ICU病房克隆传播;按照亚型相似度<80%进行区分[9],PFGE将20株MDR-PA分为A-F 6个亚型。按照亚型相似度<70%进行区分[10],MALDI- TOF MS将20株MDR-PA分为Ⅰ~Ⅲ 3个亚型。MALDI- TOF MS同源性分析结果显示,906、916、919相似度较高,菌株913、918相似度较高,与PFGE同源性分析结果完全一致,而其余4种亚型菌株间亲缘性比较,发现PFGE分型结果与MALDI-TOF MS聚类分析结果不完全相符。分析其主要原因可能为PFGE是根据细菌的染色体进行分型,稳定性和准确性较好[12];而MALDI-TOF MS主要通过细菌蛋白指纹图谱相似性进行聚类分析,细菌蛋白表达过程中其丰度会受到培养时间、培养基等多因素的影响,从而使得MALDI-TOF MS同源性分析结果具有不稳定性,因此MALDI-TOF MS同源性分析具有一定局限性,质谱特征峰采集受人、机、料、法、环等多因素影响,需要严格掌握实验条件,在标准条件下完成实验,且多次综合分析有助于结果的可靠性和准确性。此外,目前没有制定统一的质谱标准化操作流程,实验结果的重复性和可靠性还未得到多中心不同实验室的验证,尚难以准确定论MALDI-TOF MS同源性分析能力。
基于临床发生暴发性、聚集性感染的后果严重,迅速诊断病原菌、判明病原菌的亲缘关系对于明确感染暴发流行的本质和制定合理的感染控制措施至关重要。因此,我们需要建立一种新的快速病原菌同源性分析的新方法,而VITEK MS能利用SARAMIS软件对细菌蛋白图谱进行鉴定和聚类分析,可在几分钟内完成对可疑细菌的鉴定及同源性分析。该技术在溯源分析方面具有快速、通量高、方便、节约成本和时间等优点,在临床实验室中比其他分子生物学方法更实用,能够及时明确引发院内感染病原菌的性质,为医院感染控制研究提供一个更加快捷简便的方法。
| [1] |
袁莉莉, 丁百兴, 沈震, 等. 耐碳青霉烯类铜绿假单胞菌的耐药性及分子流行病学研究[J].
中国感染与化疗杂志, 2017, 17(3): 289–292.
YUAN L L, DING B X, SHEN Z, et al. Antibiotic resistance and molecular epidemiology of carbapenem-resistant Pseudomonas aeruginosa[J]. Chin J Infec Chemoth, 2017, 17(3): 289–292. |
| [2] |
黄小荣, 梁天文, 刘配辰, 等. 多重耐药铜绿假单胞菌同源性分析及Ⅰ型整合子研究[J].
中国抗生素杂志, 2014, 39(10): 764–768.
HUANG X R, LIANG T W, LIU P C, et al. Homological analysis of multi-drug resistant Pseudomonas aeruginosa and detection of class Ⅰ integrons[J]. Chin J Antibio, 2014, 39(10): 764–768. DOI:10.3969/j.issn.1001-8689.2014.10.009 |
| [3] | WATERS V, ZLOSNIK J E, YAU Y C, et al. Comparison of three typing methods for Pseudomonas aeruginosa isolates from patients with cystic fibrosis[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(12): 3341–3350. DOI:10.1007/s10096-012-1701-z |
| [4] | SUZUKI M, YAMADA K, AOKI M, et al. Applying a PCR-based open-reading frame typing method for easy genotyping and molecular epidemiological analysis of Pseudomonas aeruginosa[J]. J Appl Microbiol, 2016, 120(2): 487–497. DOI:10.1111/jam.13016 |
| [5] | BADER O. MALDI-TOF-MS-based species identification and typing approaches in medical mycology[J]. Proteomics, 2013, 13(5): 788–799. DOI:10.1002/pmic.201200468 |
| [6] | MENCACCI A, MONARI C, LELI C, et al. Typing of nosocomial outbreaks of Acinetobacter baumannii by use of matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. J Clin Microbiol, 2013, 51(2): 603–606. DOI:10.1128/JCM.01811-12 |
| [7] |
李东菊, 朱元祺, 梁冰. MALDI-TOF MS用于肺炎克雷伯菌同源性分析的初步研究[J].
中国微生态学杂志, 2016, 28(5): 528–532+537.
LI D J, ZHU Y Q, LIANG B. MALDI-TOF homology analysis of Klebsiella pneumoniae by MALDI-TOF MS[J]. Chin J Microecol, 2016, 28(5): 528–532+537. |
| [8] |
王亚南, 高晶晶, 钟桥, 等. MALDI-TOF MS技术在鲍曼不动杆菌鉴定及同源性分析中的应用[J].
临床检验杂志, 2015, 33(6): 430–433.
WANG Y N, GAO J J, ZHONG Q, et al. MALDI-TOF identification and homology analysis of Acinetobacter baumannii by use of matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Chin J Clin Lab Sci, 2015, 33(6): 430–433. |
| [9] | THONG K L, LAI K S, GANESWRIE R, et al. Pulsed-field gel electrophoresis of multidrug-resistant and -sensitive strains of Pseudomonas aeruginosa from a Malaysian hospital[J]. Jpn J Infect Dis, 2004, 57(5): 206–209. |
| [10] | VERROKEN A, BAURAING C, DEPLANO A, et al. Epidemiological investigation of a nosocomial outbreak of multidrug-resistant Corynebacterium striatum at one Belgian university hospital[J]. Clin Microbiol Infect, 2014, 20(1): 44–50. DOI:10.1111/1469-0691.12197 |
| [11] |
闻海丰, 冯忠军, 秦瑾, 等. 采用ERIC-PCR与PFGE分析鲍曼不动杆菌基因型和同源性并对比方法学差异[J].
分子诊断与治疗杂志, 2016, 8(1): 27–31.
WEN H F, FENG Z J, QIN J, et al. Comparison between PFGE and ERIC-PCR for genotyping and homologous analysis of Acinetobacter baumannii[J]. J Mol Diagn Ther, 2016, 8(1): 27–31. |
| [12] |
杨富国, 闫志勇, 毕春霞. 青岛地区医院内感染耐甲氧西林金黄色葡萄球菌分子分型研究[J].
中华流行病学杂志, 2008, 29(12): 1230–1234.
YANG F G, YAN Z Y, BI C X. Molecular typing of methieillin-resistant Staphylococcus aureus isolated from hospitalized patients in Qingdao[J]. Chin J Epidemiol, 2008, 29(12): 1230–1234. DOI:10.3321/j.issn:0254-6450.2008.12.014 |



