人参是五加科物人参Panax ginseng C.A, Mey.的干燥根,是我国传统珍贵的中药材,具有对多种疾病防治效果和对人体滋补强壮作用,其主要有效成分为人参皂苷和人参多糖[1]。人参皂苷Rg3是从中药人参中提取的单一成分[2],是一种四环三萜皂苷,为原人参二醇型皂苷,是人参中的微量皂苷,分子式为C42H72O13,相对分子质量为784[3]。人参皂苷Rg3在抗肿瘤方面有明显的药理作用,它具有最佳的细胞凋亡效应,能选择性地抑制肿瘤细胞转移,提高机体免疫功能,临床批准于癌症治疗[4-5]。
人参皂苷Rg3作为一种抗肿瘤药物进入体内,经过吸收分布代谢排泄等一系列过程,因此人参皂苷Rg3的药代动力学研究必不可少[6]。人参皂苷Rg3在大鼠[3, 7-9]、狗[10]、人体[11-12]内的药代动力学研究已有报道,但在文献[3, 7-9]报道中人参皂苷Rg3在大鼠体内的药动学参数存在较大差异。因此本研究以大鼠作为实验动物,研究口服灌胃后的人参皂苷Rg3在大鼠体内的药代动力学过程,为新药开发和吸收机制进一步研究提供参考。人参皂苷Rg3的血药浓度测定主要采用液相色谱-蒸发光散射检测法、液相色谱-紫外检测法(LC-UV)和液相色谱-串联质谱法(LC-MS/MS)。由于大鼠眼眶取血采血体积小且人参皂苷Rg3在大鼠体内的血药浓度很低,而文献[7-9, 11]报道的方法存在灵敏度不高、预处理方法成本高、取样量大等问题,不能满足本实验的需求。本实验在文献[7-14]的基础上建立了快速、灵敏、经济、取样量少的液相色谱-质谱联用法,并将该法用于人参皂苷Rg3在大鼠体内药代动力学研究。
1 材料与方法 1.1 仪器SHIMADZU SIL-30AC高效液相色谱仪,AB Sciex QTRAP 5500质谱仪;冷冻离心机(美国Thermo公司);超纯水器(Milli-Q plus,USA,Millipore公司);KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司);BT-Ⅱ水浴式氮吹仪(北京踏锦科技有限公司);GENIUS 3型漩涡混匀器(德国IKA);BP211D型赛多利斯电子天平(德国赛多利斯公司);数据采集和处理系统:Analyst1.6.2。
1.2 药品与试剂人参皂苷Rg3对照品:CFS201601,含量98%,Chem Faces公司;三七皂苷R1对照品:Must-12020215,含量98%,Chengdu Must Bio-Technology Co.;甲醇、乙腈、乙酸乙酯(色谱纯)美国迪马公司;乙酸铵(色谱纯),FLUKA公司;水为超纯水。
1.3 实验动物6~8周SD大鼠,6只,体质量210~230 g,雄性,由陆军军医大学实验动物中心提供,许可证号SCXK(渝)-2017-0002。
1.4 方法 1.4.1 实验方案将健康雄性SD大鼠6只,实验前禁食12 h,次日空腹灌胃20 mg/kg人参皂苷Rg3。给药后于0.25、0.5、1、1.5、2、3、4、6、8、10、12 h从大鼠眼眶静脉取血0.3 mL置于肝素抗凝管中,3 000 r/min离心5 min,取上清液于-70 ℃冰箱保存待测。HPLC-MS/MS法测定大鼠血浆中人参皂苷Rg3浓度,采用DAS 3.3.1软件对血药浓度数据进行分析,非房室模型方法计算药代动力学统计矩参数。
1.4.2 色谱条件色谱柱:Inertsil ODS-3(2.1 mm× 50 mm,5 μm),Dikma公司生产;柱温:35 ℃;流动相:乙腈﹕10 mmol/L乙酸铵水溶液(含0.1%甲酸)= 90 :10;流速:0.4 mL/min;进样量:5 μL。
1.4.3 质谱条件ESI离子源:离子源电压:-4 500 V,离子源温度:450.0 ℃;检测方式:多反应监测(MRM), 负离子模式;定量分析监测离子对:人参皂苷Rg3:783.3→161.0,去簇电压(DP):-5.5 V,碰撞能(CE):-43.4 V;三七皂苷R1:931.3→637.3(图 1);去簇电压(DP):-195.0 V;碰撞能(CE):-48.0 V。
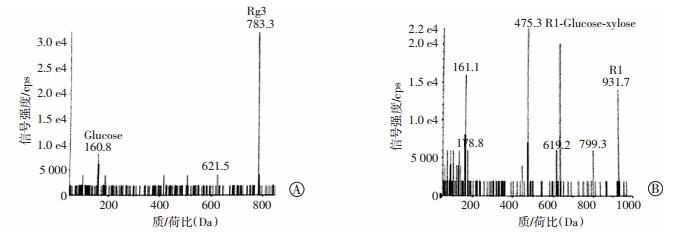
|
| 图 1 人参皂苷Rg3(A)和三七皂苷R1(B)质谱分析 |
1.4.4 溶液的配制
精密称取人参皂苷Rg3对照品适量,置于10 mL容量瓶中,用甲醇溶解并稀释至刻度,获得浓度为1.0 mg/mL的储备液,用甲醇稀释成浓度为0.2、0.4、0.8、2、4、8、20、40 μg/mL人参皂苷Rg3系列标准液;精密称取三七皂苷R1对照品适量,置于10 mL容量瓶中,用甲醇溶解并稀释至刻度,获得浓度为1.0 mg/mL的储备液,用甲醇稀释成浓度为5 μg/mL三七皂苷R1内标溶液;4 ℃冰箱保存备用。
1.4.5 样品处理取待测血浆0.05 mL,加入10 μL三七皂苷R1内标甲醇溶液(5 μg/mL),混匀30 s;加入1 mL乙酸乙酯,混匀提取5 min,离心5 min(13 000 r/min),取上清液900 μL,40 ℃氮气吹干,0.1 mL乙腈复溶,5 μL进样测定。
1.4.6 专属性分别取6只大鼠空白血浆、空白血浆加人参皂苷Rg3 40 ng/mL和三七皂苷R1 500 ng/mL以及大鼠灌胃给药后1.5 h的血浆样品,按“2.5”项下操作考察人参皂苷Rg3和三七皂苷R1的专属性。
1.4.7 标准曲线和定量下限从浓度分别为0.2、0.4、0.8、2、4、8、20、40 μg/mL人参皂苷Rg3系列标准液中各取10 μL分别加入990 μL空白血浆中,得浓度分别为2、4、8、20、40、80、200、400 ng/mL的人参皂苷Rg3血样。按样品处理方法处理后进样分析,以待测物浓度X为横坐标,待测物与内标的峰面积比值Y为纵坐标,进行回归运算求得人参皂苷Rg3的标准曲线。配制成相当于人参皂苷Rg3血浆浓度为2 ng/mL的样品,对该浓度样品进行5样本分析,并根据当日标准曲线计算每一样本测得浓度即为定量下限。
1.4.8 基质效应分别取6只大鼠100 μL空白血浆按“1.4.5项”下处理血样,取乙腈复溶液作为溶剂,配制与质控样品浓度一致的低、高浓度质控样品进样后所得峰面积为AMatrix;另用乙腈作溶剂配制与其相同浓度的低、高浓度对照品进样后所得峰面积为AStandard,按公式AMatrix·AStandard-1×100%计算所得基质效应因子MF(matrix factor,MF),同法处理内标得到内标的MF,人参皂苷Rg3与内标的比值为内标归一化基质效应因子(IS-normalized MF)。
1.4.9 精密度与准确度按“1.4.7”项下的方法配制最低定量限、低、中、高4个浓度的质控样品,每一浓度进行5样本分析,在同一批内计算本法的批内精密度;连续测定3批,计算本法的批间精密度;同法配制最低定量限、低、中、高4个浓度的质控样品,每一浓度进行5样本分析,根据标准曲线计算所得浓度与理论浓度的比值即为相对回收率。
1.4.10 提取回收率按“1.4.7”项下的方法配制低、中、高3个浓度的质控样品,每一浓度进行5样本分析;另用乙腈作溶剂配制与血浆处理后乙腈复溶后进样浓度相同的低、中、高浓度的对照品溶液,每一浓度进行5样本分析,每一浓度两种处理方式的峰面积比值计算提取回收率。
1.4.11 稳定性配制低、中、高3个浓度的血浆样品,每一种浓度水平进行3样本分析,分别考察人参皂苷Rg3血浆样品经处理后室温放置5 h的稳定性,血浆样品室温放置2 h的稳定性,血浆样品经历3次冷冻-解冻循环的稳定性,血浆样品-70 ℃冷冻保存16 d的稳定性。
2 结果 2.1 专属性本实验条件下,人参皂苷Rg3和三七皂苷R1的保留时间分别为0.64、0.34 min,空白血浆中的内源性物质不干扰人参皂苷Rg3和三七皂苷R1的测定(图 2)。

|
| A:空白血浆;B:空白血浆+人参皂苷Rg3(40 ng/mL)+三七皂苷R1(500 ng/mL);C:大鼠灌胃给药人参皂苷Rg3 20 mg/kg后1.5 h血浆样品分析 图 2 大鼠血浆中人参皂苷Rg3和三七皂苷R1典型色谱分析 |
2.2 标准曲线和定量下限
以人参皂苷Rg3浓度X为横坐标,人参皂苷Rg3与三七皂苷R1的峰面积比值Y为纵坐标,进行回归运算得标准曲线方程为Y=0.004 51X+0.000 172(权重系数1/X2),R=0.998 9。人参皂苷Rg3的线性范围为2~400 ng/mL。人参皂苷Rg3的定量下限为2 ng/mL,该浓度下人参皂苷Rg3的RSD为7.65%。
2.3 基质效应人参皂苷Rg3低浓度相对基质效应分别为(98.78±4.18)%,高浓度相对基质效应为(100.31±2.19)%,RSD分别为4.24%,2.19%(表 1)。
| 理论浓度 /ng·mL-1 |
批内精密度(n=5) | 批间精密度(n=15) | 相对回收率 | 提取回收率 (%) |
基质效应 (%) |
|||||
| 测得浓度 /ng·mL-1 |
RSD(%) | 测得浓度 /ng·mL-1 |
RSD(%) | 测得浓度 /ng·mL-1 |
RSD(%) | |||||
| 2 | 2.06±0.08 | 3.92 | 1.98±0.17 | 8.56 | 2.11±0.07 | 3.40 | - | - | ||
| 4 | 4.53±0.32 | 6.96 | 4.21±0.38 | 8.96 | 4.24±0.27 | 6.36 | 76.89±2.91 | 98.78±4.18 | ||
| 40 | 45.28±2.69 | 5.95 | 41.69±4.75 | 11.38 | 43.98±2.15 | 4.88 | 73.17±3.97 | - | ||
| 320 | 331.20±12.36 | 3.73 | 323.47±26.31 | 8.13 | 347.60±12.46 | 3.59 | 72.24±0.96 | 100.32±2.13 | ||
2.4 精密度与准确度
人参皂苷Rg3每一浓度水平样品的批内精密度RSD在3.73%~6.96%之间;批间精密度RSD在8.13%~11.38%之间;相对回收率RSD在3.40%~6.36%之间(表 1)。
2.5 提取回收率低、中、高3个浓度的质控样品提取回收率,结果见表 1。
2.6 稳定性考察了人参皂苷Rg3血样经处理后室温放置5 h,血样室温放置2 h,血样经历3次冷冻-解冻循环,血样-70 ℃冷冻保存16 d的稳定性。各样品浓度的RSD<±15%,结果见表 2。
| 理论浓度/ng·mL-1 | 室温放置 | 处理后稳定性 | 反复冻融3次 | 冷冻稳定性 | |||||||
| 测得浓度 /ng·mL-1 |
RSD(%) | 测得浓度 /ng·mL-1 |
RSD(%) | 测得浓度 /ng·mL-1 |
RSD(%) | 测得浓度 /ng·mL-1 |
RSD(%) | ||||
| 4 | 4.25±0.20 | 4.72 | 4.03±0.34 | 8.42 | 4.11±0.39 | 9.41 | 3.96±0.46 | 11.51 | |||
| 40 | 42.18±3.34 | 7.91 | 40.22±4.98 | 12.38 | 39.76±3.31 | 8.32 | 39.87±4.32 | 10.83 | |||
| 320 | 326.33±17.27 | 5.29 | 311.67±32.10 | 10.30 | 302.89±17.40 | 5.74 | 300.13±30.37 | 10.15 | |||
2.7 药代动力学试验结果 2.7.1 药-时曲线
采用本试验建立的方法对6只大鼠口服灌胃20 mg/kg人参皂苷Rg3后血浆浓度进行测定,平均血药浓度-时间曲线见图 3。
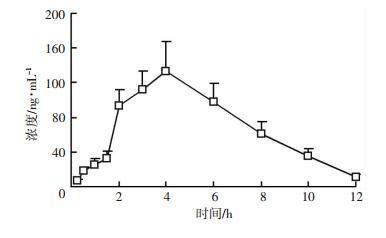
|
| 图 3 平均血药浓度-时间曲线 |
2.7.2 药代动力学参数
采用DAS 3.3.1软件非房室模型方法对其药动学参数进行统计,其主要药动学参数t1/2、Tmax、Cmax、AUC0~t、AUC0~∞、CLZ结果见表 3。
| 药代动力学参数 | Rg3 |
| AUC0-t | 821.659±170.125 ng·h/mL |
| AUC0-∞ | 912.468±190.653 ng·h/mL |
| Cmax | 138.803±28.997 ng/mL |
| t1/2 | 2.803±0.263 h |
| Tmax | 3.667±0.516 h |
| CLZ | 22.794±5.134 L/(h·kg) |
3 讨论
本实验建立了测定大鼠血浆中人参皂苷Rg3的HPLC-MS/MS分析方法,并运用本实验建立的方法测定了6只大鼠口服灌胃人参皂苷Rg3后大鼠血浆中人参皂苷Rg3的浓度。测得的大鼠血浆中人参皂苷Rg3血药浓度个体间差异较大,所得的药动学参数与文献[8-9]报道一致。
分析测试过程中采用负离子模式进行检测,人参皂苷Rg3在正、负离子模式下虽均有响应,但正离子模式分析时在标准曲线浓度范围内不成线性关系。提示正离子模式下[M+Na]+离子化效率不稳定,仅可用于定性分析。据文献[9, 11]报道采用固相萃取方法对样品进行预处理,该方法操作较为复杂且SPE柱成本较高。样品预处理我们采用了甲醇、乙腈沉淀蛋白、液-液萃取的方法对血浆样品进行预处理。但甲醇、乙腈沉淀蛋白方法灵敏度低且基质效应明显,影响仪器的稳定性和灵敏度。采用液-液萃取方法进行预处理时,比较了乙酸乙酯、乙醚、正己烷等提取试剂的效率,结果是乙酸乙酯提取的回收率一致且较高,能满足生物样本检测要求,且血浆取样量少。
文献[3]报道采用HPLC-UV方法测定人参皂苷Rg3的血药浓度,但该方法检测灵敏度低,定量下限仅为545 ng/mL。文献[11]报道采用HPLC-UV方法测定人参皂苷20(R)-Rg3的血药浓度,该方法检测灵敏度较高为2.5 ng/mL,但取样量大,而大鼠取血体积小,不能满足本试验的要求。另据文献[9]报道HPLC-MS/MS方法测定大鼠血浆中的人参皂苷Rg3浓度,最低检测限仅为10 ng/mL。本实验建立的测定大鼠血浆中人参皂苷Rg3的HPLC-MS/MS分析方法,定量下限可达2 ng/mL。经方法学验证,人参皂苷Rg3在一定浓度范围内线性关系良好,专属性、基质效应、精密度与准确度、稳定性等均符合生物样品分析的要求[15], 适用于大鼠体内人参皂苷Rg3的药代动力学研究。
| [1] |
黎阳, 张铁军, 刘素香, 陈常青. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164-166.
LI Y, ZHANG T J, LIU S X, et al. Research progress in chemical constituents and pharmacological activities of Panax ginseng[J]. Chin Tradit Herb Drugs, 2009, 40(1): 164-166. |
| [2] |
王金良, 孔佩艳, 徐葳, 等. 人参皂苷Rg3抑制急性白血病骨髓基质细胞HIF-1α及VEGF的表达及其机制探讨[J].
第三军医大学学报, 2010, 32(07): 621–624.
WANG J L, KONG P Y, XU W, et al. Ginsenosisde Rg3 inhibits HIF-1α and VEGF expressions in acute leukemia bone marrow stromal cells[J]. J Third Mil Med Univ, 2010, 32(07): 621–624. |
| [3] |
何凡, 孙小玲, 宿亚柳, 等. 人参皂苷Rg3及其代谢产物在大鼠体内组织分布研究[J].
中药药理与临床, 2015, 31(4): 14–16.
HE F, SUN X L, SU Y L, et al. Pharmacokinetics of ginsenoside Rg3 and its main metabolite in rats determined[J]. ?Pharmacol Clin Chin Materia Medica, 2015, 31(4): 14–16. |
| [4] |
江昌, 缪雨青, 周文丽, 等. 人参皂苷Rg3的抗肿瘤作用及研究进展[J].
临床肿瘤学杂志, 2017, 22(07): 664–667.
JIANG C, MIAO Y Q, ZHOU W L, et al. Research progress of ginsenoside Rg3 in anticancer activities[J]. Chin Clin Oncol, 2017, 22(07): 664–667. DOI:10.3969/j.issn.1009-0460.2017.07.019 |
| [5] | MOHANAN P, SUBRAMANIYAM S, MATHIYALAGAN R, et al. The molecular signaling of ginsenosides Rb1, Rg1, Rg3 and their mode of actions[J]. J Ginseng Res, 2017(1-10). |
| [6] |
段林瑞, 谢艳华, 王四旺. 人参皂苷Rg3药代动力学及抗肿瘤作用的研究进展[J].
现代生物医学进展, 2010, 10(4): 770–773.
DUAN L R, XIE Y H, WANG S W. Progress of ginsenoside Rg3 pharmacokinetics and antineoplastic mechanisms[J]. Prog Mod Biomed, 2010, 10(4): 770–773. |
| [7] |
刘继华, 卢丹, 刘金平, 等. 大鼠肌内注射20(S)-人参皂苷Rg3的药动学研究[J].
中国药学杂志, 2007, 42(14): 1087–1090.
LIU J H, LU D, LIU J P, et al. Studies on pharmacokinetics of 20(S)-Ginsenoside Rg3 after intramuscular administration to rats[J]. Chin Pharm J, 2007, 42(14): 1087–1090. DOI:10.3321/j.issn:1001-2494.2007.14.013 |
| [8] | PENG M, LI X, ZHANG T, et al. Stereoselective pharmacokinetic and metabolism studies of 20(S)- and 20(R)-ginsenoside Rg epimers in rat plasma by liquid chromatography-electrospray ionization mass spectrometry[J]. J Pharm Biomed Anal, 2016, 121: 215–224. DOI:10.1016/j.jpba.2016.01.020 |
| [9] | XIE H T, WANG G J, SUN J G, et al. High performance liquid chromatographic-mass spectrometric determination of ginsenoside Rg3 and its metabolites in rat plasma using solid-phase extraction for pharmacokinetic studies[J]. J Chromatogr B, 2005, 818(2): 167–173. DOI:10.1016/j.jchromb.2004.12.028 |
| [10] | LI K, CHEN X, XU J, et al. Liquid chromatography/tandem mass spectrometry for pharmacokinetic studies of 20(R)-ginsenoside Rg3 in dog[J]. Rapid Commun Mass Spectrom, 2005, 19(6): 813–817. DOI:10.1002/rcm.1862 |
| [11] |
庞焕, 汪海林, 富力, 等. 20(R)-人参皂苷Rg3人体药代动力学研究[J].
药学学报, 2001, 36(3): 170–173.
PANG H, WANG H L, FU L, et al. Pharmaco- kinetics studies of 20(R)- Ginsenoside Rg3 in human volunteers[J]. Acta Pharm Sin, 2001, 36(3): 170–173. DOI:10.16438/j.0513-4870.2001.03.003 |
| [12] | ZHAO Q, ZHENG X, JIANG J, et al. Determination of ginsenoside Rg3 in human plasma and urine by high performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2010, 878(24): 2266–2273. DOI:10.1016/j.jchromb.2010.06.019 |
| [13] |
康安, 钱静, 单进军, 等. 人参总皂苷主要成分大鼠体内药动学研究[J].
中草药, 2015, 46(20): 3045–3050.
KANG A, QIAN J, SHAN J J, et al. In vivo pharmacokinetic study on total saponins from roots of panax ginseng in rats[J]. Chin Tradit Herb Drugs, 2015, 46(20): 3045–3050. DOI:10.7501/j.issn.0253-2670.2015.20.014 |
| [14] |
刘妍如, 史鑫波, 陈永琴, 等. HPLC-ESI-MS/MS法同时测定珠子参中15种皂苷类化合物[J].
中草药, 2016, 47(19): 3502–3507.
LIU Y R, SHI X B, CHEN Y Q, et al. Simultaneous determination of 15 ginsenosides from panacis majoris rhizoma by HPLC-ESI-MS/MS method[J]. Chin Tradit Herb Drugs, 2016, 47(19): 3502–3507. DOI:10.7501/j.issn.0253-2670.2016.19.024 |
| [15] |
国家药典委员会. 中华人民共和国药典[M]. 2015版. 北京: 中国医药科技出版社, 2015: 363-368.
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. 2015 Ed. Beijing: Chinese Medicine Science and Technology Press, 2015: 363-368. |



