急性心肌梗死(acute myocardial infarction,AMI)后90 min以内,经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)可以让90%闭塞的冠状动脉再开放,显著降低患者病死率[1-2]。然而,其中很大一部分患者由于存在微循环功能障碍,首次PCI后仍表现为心肌血流灌注不足,最终可能导致更大面积的心肌梗死、不良的左心室重构或死亡[2-4]。因此,阻止微循环功能障碍,促进微血管血流恢复,变得尤为重要。促进缺血诱导的、以新生血管出芽、迁移、单核细胞并入为主要特征的血管新生能增加心肌微血管密度,有效恢复微循环血流,改善这部分患者的临床预后[1-2]。
微小RNA(microRNA,miRNA)是一种长度为20~ 25个核苷酸、高度保守的内源性小分子非编码RNA,通过靶向结合特定mRNA 3′端非编码区(3′UTR),从而抑制蛋白翻译或者促进mRNA降解[5-6]。作为一种新型的调控分子,miRNA广泛参与了细胞增殖、分化等许多病理生理过程,其中包括对内皮功能的调节,如miR-92a、miR-204[5-6]。miR-145是动脉血管中表达含量最高的miRNA,其在血管平滑肌细胞中高表达,在内皮细胞中的表达量为血管平滑肌细胞的10%,血管损伤或者发生动脉粥样硬化、动脉瘤均会导致其表达下降[7-9]。近年研究亦发现,miR-145是内皮细胞和血管平滑肌细胞间串扰的重要信号分子之一,具有促进平滑肌细胞分化、抑制其增殖和抗动脉粥样硬化等作用[10-12]。本研究在构建miR-145过表达和干扰重组腺病毒基础上,再分别体外转染人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),观察对细胞增殖和血管形成能力的影响,以期为心肌微循环功能障碍的AMI患者的治疗提供理论依据。
1 材料与方法 1.1 材料 1.1.1 质粒、细菌及细胞pHBAd-EF1-MCS-GFP质粒、pHBAd-U6-Scramble-CMV-GFP质粒、pHBAd- BHG骨架质粒购自Hanbio公司;感受态大肠杆菌菌株DH5α购自Invitrogen公司;HEK293细胞和HUVECs均由重庆医科大学超声医学工程重点实验室保存。
1.1.2 主要实验试剂TRIzol试剂、Lipofectamine 3000转染试剂购自Invitrogen公司;限制性内切酶BamHⅠ、EcoRⅠ、T4连接酶、DNA ladder购自Fermentas公司;质粒DNA抽提试剂盒购自康为世纪公司;凝胶回收试剂盒购自Axygen公司;胎牛血清、胰酶、DMEM高糖培养基购自Gibco公司;反转录和实时荧光定量PCR试剂盒购自Promega公司;MTT细胞增殖及细胞毒性检测试剂盒购自博士德生物公司;BD Matrigel基质胶购自Corning公司;环磷腺苷反应元件结合蛋白(cAMP response element-binding protein, CREB)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、GAPDH一抗购自Proteintech公司;羊抗兔二抗购自中杉金桥公司;psiCHECK-2载体质粒购自Promega公司。
1.1.3 主要仪器超净工作台购自上海博迅医疗生物仪器股份有限公司;离心机购自上海医用分析仪厂;BS60型恒温水浴箱购自Nikon公司;细胞培养箱购自Thermo Scientific公司;PCR仪购自Bio-Rad公司;倒置光学显微镜CKX-41型购自Olympus公司;低温冰箱MDF-382E购自日本三洋公司;全自动酶标仪购自Gene公司。
1.2 实验方法 1.2.1 miR-145过表达和干扰重组质粒的构建根据NCBI miR-145前体序列(GenBank编号MI0000169)和反向互补序列(3′-AGGGATTCCTGGGAAAACTGGAC-5′)分别设计miR-145过表达和干扰PCR引物,并由上海桑尼生物公司合成。过表达序列上游:5′-ATAGAATTCATCACTGGCCAGAGTCCCCGT-3′,下游:5′-ATAGGATCCTCAGAGTGGAGGGGAGCCGTC-TCA-3′。干扰序列上游:5′-AATTAGGGATTCCTGGGAAAACTGGACTTTTTTG-3′,下游:5′-GATCCAAA-AAAGTCCAGTTTTCCCAGGAATCCCT-3′。过表达和干扰目的片段分别来自于PCR扩增产物、3′和5′的单链退火获得,PCR程序:95 ℃ 5 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 20 s,扩增27个循环;72 ℃终末延伸10 min。退火程序:95 ℃ 10 min,75 ℃ 10 min,55 ℃ 10 min,35 ℃ 10 min,15 ℃ 10 min。利用EcoRⅠ、BamHⅠ双酶切体系分别将miR-145过表达和干扰序列插入pHBAd-EF1-MCS-GFP和pHBAd-U6-Scramble-CMV-GFP载体EF1和U6启动子之后,构建miR-145过表达和干扰重组质粒。再将重组质粒转入大肠杆菌DH5α感受态细胞,37 ℃培养过夜,挑取阳性克隆菌进行基因测序鉴定。
1.2.2 miR-145过表达和干扰重组腺病毒质粒的包装与扩增病毒包装前24 h,将HEK293细胞用DMEM高糖培养基添加10%FBS接种于直径60 mm的培养皿,待细胞生长密度达70%~80%时进行转染。取300 μL Opti-MEM稀释2 μg重组腺病毒质粒或4 μg骨架质粒并混匀。另取15 μL的Lipofectamine 3000,用300 μL的Opti-MEM培养液进行稀释。将两者混合,室温放置20 min加入细胞,37 ℃,5% CO2培养箱中培养。每天观察细胞出毒迹象,约48 h后细胞大部分病变并从底部脱落进行收毒。液氮和37 ℃水浴反复冻融3次,2 500×g离心5 min,收集上清液即为miR-145第1代毒种。按相同步骤扩增第2代毒种。收获病变细胞混悬液后,1 000×g离心5 min,弃上清,加入6 mL ST buffer(培养液+10%血清+2.5%甘油),涡旋振荡后反复冻融3次,2 500×g离心5 min,取上清作为第3代病毒,即高滴度病毒。
1.2.3 腺病毒滴度的检测和最佳感染复数(multiplicity of infection,MOI)值测定腺病毒滴度检测参照半数组织培养感染量(50% tissue culture infectious dose,TCID50)法[13]。
滴度(titer, T)计算公式:T=101+d(s-0.5),其中d=lg(稀释度),s=阳性比率之和(从第1个10倍稀释度算起)。两次重复实验得到的滴度值应相差≤100.7。
测定最佳MOI值时,将生长状态良好的HEK293细胞接种于24孔板(40 000个/孔),待生长融合率约90%时,分别按MOI 0、20、40、60、80、100添加腺病毒至各组,转染4 h后更换新鲜培养液,继续培养24 h后,荧光显微镜下拍照,观察腺病毒表达效率,同时观察细胞聚集和贴壁程度,以判断最佳MOI值。
1.2.4 qRT-PCR检测miR-145的表达情况将重组腺病毒和空载体病毒(adenovirus vector,Ad-vector)感染HUVECs,48 h后提取细胞总RNA,茎环法反转录成cDNA,qRT-PCR检测miR-145的表达情况。qRT-PCR反应条件:94 ℃ 20 s;55 ℃ 20 s;72 ℃ 90 s,重复37个循环。
1.2.5 MTT实验采用MTT实验检测miR-145过表达和干扰重组腺病毒感染后HUVECs的增殖情况。将处于对数生长期的HUVECs接种于96孔板(5 000个/孔),24 h后加入10 μL重组腺病毒/每孔,并设置空白细胞组和转染空载体组,每组5个复孔,分别在24、48、72 h和96 h加入10 μL MTT溶液,孵育4 h,每孔加入100 μL Formanzan溶解液,孵育4 h,在酶联免疫检测仪570 nm测定光密度值[D(570)]。
1.2.6 小管形成实验HUVECs转染各重组腺病毒步骤同前。48 h后常规胰酶消化、计数,按每孔2×104个细胞接种至预先铺好Matrigel基质胶的96孔板。6~8 h后显微镜下随机取5个视野拍照,再运用Image-Pro Plus软件计算小管总长度。
1.2.7 Western blotHUVECs分别感染miR-145过表达和干扰重组腺病毒,96 h后弃掉培养液,用冰预冷的PBS洗2遍,按每个T25培养瓶细胞加入100 μL裂解缓冲液(50 mmol/L hepes、500 mmol/L NaCl、10 g/L NP40、1 mg/L抑蛋白酶肽aprotinin及100 mg/L PMSF),冰浴5 min、震荡5 min,重复3个循环,刮取细胞,12 000×g离心15 min。收集上清,经BCA蛋白定量后,按4 :1体积比加入5×SDS上样缓冲液,98 ℃煮5 min。样品以10%SDS-PAGE电泳,100 V恒压2 h;常规转膜,5%脱脂奶粉封闭;兔多克隆PCNA、CREB、VEGF(5%脱脂奶粉1 :1 000稀释)抗体4 ℃孵育过夜,TBST洗脱10 min×3遍;鼠二抗(TBST 1 :5 000稀释)室温孵育1 h,TBST洗脱5 min×3遍;ECL化学发光检测。
1.2.8 生物信息学预测采用生物信息学软件miRanda、miRwalk和TargetScan 7.0预测miR-145靶基因及与CREB 3′UTR的结合位点。
1.2.9 双荧光素酶鉴定实验将目的基因CREB 3′UTR野生型(WT)和突变型(Mut)序列片段分别克隆进入psiCHECK-2质粒。96孔板接种HEK293细胞,待细胞生长融合度至70%~90%时,将目的质粒、突变型质粒分别与miR-145、Scrambled RNA混匀,按每孔0.15 μL加入Lipofectamine 3000转染试剂。转染48 h后按照Promega Dual-Luciferase system操作说明书,化学发光仪560 nm和465 nm波长分别检测4组萤火虫荧光素酶和海肾荧光素酶活性。
1.3 统计学处理应用SPSS 21.0和GraphPad Prism 5.0软件进行统计学分析和统计图制作,数据以x±s表示,多组均数间的比较采用单因素方差分析,组内数据比较采用t检验。
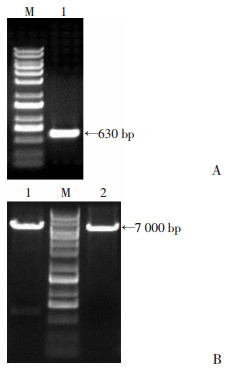
2 结果 2.1 miR-145过表达和干扰腺病毒载体的构建miR-145过表达和干扰质粒双酶切产物经1%琼脂糖凝胶电泳,在630 bp处见有一亮带(图 1A),即为miR-145过表达目的片段;酶切后的miR-145过表达和干扰质粒均位于约7 000 bp处(图 1B)。
|
| A:miR-145过表达目的序列PCR扩增产物M:标准;1:过表达目的序列;B:载体经EcoRⅠ、BamHⅠ双酶切1:过表达质粒;2:干扰质粒;M:标准 图 1 目的序列扩增和载体酶切后的电泳结果 |
2.2 miR-145过表达和干扰病毒载体的测序鉴定
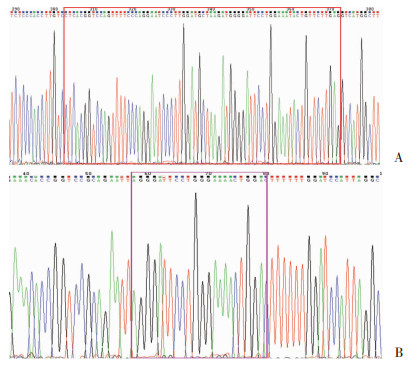
用T4连接酶分别将miR-145过表达和干扰目的片段与EcoRⅠ、BamHⅠ双酶切后的过表达和干扰质粒连接在一起,经大肠杆菌DH5α感受态细胞转化、筛选后进行基因测序。结果显示,miR-145过表达序列(图 2A)和干扰序列(图 2B)均与目标序列一致,说明质粒构建成功。
|
| A:miR-145过表达质粒;B:miR-145干扰质粒 图 2 载体构建的基因测序结果 |
2.3 腺病毒包装、扩增及滴度测定
miR-145过表达和干扰质粒分别与骨架质粒pHBAd-BHG共转染HEK293细胞24 h后,发现有细胞出毒现象,即细胞变大、变圆,呈葡萄状样改变,同时有明显噬斑出现。72 h后荧光显微镜下观察到荧光阳性细胞约75%,结果证实miR-145重组腺病毒成功转染和包装。经3轮扩增,7 d后收集到高滴度腺病毒浓缩悬液。按照TCID50法进行病毒滴度测定,miR-145过表达和干扰重组腺病毒滴度分别为1.26×1010、1.58×1010 PFU/mL。
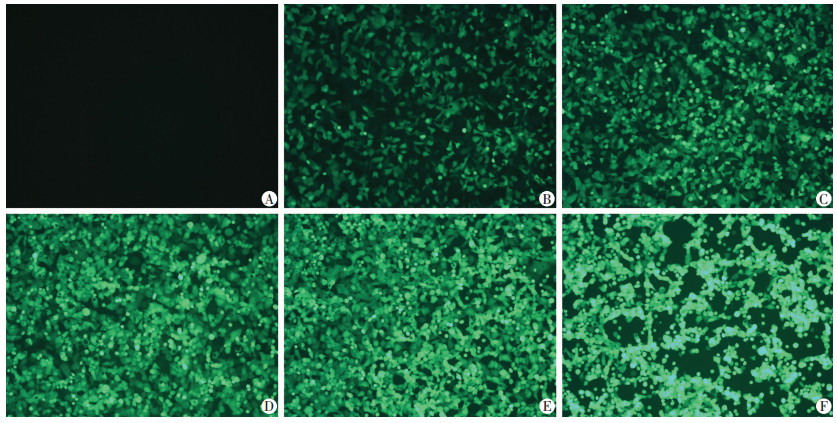
2.4 腺病毒最佳MOI值miR-145过表达腺病毒分别按0、20、40、60、80、100 MOI值感染HEK293细胞48 h,可以观察到绿色荧光蛋白表达随MOI值增大,呈逐渐上升趋势。当MOI值介于60~80之间时,绿色荧光表达较强,且细胞均贴壁生长,状态良好,无细胞聚集和分离现象(图 3),此为病毒感染的最佳MOI值。按同样的方法测定miR-145干扰腺病毒的最佳MOI值亦介于60~80之间。
|
| A~F:分别为MOI值0、20、40、60、80、100 图 3 miR-145过表达腺病毒按不同MOI值感染HEK293细胞48 h GFP表达情况(荧光显微镜×100) |
2.5 实时荧光定量PCR检测miR-145表达情况
重组腺病毒按最佳MOI值感染HUVECs 48 h后,采用qRT-PCR检测miR-145表达情况。感染miR-145过表达腺病毒的HUVECs中,miR-145表达量较对照组明显升高(P<0.01),同时干扰miR-145表达能够显著降低HUVECs miR-145表达量(P<0.05)。
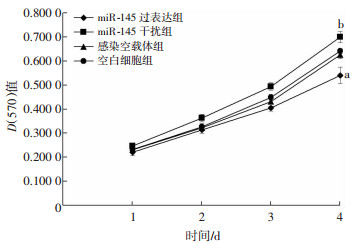
2.6 MTT实验利用MTT试剂盒检测细胞增殖,结果显示:与感染空载体组比较,miR-145过表达显著抑制了HUVECs的增殖,而miR-145干扰则促进HUVECs的增殖(P<0.05,P<0.01,图 4)。
|
| a:P<0.05,b: P<0.01,与感染空载体组比较 图 4 miR-145过表达及干扰腺病毒对HUVECs增殖的影响(n=5,x±s) |
2.7 小管形成实验
根据Image-Pro Plus计算统计结果,与感染空载体组比较,过表达miR-145显著抑制了HUVECs在Matrigel基质胶表面的小管生成能力(P<0.01),干扰miR-145表达则明显促进了HUVECs的小管生成(P<0.05,图 5)。
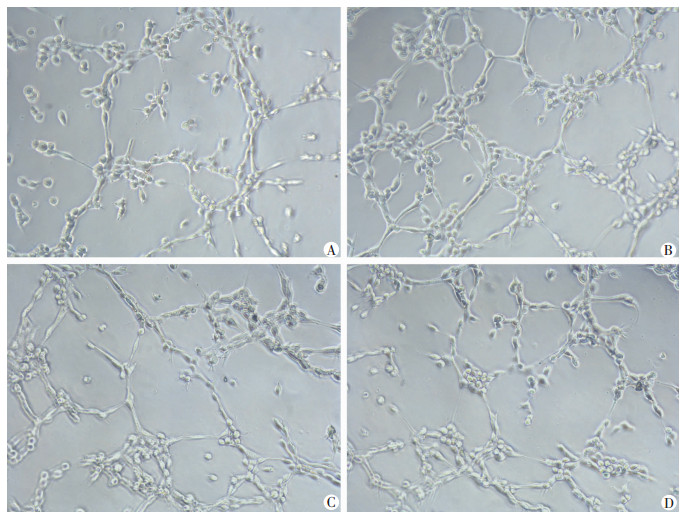
|
| A:miR-145过表达组;B:miR-145干扰组;C:感染空载体组;D:空白细胞组 图 5 miR-145过表达及干扰腺病毒对HUVECs小管形成的影响(LM ×100) |
2.8 生物信息学预测和双荧光素酶鉴定实验
生物信息学预测结果显示,miR-145能与人类基因CREB 3′UTR结合的位点有2个,1个位于第1 186~ 1 191个核苷酸(图 6A),另一个位于第4 378~4 384个核苷酸(图 6B)。双荧光素酶实验结果亦显示,与对照组相比,miR-145能使CREB(WT)的表达下调41.6%(P<0.01),而CREB(Mut)的表达不受miR-145的影响,即miR-145可直接与CREB 3′UTR结合。

|
| A:位于3′UTR第1 186~1 191个核苷酸;B:位于3′UTR第4 378~4 384个核苷酸 图 6 生物信息学预测miR-145与人类基因CREB的结合位点 |
2.9 Western blot结果
分别提取感染miR-145过表达和干扰重组腺病毒72 h的HUVECs与正常HUVECs的总蛋白进行Western blot检测,结果显示,与感染空载体组比较,miR-145过表达组CREB和VEGF蛋白受到明显抑制(P<0.05),而miR-145干扰组两者表达量显著增加(P<0.05);同时,miR-145过表达组PCNA表达量下降明显(P<0.01),细胞增殖受到明显抑制,miR-145干扰组PCNA表达量显著增加(P<0.05,图 7)。

|
| 1:miR-145过表达组;2:miR-145干扰组;3:感染空载体组;4:空白细胞组 图 7 Western blot检测HUVECs感染各组腺病毒后CREB、VEGF和PCNA蛋白表达 |
3 讨论
成熟的miRNA可整合到RNA诱导的沉默复合体(RNA-induced silencing complex,RISC)中,将其导向靶mRNA,从而产生翻译的抑制作用[14]。目前已超过1 000种人类miRNA被确定,并调控着人类50%的蛋白质编码基因[15-16]。据估计,人类基因组中1%~4%的基因是miRNA,单个miRNA可以调节多达200个mRNA[15]。其中miR-145已经被证实是血管中最丰富的miRNA[16]。既往研究表明miR-145能显著抑制膀胱癌、卵巢癌和肺癌等肿瘤血管新生[4-7]。但近年来,不少报道还发现miR-145在心血管系统疾病中发挥着重要作用,比如平滑肌细胞中的miR-145在动脉粥样硬化症发生时表达下调,并通过增加炎症细胞因子IL-6、IL-8和MCP-1等来促进动脉粥样斑块形成[17-18];研究者还证实,miR-145靶向cTnI和CK-MB,直接参与调节心肌梗死面积的大小[19]。
CREB作为一个早在1987年就被发现的转录因子,广泛参与调节细胞生长和分化。既往研究证实,CREB的激活能显著刺激VEGF的表达[20-22]。此外,CREB/VEGF信号通路与大脑发育、前列腺癌的转移等亦关系密切[20-23]。很多miRNA也能直接靶向调节CREB,比如miR-9、miR-23a、miR-200b等[24-26]。因此,CREB/VEGF信号通路是否参与了miR-145在急性心梗后血管新生中的调节作用值得进一步探讨。
本研究利用载体pHBAd-EF1-MCS-GFP和pHBAd- U6-Scramble-CMV-GFP成功完成miR-145过表达及干扰重组腺病毒的包装与扩增,收获高滴度重组腺病毒。一方面,我们利用构建的miR-145过表达及干扰重组腺病毒,证实了miR-145能够显著影响血管内皮细胞的增殖和血管新生能力;另一方面,双荧光素酶实验和Western blot分别在基因和蛋白的分子水平直接和间接证实了miR-145可以靶向抑制CREB/VEGF信号通路。因此,虽然miR-145的作用靶点较多,但通过本研究可以得出结论:miR-145调节血管新生,至少部分是通过靶向抑制CREB/VEGF信号通路实现的。这也为miR-145用于改善急性心肌梗塞症状及预后的临床研究提供了理论依据。
| [1] | KEELEY E C, BOURA J A, GRINES C L. Comparison of primary and facilitated percutaneous coronary interventions for ST-elevation myocardial infarction: quantitative review of randomised trials[J]. Lancet, 2006, 367(9510): 579–588. DOI:10.1016/S0140-6736(06)68148-8 |
| [2] | VAN DER LAAN A M, PIEK J J, VAN ROYEN N. Targeting angiogenesis to restore the microcirculation after reperfused MI[J]. Nat Rev Cardiol, 2009, 6(8): 515–523. DOI:10.1038/nrcardio.2009.103 |
| [3] | COCHAIN C, CHANNON K M, SILVESTRE J S. Angiogenesis in the infarcted myocardium[J]. Antioxid Redox Signal, 2013, 18(9): 1100–1113. DOI:10.1089/ars.2012.4849 |
| [4] | KAN X, WU Y, MA Y, et al. Deficiency of IL-12p35 improves cardiac repair after myocardial infarction by promoting angiogenesis[J]. Cardiovasc Res, 2016, 109(2): 249–259. DOI:10.1093/cvr/cvv255 |
| [5] | WELTEN S M, GOOSSENS E A, QUAX P H, et al. The multifactorial nature of microRNAs in vascular remodelling[J]. Cardiovasc Res, 2016, 110(1): 6–22. DOI:10.1093/cvr/cvw039 |
| [6] | GOU L, ZHAO L, SONG W, et al. Inhibition of miR-92a suppresses oxidative stress and improves endothelial function by upregulating heme oxygenase-1 in db/db mice[J]. Antioxid Redox Signal, 2018, 28(5): 358–370. DOI:10.1089/ars.2017.7005 |
| [7] | KASSAN M, VIKRAM A, LI Q, et al. MicroRNA-204 promotes vascular endoplasmic reticulum stress and endothelial dysfunction by targeting Sirtuin1[J]. Sci Rep, 2017, 7(1): 9308. DOI:10.1038/s41598-017-06721-y |
| [8] | CHENG Y, LIU X, YANG J, et al. MicroRNA-145, a novel smooth muscle cell phenotypic marker and modulator, controls vascular neointimal lesion formation[J]. Circ Res, 2009, 105(2): 158–166. DOI:10.1161/CIRCRESAHA.109.197517 |
| [9] | CLIMENT M, QUINTAVALLE M, MIRAGOLI M, et al. TGFβ triggers miR-143/145 transfer from smooth muscle cells to endothelial cells, thereby modulating vessel stabilization[J]. Circ Res, 2015, 116(11): 1753–1764. DOI:10.1161/CIRCRESAHA.116.305178 |
| [10] | CORDES K R, SHEEHY N T, WHITE M P, et al. MiR-145 and miR-143 regulate smooth muscle cell fate and plasticity[J]. Nature, 2009, 460(7256): 705–710. |
| [11] | HERGENREIDER E, HEYDT S, TREQUER K, et al. Atheroprotective communication between endothelial cells and smooth muscle cells through miRNAs[J]. Nat Cell Biol, 2012, 14(3): 249–256. DOI:10.1038/ncb2441 |
| [12] | LOVREN F, PAN Y, QUAN A, et al. MicroRNA-145 targeted therapy reduces atherosclerosis[J]. Circulation, 2012, 126(11 Suppl 1): S81–S90. |
| [13] | MARZI A, FELDMANN F, HANLEY P W, et al. Delayed disease progression in Cynomolgus Macaques infected with Ebola Virus Makona Strain[J]. Emerg Infect Dis, 2015, 21(10): 1777–1783. DOI:10.3201/eid2110.150259 |
| [14] | O'SULLIVAN J F, MARTIN K, CAPLICE N M. Microribonucleic acids for prevention of plaque rupture and in-stent restenosis: "a finger in the dam"[J]. J Am Coll Cardiol, 2011, 57(4): 383–389. DOI:10.1016/j.jacc.2010.09.029 |
| [15] | DONG Y M, LIU X X, WEI G Q, et al. Prediction of long-term outcome after acute myocardial infarction using circulating miR-145[J]. Scand J Clin Lab Invest, 2015, 75(1): 85–91. DOI:10.3109/00365513.2014.981855 |
| [16] | FRIEDMAN R C, FARH K K, BURGE C B, et al. Most mammalian mRNAs are conserved targets of microRNAs[J]. Genome Res, 2009, 19(1): 92–105. |
| [17] | ZHANG C. MicroRNA-145 in vascular smooth muscle cell biology: a new therapeutic target for vascular disease[J]. Cell Cycle, 2009, 8(21): 3469–3473. DOI:10.4161/cc.8.21.9837 |
| [18] | HIGASHI K, YAMADA Y, MINATOGUCHI S, et al. MicroRNA-145 repairs infarcted myocardium by accelerating cardiomyocyte autophagy[J]. Am J Physiol Heart Circ Physiol, 2015, 309(11): H1813–H1826. DOI:10.1152/ajpheart.00709.2014 |
| [19] | ORR A W, HASTINGS N E, BLACKMAN B R, et al. Complex regulation and function of the inflammatory smooth muscle cell phenotype in atherosclerosis[J]. J Vasc Res, 2010, 47(2): 168–180. DOI:10.1159/000250095 |
| [20] | WU D, ZHAU H E, HUANG W C, et al. cAMP-responsive element-binding protein regulates vascular endothelial growth factor expression: implication in human prostate cancer bone metastasis[J]. Oncogene, 2007, 26(35): 5070–5077. DOI:10.1038/sj.onc.1210316 |
| [21] | SHNEOR D, FOLBERG R, PEER J, et al. Stable knockdown of CREB, HIF-1 and HIF-2 by replication-competent retroviruses abrogates the responses to hypoxia in hepatocellular carcinoma[J]. Cancer Gene Ther, 2017, 24(2): 64–74. DOI:10.1038/cgt.2016.68 |
| [22] | RHEE S H, MA E L, LEE Y, et al. Corticotropin releasing hormone and Urocortin 3 stimulate vascular endothelial growth factor expression through the cAMP/CREB pathway[J]. J Biol Chem, 2015, 290(43): 26194–26203. DOI:10.1074/jbc.M115.678979 |
| [23] | KANG Z, ZHU H, LUAN H, et al. Curculigoside A induces angiogenesis through VCAM-1/Egr-3/CREB/VEGF signaling pathway[J]. Neuroscience, 2014, 267: 232–240. DOI:10.1016/j.neuroscience.2014.02.050 |
| [24] | TAN X, WANG S, YANG B, et al. The CREB-miR-9 negative feedback minicircuitry coordinates the migration and proliferation of glioma cells[J]. PLoS ONE, 2012, 7(11): e49570. DOI:10.1371/journal.pone.0049570 |
| [25] | TAN X, WANG S, ZHU L, et al. cAMP response element-binding protein promotes gliomagenesis by modulating the expression of oncogenic microRNA-23a[J]. Proc Natl Acad Sci U S A, 2012, 109(39): 15805–15810. DOI:10.1073/pnas.1207787109 |
| [26] | ZHANG J Q, YAO Q H, KUANG Y Q, et al. Prognostic value of coexistence of abnormal expression of micro-RNA-200b and cyclic adenosine monophosphate-responsive element-binding protein 1 in human astrocytoma[J]. Hum Pathol, 2014, 45(10): 2154–2161. DOI:10.1016/j.humpath.2014.01.025 |



