2. 400016 重庆, 重庆医科大学附属第一医院:胸心外科;
3. 332000 江西 九江, 江西省九江市第一人民医院耳鼻喉头颈外科;
4. 646000 四川 泸州, 西南医科大学附属医院耳鼻咽喉-头颈外科
2. Department of Cardiothoracic Surgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016;
3. Department of Otolaryngology, Head and Neck Surgery, Jiujiang First People's Hospital, Jiujiang, Jiangxi Province, 332000;
4. Department of Otolaryngology, Head and Neck Surgery, the Affiliated Hospital of Southwest Medical University, Luzhou, Sichuan Province, 646000, China
鼻咽癌是起源于鼻咽部上皮组织的恶性肿瘤, 其发病率和死亡率居于头颈部肿瘤前列[1]。我国南方是鼻咽癌好发区, 2015年该地区新发病例约占世界新发病例的65%[2]。虽然鼻咽癌目前的主要治疗方式仍是放射治疗, 但辅助化疗及分子靶向治疗等综合治疗可以提高中晚期鼻咽癌患者的预后。作为目前临床使用最为广泛的化疗药物之一, 紫杉醇也被应用于中晚期鼻咽癌患者的治疗中[3-4], 但频繁出现的耐药限制了其治疗效果, 也成为了中晚期患者治疗失败的重要原因[5-7]。因此, 进一步研究鼻咽癌肿瘤细胞对紫杉醇产生耐药的分子机制, 寻找可能的治疗靶点, 提高紫杉醇疗效就显得十分迫切。
转录因子叉头框M1(forkhead box protein M1, FoxM1)是重要的转录因子, 在胚胎或增殖活跃的组织中表达水平较高, 参与调控细胞增殖、凋亡、分化等过程。FoxM1在多种恶性肿瘤中显著上调, 在其发生、发展过程中扮演重要角色[8-10]。研究发现, FoxM1参与肿瘤细胞凋亡过程进而影响其对化疗药物的敏感性[11-12]。在非小细胞肺癌研究中发现, 沉默FoxM1后Bax表达上调、Bcl-2表达下调, 促进了耐多烯紫杉醇A549细胞的凋亡, 增加了其对多烯紫杉醇的敏感性[11]。本课题组前期研究中已证实FoxM1在鼻咽癌组织中呈高表达[13], 然而FoxM1的表达水平与鼻咽癌细胞紫杉醇化疗敏感性是否相关尚不清楚。本研究利用特异性siRNA沉默人鼻咽癌HONE-1细胞中FoxM1的表达, 探讨FoxM1对HONE-1细胞紫杉醇敏感性的影响及可能机制。
1 材料与方法 1.1 主要试剂RPMI1640、四甲基偶氮唑盐(MTT)(美国Sigma公司), 紫杉醇(美国Selleck公司), 兔抗人FoxM1抗体(美国Cell Signaling公司), 兔抗人Ki67、Cyclin E1抗体(美国Santa Cruz公司), ECL发光液、PVDF膜(美国Millipore公司), 胎牛血清(德国PAN公司), 兔抗人JNK、p-JNK、c-Jun、p-c-Jun、Bcl-2、Bax、MDR1、GAPDH抗体(英国abcam公司), PCR引物、RNA提取试剂Trizol、逆转录试剂盒、qRT-PCR SYBR Green(日本TaKaRa公司), FoxM1-siRNA、阳离子转染试剂siRNA-Mate(中国上海吉玛公司), 山羊抗兔二抗(中国武汉博士德公司), Annexin Ⅴ-FITC/碘化丙啶(propidiumiodide, PI)凋亡检测试剂盒、BCA试剂盒、SDS配胶试剂盒(中国上海碧云天生物公司)。
1.2 方法 1.2.1 细胞培养及转染人鼻咽癌HONE-1细胞株购于美国ATCC公司, 用含120 mL/L FBS的RPMI1640培养基常规培养。根据本课题组前期研究结果[14]构建, FoxM1-siRNA序列上游:5′-GCUGGGAUCAAGAUUAUUATT-3′, 下游:5′-UAAUAAUCUUGAUCCCAGCTT-3′; 阴性对照序列NC-siRNA上游:5′-UUCUCCGAACGUGUCACGUTT-3′, 下游:5′-ACGUGACACGUUCGGAGAATT-3′。取对数生长期细胞, 每孔约20×104铺于6孔板, 培养24 h后按说明书分别将100 nmol/L FoxM1-siRNA、100 nmol/L NC-siRNA以及RPMI1640培养液3组加入HONE-1细胞。继续培养48 h后提取RNA、蛋白及细胞, 进行PCR、Western blot、MTT等后续实验。
1.2.2 RT-PCR检测FoxM1基因的mRNA水平细胞转染48 h后用Trizol提取细胞RNA, 测浓度后进行逆转录。以2 μg cDNA为模板进行扩增。FoxM1引物序列正向:5′-GCCAACCGCTACTTGACATT-3′, 反向:5′-TTGATGGGTCTCGCTAAGTGT-3′; β-actin正向:5′-ACTCTTCCAGCCTTCCTTCCT-3′, 反向:5′-ACTCGTCATACTCCTGCTTGCT-3′。PCR条件:94 ℃预变性3 min, 94 ℃ 30 s、58 ℃ 30 s, 总共30个循环, 72 ℃延伸1 min。2%琼脂糖凝胶电泳, 用Bio-Rad Molecular Imager仪采集图片。
1.2.3 实时定量PCR检测FoxM1基因的mRNA水平用反转录试剂盒和qPCR Master Mix将1.2.2所提取的细胞RNA进行逆转录。FoxM1引物序列上游:5′-TGCAGCTAGGGATGTGAATCTTC-3′, 下游:5′-GGA-GCCCAGTCCATCAGAACT-3′; β-actin上游:5′-CCACGAAACTACCTTCAACTCC-3′, 下游:5′-GTGATCTCCT TCTGCATCCTGT-3′[15]。PCR反应条件参照文献[13]。采用CFX96TM Real-Time系统(Bio-Rad)检测, 用2-△△Ct法计算, 实验重复3次。
1.2.4 Western blot检测HONE-1细胞中FoxM1、Ki67、Cyclin E1、MDR1蛋白水平细胞转染48 h后分别提取3组细胞总蛋白, 30 μg蛋白上样, SDS-聚丙烯酰胺电泳, 转膜, 用含50 g/L蛋白干粉的TBST泡膜2 h, 加FoxM1(1 :1 000)、GAPDH(1 :8 000)、Ki67(1 :100)、Cyclin E1(1 :100)、MDR1(1 :1 000)兔抗人抗体, 4 ℃孵育。次日TBST洗膜后, 加二抗(1 :2 000)反应1 h, TBST洗3次, ECL Bio-Rad成像系统显影。实验重复3次。
1.2.5 MTT检测HONE-1细胞增殖细胞转染48 h后收集3组细胞分别制成悬液, 每孔1×103细胞, 200 μL培养基接种于96孔板, 设6个复孔。分别培养24、48、72、96、120 h后, 加入MTT 20 μL (5 mg/mL), 继续培养4 h后加入150 μL DMSO, 振荡10 min, 在570 nm波长处检测光密度值, 绘制增殖曲线。
1.2.6 流式细胞仪检测HONE-1细胞周期分布细胞转染48 h后收集3组细胞制成悬液, 用70%冰酒精固定。次日用PBS洗2次, 用RNase(100 mg/L)反应后加碘化乙碇(PI), 避光染色20 min, 上流式细胞仪检测周期分布。实验重复3次。
1.2.7 MTT法检测HONE-1细胞对紫杉醇的敏感性细胞转染48 h后收集细胞制成悬液, 将3组细胞按每孔5×103、180 μL悬液接种于96孔板, 培养过夜后分别加入20 μL不同浓度紫杉醇, 使终浓度为0、1、10、100、1 000、10 000 nmol/L[16], 48 h后常规MTT法检测细胞光密度值D(570)。存活率=[各浓度组D(570)-调零组D(570)]/[0 nmol/L组D(570)-调零组D(570)]×100%, 用SPSS计算紫杉醇半数抑制浓度(IC50)。实验重复3次。
1.2.8 Annexin V-FITC/PI双染法检测HONE-1细胞凋亡率取对数生长期细胞, 分别转染FoxM1-siRNA、NC-siRNA及RPMI1640培养液48 h后, 分别加入阴性对照组细胞IC20(终浓度15 nmol/L)紫杉醇以及相应体积培养基作对照, 继续培养48 h。分别收集6组细胞制成悬液, PBS洗后, 离心弃上清, 制成密度为1×106/mL悬液, 取其100 μL加入Annexin V-FITC和PI, 室温避光孵育15 min, 检测凋亡率。实验重复3次。
1.2.9 Western blot检测HONE-1细胞中FoxM1、JNK、p-JNK、c-Jun、p-c-Jun、Bax、Bcl-2蛋白水平取对数生长期细胞, 转染FoxM1-siRNA、NC-siRNA 48 h后分别加入阴性对照组细胞IC20(终浓度15 nmol/L)紫杉醇以及相应体积培养基作对照, 继续培养48 h后分别提取4组细胞总蛋白, 30 μg蛋白上样, SDS-聚丙烯酰胺电泳, 转膜, 用含50 g/L蛋白干粉的TBST泡膜2 h, 加FoxM1(1 :1 000)、JNK(1 :1 000)、p-JNK(1 :800)、c-Jun(1 :1 000)、p-c-Jun(1 :1 000)、Bcl-2(1 :500)、Bax(1 :2 000)兔抗人抗体, 4 ℃孵育。次日TBST洗膜后, 加二抗(1 :2 000)反应1 h, TBST洗3次, ECL Bio-Rad成像系统显影。实验重复3次。
1.3 统计学分析计量数据用x±s形式表示, 采用SPSS 21.0与GraphPad Prism 6处理, 多组间比较采用单因素方差分析, 组内两两比较采用SNK-q检验, 检验水准α=0.05。
2 结果 2.1 FoxM1-siRNA转染鼻咽癌HONE-1细胞后其mRNA和蛋白的表达RT-PCR和荧光定量PCR结果(图 1A、B)显示, FoxM1-siRNA转染组FoxM1 mRNA相对表达量明显低于阴性对照组(P < 0.01)及空白对照组(P < 0.01)。蛋白质印迹法检测结果显示(图 1C、D), FoxM1-siRNA转染组细胞FoxM1蛋白水平低于两对照组(P < 0.01)。以上结果提示, FoxM1-siRNA能有效沉默FoxM1基因。

|
| 1:空白对照组; 2:阴性对照组; 3:FoxM1-siRNA转染组; A:RT-PCR检测结果; B:Western blot检测FoxM1蛋白表达水平; C:qRT-PCR检测结果; D:FoxM1蛋白表达水平半定量分析结果; a:P < 0.01, 与阴性对照组及空白对照组比较 图 1 HONE-1细胞转染FoxM1-siRNA后FoxM1 mRNA和蛋白的表达水平 |
2.2 下调FoxM1对鼻咽癌HONE-1细胞增殖活力的影响
MTT结果显示(图 2A), FoxM1-siRNA转染组细胞从第2天开始增殖速度减慢(P < 0.05)。蛋白质印迹法检测(图 2B、C)发现FoxM1-siRNA转染组Ki67蛋白表达显著低于两对照组(P < 0.05)。结果提示, FoxM1基因表达下调可使鼻咽癌HONE-1细胞的增殖能力降低。
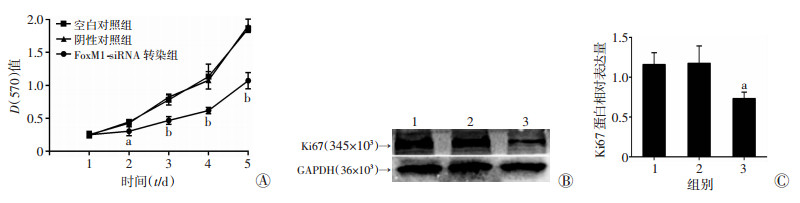
|
| 1:空白对照组; 2:阴性对照组; 3:FoxM1-siRNA转染组; A:MTT检测结果; B:Western blot检测Ki67蛋白表达水平; C:Ki67蛋白表达水平半定量分析; a:P < 0.05, b:P < 0.01, 与阴性对照组及空白对照组比较 图 2 转染FoxM1-siRNA对HONE-1细胞增殖能力及Ki67蛋白表达的影响 |
2.3 下调FoxM1对鼻咽癌HONE-1细胞周期分布的影响
流式细胞仪检测结果(图 3A、B)显示, FoxM1-siRNA转染组G1期细胞比例较空白对照组和阴性对照组明显增加(P < 0.01), S期细胞比例低于空白对照组和阴性对照组(P < 0.05)。蛋白质印迹法检测(图 3C、D)发现FoxM1-siRNA转染组细胞Cyclin E1蛋白表达量显著低于两对照组(P < 0.01)。上述结果表明, 下调FoxM1基因可将HONE-1细胞阻滞于G1期。
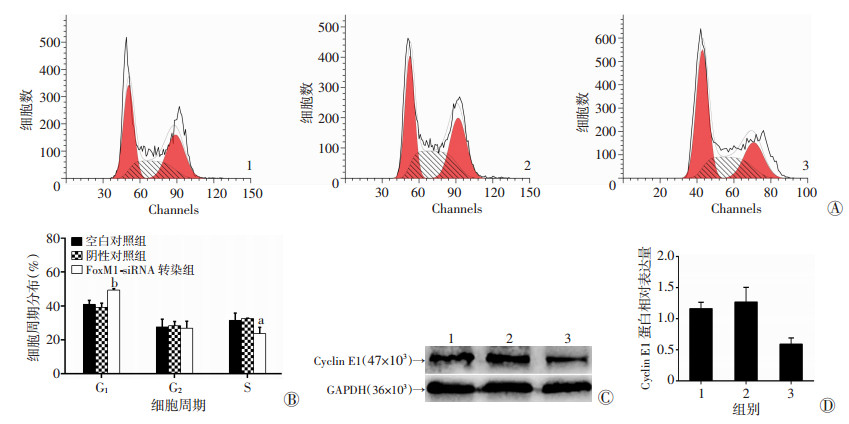
|
| 1:空白对照组; 2:阴性对照组; 3:FoxM1-siRNA转染组; A:流式细胞仪检测结果; B:细胞周期分布半定量分析结果; C:Western blot检测Cyclin E1蛋白表达水平; D:Cyclin E1蛋白表达水平半定量分析结果; a:P < 0.05, b:P < 0.01, 与阴性对照组及空白对照组比较 图 3 转染FoxM1-siRNA对HONE-1细胞周期分布及Cyclin E1蛋白表达的影响 |
2.4 下调FoxM1对鼻咽癌HONE-1细胞紫杉醇敏感性的影响
用不同浓度的紫杉醇处理3组细胞48 h, 发现HONE-1细胞的存活率随药物浓度增加逐渐降低(图 4A)。FoxM1-siRNA转染组、阴性对照组、空白对照组的IC50分别为(64.04±11.17)、(260.63±29.60)、(257.66±8.56) nmol/L。蛋白质印迹法检测结果(图 4B、C)显示, FoxM1-siRNA转染组细胞多药耐药基因MDR1的蛋白水平明显低于两对照组(P < 0.05)。结果表明, FoxM1-siRNA转染组细胞对紫杉醇的敏感性较两对照组明显增强(P < 0.01)。
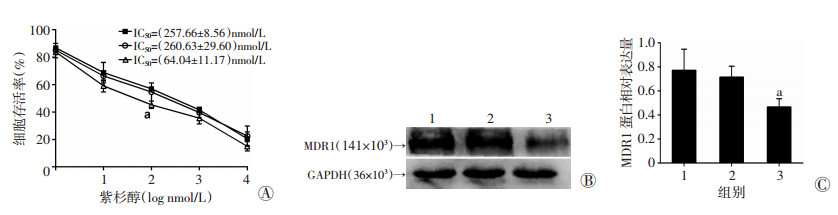
|
| 1:空白对照组; 2:阴性对照组; 3:FoxM1-siRNA转染组; A:MTT检测结果; B:Western blot检测MDR1蛋白表达水平; C:MDR1蛋白表达水平半定量分析结果; a:P < 0.05, 与阴性对照组及空白对照组比较 图 4 转染FoxM1-siRNA对HONE-1细胞紫杉醇敏感性及MDR1蛋白表达的影响 |
2.5 沉默FoxM1对鼻咽癌HONE-1细胞凋亡的影响
凋亡率检测结果(图 5)显示, FoxM1-siRNA转染组细胞凋亡率高于阴性对照组及空白对照组(P < 0.01), 同时, FoxM1-siRNA转染+紫杉醇组凋亡率高于阴性对照+紫杉醇组及空白对照+紫杉醇组(P < 0.01)。结果表明, FoxM1基因沉默促进了鼻咽癌HONE-1细胞紫杉醇作用下的凋亡。
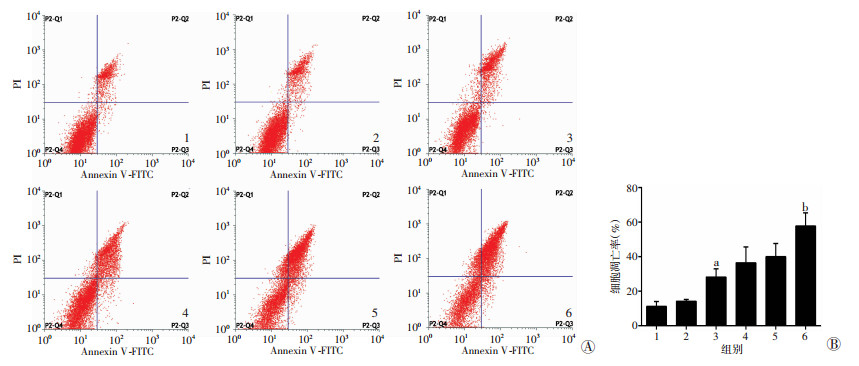
|
| 1:空白对照组; 2:阴性对照组; 3:FoxM1-siRNA转染组; 4:空白对照+紫杉醇组; 5:阴性对照+紫杉醇组; 6:FoxM1-siRNA转染+紫杉醇组; A:Annexin V-FITC/PI双染法检测结果; B:细胞凋亡率半定量分析结果; a:P < 0.01, 与阴性对照组及空白对照组比较; b:P < 0.01, 与阴性对照+紫杉醇组及空白对照+紫杉醇组比较 图 5 转染FoxM1-siRNA对紫杉醇处理下HONE-1细胞凋亡率的影响 |
2.6 下调FoxM1对JNK/线粒体通路活性的影响
蛋白质印迹法检测结果(图 6)显示, 与阴性对照组相比, siRNA组p-JNK1表达增高(P < 0.01), p-c-Jun表达上调(P < 0.01), Bax表达上调(P < 0.01), Bcl-2表达降低(P < 0.01)。同时, siRNA+紫杉醇组与阴性对照+紫杉醇组相比FoxM1蛋白表达下调(P < 0.01), Bcl-2蛋白表达降低(P < 0.01), p-JNK1、p-c-Jun和Bax表达均上调(P < 0.01)。
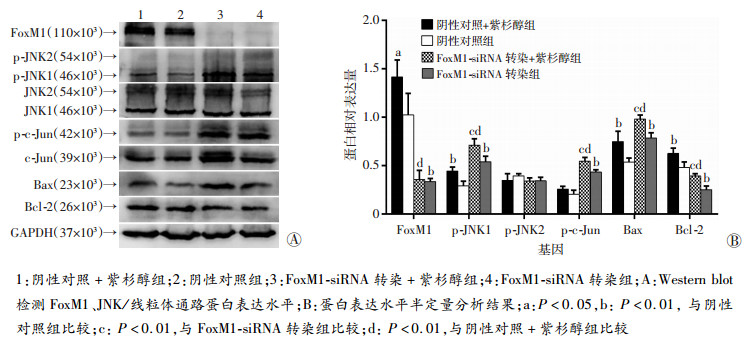
|
| 1:阴性对照+紫杉醇组; 2:阴性对照组; 3:FoxM1-siRNA转染+紫杉醇组; 4:FoxM1-siRNA转染组; A:Western blot检测FoxM1、JNK/线粒体通路蛋白表达水平; B:蛋白表达水平半定量分析结果; a:P < 0.05, b:P < 0.01, 与阴性对照组比较; c:P < 0.01, 与FoxM1-siRNA转染组比较; d:P < 0.01, 与阴性对照+紫杉醇组比较 图 6 转染FoxM1-siRNA及紫杉醇处理后HONE-1细胞FoxM1及JNK/线粒体通路蛋白水平的变化 |
3 讨论
FoxM1基因是Fox(Forkhead Box)家族成员之一[17], 在恶性肿瘤中通过调控细胞周期, 促进细胞增殖、抑制凋亡。近年来有研究发现下调FoxM1的表达可抑制胃癌、肝癌细胞的增殖能力, 延长肿瘤的倍增时间[18-19]。本研究下调FoxM1表达后发现, 鼻咽癌HONE-1细胞增殖能力受到抑制, 增殖细胞核抗原Ki67表达降低。进一步检测细胞周期分布, 结果提示下调FoxM1可使HONE-1细胞阻滞于G1期, 降低Cyclin E1表达, 抑制HONE-1细胞的增殖。
在乳腺癌[20]、胃癌[21]、肝癌[22]的研究中发现, FoxM1参与恶性肿瘤对紫杉醇的耐药, 下调肿瘤细胞内FoxM1的表达可以提高其对紫杉醇的敏感性。因此, FoxM1被认为是提高肿瘤细胞紫杉醇敏感性的可能靶点, 具有深入研究的价值。为了探讨FoxM1对鼻咽癌紫杉醇敏感性的关系, 我们检测了下调FoxM1前后HONE-1细胞紫杉醇半数抑制浓度, 发现下调FoxM1增强了鼻咽癌细胞对紫杉醇的敏感性, 降低了多药耐药基因MDR1的表达。
有研究显示, 药物靶点结构改变、DNA损伤修复活性升高以及凋亡途径受到抑制等均可能参与了紫杉醇耐药的产生, 但其具体的作用机制尚不十分清楚[23-25]。为了了解在鼻咽癌细胞中FoxM1是否作用于紫杉醇处理下的凋亡, 本研究检测了HONE-1细胞的凋亡率, 发现FoxM1的沉默促进了鼻咽癌HONE-1细胞紫杉醇作用下的凋亡。
FoxM1作为调控细胞周期的转录因子, 其转录活性与Ras-MAPK信号通路的活化密切相关[26], 而后者参与了细胞增殖、分化、凋亡等过程[27-28]。JNK通路作为MAPKs信号通路之一, 主要通过线粒体途径调节细胞凋亡[29]。有研究显示, 在骨肉瘤细胞中, FoxM1作为JNK通路的上游调节因子直接结合并激活JNK1启动子, 促进细胞G1/S期转换, 影响细胞增殖[26]。为探索JNK/线粒体通路在FoxM1提高鼻咽癌紫杉醇敏感性中的作用, 本研究检测了JNK/线粒体通路相关蛋白的表达, 发现沉默FoxM1及紫杉醇作用后HONE-1细胞p-JNK1、p-c-Jun和Bax表达水平增高, 凋亡抑制基因Bcl-2表达下降。这表明在鼻咽癌细胞株中下调FoxM1影响了JNK通路的活化, 降低了Bcl-2的表达, 提高了Bax表达水平, 促进了细胞凋亡。
综上所述, 本研究利用特异性siRNA沉默FoxM1表达可能通过影响JNK/线粒体通路活性抑制鼻咽癌HONE-1细胞增殖, 促进其凋亡, 提高其对紫杉醇的敏感性。本研究为寻找鼻咽癌可能的治疗靶点, 预测和增强紫杉醇疗效, 提高中晚期鼻咽癌患者生存质量提供了理论依据。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [2] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | CHEN C, WANG F H, AN X, et al. Triplet combination with paclitaxel, cisplatin and 5-FU is effective in metastatic and/or recurrent nasopharyngeal carcinoma[J]. Cancer Chemoth Pharm, 2012, 71(2): 371–378. DOI:10.1007/s00280-012-2020-x |
| [4] | HE X Y, HU C S, YING H M, et al. Paclitaxel with cisplatin in concurrent chemoradiotherapy for locally advanced nasopharyngeal carcinoma[J]. Eur Arch Otorhinolaryngol, 2010, 267(5): 773–778. DOI:10.1007/s00405-009-1112-7 |
| [5] | SU S F, HAN F, ZHAO C, et al. Long-term outcomes of early-stage nasopharyngeal carcinoma patients treated with intensity-modulated radiotherapy alone[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 327–333. DOI:10.1016/j.ijrobp.2010.09.011 |
| [6] | KAMRAN S C, RIAZ N, LEE N. Nasopharyngeal carcinoma[J]. Surg Oncol Clin N Am, 2015, 24(3): 547–561. DOI:10.1016/j.soc.2015.03.008 |
| [7] | FAYETTE J, MONTELLA A, CHABAUD S, et al. Paclitaxel is effective in relapsed head and neck squamous cell carcinoma:A retrospective study of 66 patients at a single institution[J]. Anticancer drug, 2010, 21(5): 553–558. DOI:10.1097/CAD.0b013e3283388e60 |
| [8] | KWOK J M, PECK B, MONTEIRO L J, et al. FOXM1 confers acquired cisplatin resistancein breastcancer cells[J]. Mol Cancer Res, 2010, 8(1): 24–34. DOI:10.1158/1541-7786.MCR-09-0432 |
| [9] | WANG Y, WEN L, ZHAO S H, et al. FoxM1 expression is significantly associated withcisplatin-based chemotherapy resistance and poor prognosis in advanced non-small celllung cancerpatients[J]. Lung Cancer, 2013, 79(2): 173–179. DOI:10.1016/j.lungcan.2012.10.019 |
| [10] | OKADA K, FUJIWARA Y, TAKAHASHI T, et al. Over-expression of forkhead box M1 transcriptionfactor (FOXM1) is a potential prognostic marker and enhances chemoresistance for docetaxel ingastric cancer[J]. Ann Surg Oncol, 2013, 20(3): 1035–1043. DOI:10.1245/s10434-012-2680-0 |
| [11] | WANG K, ZHU X, ZHANG K, et al. FoxM1 inhibition enhances chemosensitivity of docetaxel-resistant A549 cells to docetaxel via activation of JNK/mitochondrial pathway[J]. Acta Biochim Biophys Sin (Shanghai), 2016, 48(9): 804–809. DOI:10.1093/abbs/gmw072 |
| [12] | ZHAO F, SIU M K, JIANG L, et al. Overexpression of forkheadbox protein M1 (FOXM1) in ovarian cancer correlates with poor patient survival and contributes to paclitaxel resistance[J]. PLoS ONE, 2014, 9(11): e113478. DOI:10.1371/journal.pone.0113478 |
| [13] | JIANG L, WANG P, CHEN H. Overexpression of FOXM1 is associated with metastases of nasopharyngeal carcinoma[J]. Ups J Med Sci, 2014, 119(4): 324–332. DOI:10.3109/03009734.2014.960053 |
| [14] |
魏蕾, 江黎珠, 于超, 等. 下调FoxM1表达对人喉癌Hep-2细胞顺铂敏感性的影响[J].
第三军医大学学报, 2015, 37(16): 1603–1608.
WEI L, JIANG L Z, YU C, et al. FoxM1 down-regulation promotes sensitivity of laryngeal carcinoma Hep-2 cells to cisplatin[J]. J Third Mil Med Univ, 2015, 37(16): 1603–1608. DOI:10.16016/j.1000-5404.201411182 |
| [15] | JIANG L, WANG P, CHEN L, et al. Down-regulation of FoxM1 by thiostrepton or small interfering RNA inhibits proliferation, transformation ability and angiogenesis, and induces apoptosis of nasopharyngeal carcinoma cells[J]. Int J Clin Exp Pathol, 2014, 7(9): 5450–5460. |
| [16] |
权芳, 张少强, 白艳霞, 等. 白藜芦醇对缺氧环境中鼻咽癌细胞株CNE2的化疗增敏作用[J].
中西医结合学报, 2009, 7(10): 952–957.
QUAN F, ZHANG S Q, BAI Y X, et al. Resveratrol increases sensitivity of CNE2 cells to chemotherapeutic drugs under hypoxia[J]. J Chin Integr Med, 2009, 7(10): 952–957. |
| [17] | KAESTNER K H, KNOCHEL W, MARTINEZ D E. Unified nomenclature for the wingedhelix/forkhead transcription factors[J]. Genes Dev, 2000, 14(2): 142–146. |
| [18] | WU Q F, LIU C, TAI M H, et al. Knockdown of FoxM1 by siRNA interference decreasescell proliferation, induces cell cycle arrest and inhibits cell invasion in MHCC-97H cells in vitro[J]. Acta Pharmacol Sin, 2010, 31(3): 361–366. DOI:10.1038/aps.2010.4 |
| [19] | YU J, WANG X, LI Y, et al. TanshinoneⅡA suppresses gastric cancer cell proliferation and migration by downregulation of FOXM1[J]. Oncol Rep, 2017, 37(3): 1394–1400. DOI:10.3892/OR.2017.5408 |
| [20] | PANAYOTOPOULOU E G, MÜLLER A K, BÖRRIES M, et al. Targeting of apoptotic pathwaysby SMAC or BH3 mimetics distinctly sensitizes paclitaxel-resistant triple negative breast cancer cells[J]. Oncotarget, 2017, 8(28): 45088–45104. DOI:10.18632/ONCOTARGET.15125 |
| [21] | JIN H, PARK M H, KIM S M. 3, 3'-Diindolylmethane potentiates paclitaxel-induced antitumor effects on gastric cancer cells through the Akt/FOXM1 signaling cascade[J]. Oncol Rep, 2015, 33(4): 2031–2036. DOI:10.3892/or.2015.3758 |
| [22] | HUANG X, QIN J, LU S. Up-regulation of miR-877 induced by paclitaxel inhibitshepatocellular carcinoma cell proliferation though targeting FOXM1[J]. Int J Clin Exp Pathol, 2015, 8(2): 1515–1524. |
| [23] | FREDERIKS C N, LAM S W, GUCHELAAR H J, et al. Genetic polymorphisms andpaclitaxel-or docetaxel-induced toxicities:A systematic review[J]. Cancer Treat Rev, 2015, 41(10): 935–950. DOI:10.1016/j.ctrv.2015.10.010 |
| [24] | ZHAO Y, MU X, DU G. Microtubule-stabilizing agents:New drug discovery and cancer therapy[J]. Pharmacol Ther, 2016, 162: 134–143. DOI:10.1016/j.pharmthera.2015.12.006 |
| [25] | HOU Y, ZHU Q, LI Z, et al. The FOXM1-ABCC5 axis contributes to paclitaxel resistance in nasopharyngeal carcinoma cells[J]. Cell Death Dis, 2017, 8(3): e2659. DOI:10.1038/cddis.2017.53 |
| [26] | WANG I C, CHEN Y J, HUGHES D E, et al. FoxM1 regulates transcription of JNK1 to promote the G1/S transition and tumor cell invasiveness[J]. J Biol Chem, 2008, 283(30): 20770–20778. DOI:10.1074/jbc.M709892200 |
| [27] | WADA T, PENNINGER J M. Mitogen-activated protein kinases in apoptosisregulation[J]. Oncogene, 2004, 23(16): 2838–2849. DOI:10.1038/sj.onc.1207556 |
| [28] | RAGGATT L J, EVDOKIOU A, FINDLAY D M. Sustained activation of Erk1/2 MAPK and cell growth suppression by the insert-negative, but not the insert-positive isoform of the human calcitonin receptor[J]. J Endocrinol, 2000, 167(1): 93–105. DOI:10.1677/joe.0.1670093 |
| [29] | CHATTOPADHYAY S, MACHADO-PINILLA R, MANGUAN-GARCÍA C, et al. MKP1/CL100 controls tumor growth and sensitivity to cisplatin in non-small-cell lung cancer[J]. Oncogene, 2006, 25(23): 3335–3345. DOI:10.1038/sj.onc.1209364 |


