肺癌是全球范围内肿瘤死亡的最主要原因之一, 5年生存率不到15%[1]。在我国, 肺癌的发病率和病死率均位列第1位[2]。肺癌约有85%为非小细胞肺癌(non-small cell lung cancer, NSCLC), 它的主要治疗方式是手术合并术后的化疗, 但治疗效果仍不理想[3]。分子靶向治疗发展迅速, 找到一种有效的治疗靶点可能成为治疗NSCLC的有效途径。FBXL20(F-box and leucine rich repeat protein 20), 也称作SCRAPPER, 是E3泛素连接酶SCF(Skp1-Cullin-F-box)复合体中的一种蛋白, 最初发现与中枢神经系统的突触传递相关[4]。近年来, FBXL20与肿瘤的关系也在一些文献中被阐明。有人发现沉默FBXL20能降低肝癌SMMC-7721细胞的增殖和迁移能力[5]。本研究为探究FBXL20与NSCLC的关系, 通过RNA干扰技术降低了A549中FBXL20的表达水平, 观察其对A549细胞的影响并研究潜在的作用机制。
1 材料与方法 1.1 细胞株人非小细胞肺癌细胞株A549由分子肿瘤与表观遗传学重庆市重点实验室提供。采用RPMI1640培养基, 配以10%胎牛血清并加入100 U/mL青霉素及100 μg/mL链霉素, 在CO2浓度为5%的37 ℃孵箱内对A549进行培养。选取处于对数期且生长良好的细胞进行实验。
1.2 主要试剂RPMI1640培养基购于HyClone公司, 胎牛血清购于德国PAN Biotech公司, 青霉素、链霉素、胰酶和嘌呤霉素, 购于美国Gibco公司, 慢病毒购于上海吉凯基因化学技术有限公司, 蛋白裂解液(RIPA)、苯甲基磺酰氟(PMSF)、BCA试剂盒购于碧云天公司, CCK-8试剂盒购于日本Dojindo Molecular Technologies公司, 细胞周期测定试剂盒[内含RNase和碘化丙啶(propidium iodide, PI)]购于美国BD公司, 兔抗人FBXL20、Cyclin D1、GAPDH多克隆抗体购于北京博奥森生物技术有限公司, 鼠抗人CDK2、Cyclin E、CDK1、Cyclin A、Cyclin B1、ERK1/2、p-ERK1/2单克隆抗体购于Santa Cruz公司, 辣根过氧化物酶标记的山羊抗兔和抗小鼠IgG(二抗)购于ABGENT公司, PVDF膜、ECL化学发光试剂购于美国Millipore公司。
1.3 方法 1.3.1 慢病毒感染取对数生长期A549细胞, 用完全培养基制备密度为5×104/mL的细胞悬液, 取100 μL/孔按照不同分组加入96孔板, 培养24 h。吸去上清液并根据分组加入不同的试剂, 继续培养8~12 h后换液, 保持细胞正常生长。感染72 h后, 用显微镜观察绿色荧光, 并以感染效率在80%以上且细胞生长良好所对应的感染条件作为后续实验的依据。取对数期A549细胞, 以5×104/mL密度, 2 mL接种体积种板于6孔板中, 培养24 h。弃上清, 按照所确定的条件分别加入适量包含沉默FBXL20的shRNA的慢病毒(5′-ACTCCTGTTACGGATATTT-3′)及空载体病毒(5′-TTCTCCGAACGTGTCACGT-3′), 同时加入事先稀释好的Polybrene以增强感染效果, 并保持其终浓度为5 μg/mL, 后续操作同前。将感染成功的细胞转入培养瓶培养, 加入1 μg/mL嘌呤霉素2周, 得到稳定株。此后将A549细胞分为对照组(FBXL20-vector组)和干扰组(FBXL20-RNAi组)。
1.3.2 CCK-8增殖实验实验分为FBXL20-vector及FBXL20-RNAi两组。取对数期人非小细胞肺癌A549细胞, 以2×103/孔种板于96孔板, 每组设置5个复孔并于孵箱中培养。待细胞贴壁后加入100 μL RPMI1640培养液(包含10 μL CCK-8试剂), 孵箱中继续培养2 h后用酶联免疫检测仪测定细胞在450 nm处的光密度并记录数值, 设定时间点为0 h。此后24、48、72、96 h分别测定两组细胞的D(450), 最后根据时间和所测得的数值绘制细胞生长曲线。
1.3.3 集落形成实验取对数生长期FBXL20-vector及FBXL20-RNAi两组A549细胞, 以500/孔的密度铺板于6孔板, 每组设置3个复孔, 2周后出现肉眼可见的成团细胞集落, 终止培养, 期间视细胞状态换液。先后以4%多聚甲醛及结晶紫分别固定和染色20 min, 清水轻柔洗净干燥后扫描并计数。
1.3.4 流式细胞术检测细胞周期培养瓶中细胞融合度达80%~90%时, 用不含EDTA的胰酶将人肺腺癌细胞A549消化成单细胞悬液, 离心后吸尽上清液并用PBS重悬, 再次离心后收集细胞, 用2~3 mL预冷的70%冰乙醇轻轻将其吹散, 尽量保持为单个细胞的状态。置于4 ℃固定至少24 h, 离心弃上清并用2~3 mL PBS重悬, 重复至少2次。用400 μL PBS重悬, 加入2.5 μL RNase于37 ℃放置30 min, 再混入2 μL PI, 室温避光30 min后上机使用流式细胞仪做周期检测。
1.3.5 蛋白提取及蛋白质免疫印迹检测(Western blot)取对数生长的两组A549细胞, 弃培养基后用预冷的PBS充分清洗3次, 均匀加入适量RIPA及PMSF混合液(100 :1), 置于4 ℃摇床20 min后刮下细胞并收集于EP管中, 用超声对细胞进行裂解后4 ℃离心10 min, 将上清液转移到另一个EP管中即获得细胞总蛋白。之后用BCA法测定蛋白浓度, 加入蛋白上样缓冲液后在100 ℃的条件下变性10 min。根据想要测定的蛋白分子量配置相应浓度的聚丙烯酰胺凝胶, 以40 μg/孔进行电泳, 随后将分离后的蛋白电转至PVDF膜, 用浓度为50 μg/mL的脱脂奶粉(TBST配置)封闭1 h, 加入兔抗人FBXL20(1 :500)、Cyclin D1(1 :500)、GAPDH(1 :1 000), 鼠抗人CDK2(1 :500)、Cyclin E(1 :500)、CDK1(1 :500)、Cyclin A(1 :500)、Cyclin B1(1 :500)、ERK1/2(1 :750)、p-ERK1/2(1 :750)后4 ℃摇床过夜。TBST洗膜3次, 每次10 min。随后室温孵育二抗(1 :3 000)1 h, 再用TBST洗膜3次, 每次10 min。ECL化学发光试剂显影, 以GAPDH作为内参分析条带灰度值比值。
1.3.6 基因集富集分析(GSEA)通过http://software.broadinstitute.org/gsea/index.jsp下载GSEA软件, 从GEO数据库中的GSE31210数据集及TCGA数据库获取数据, 按照FBXL20表达水平中位数将数据分为高、低两组, 将整理好的数据及分组文件导入JAVA软件, 选取“h:hallmark gene sets”和“c2:curated gene sets”分析FBXL20的富集情况。结果中红色表示FBXL20高表达, 蓝色表示FBXL20低表达, 标准化富集分数(normalized enrichment score, NES)是富集分析的主要指标, 大于0表示该基因集富集于FBXL20高表达, 而小于0表示该基因集富集于FBXL20低表达, 值越大富集越显著。
1.4 统计学处理所有统计学结果均基于SPSS 20.0, 作图使用GraphPad Prism 7.00和Adobe Illustrator CS6。计量资料以x±s表示, 两组数据比较首先用单样本Kolmogorov-Smirnov检验查看数据是否符合正态分布, 如果符合, 则使用独立样本t检验, 如果不符合, 则使用非参数Mann-Whitney检验, 检验水准α=0.05。
2 结果 2.1 慢病毒成功干扰A549中FBXL20的蛋白表达结果表明, FBXL20-RNAi组中的FBXL20蛋白相对表达量(0.36±0.02)显著低于FBXL20-vector组(0.58±0.01), 差异有统计学意义(P < 0.01, 图 1)。说明在A549中FBXL20的shRNA慢病毒感染成功, 并构建出稳定株。
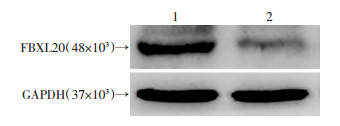
|
| 1:FBXL20-vector组; 2:FBXL20-RNAi组 图 1 感染慢病毒后不同处理组A549中FBXL20的蛋白表达 |
2.2 FBXL20的下调能促进A549细胞的增殖
通过CCK-8实验测量不同时间点A549细胞在450 nm处的光密度值, 我们发现FBXL20-RNAi组在48、72、96 h 3个时间点的测量结果均高于FBXL20-vector组, 差异有统计学意义(P < 0.05, 图 2)。结果表明下调FBXL20能有效提高A549细胞的增殖能力。

|
| a:P < 0.05, 与FBXL20-vector组比较 图 2 CCK-8实验检测不同处理组A549细胞增殖能力(n=3, x±s) |
2.3 细胞集落形成实验
细胞集落形成实验结果显示, 经过2周的培养, FBXL20-RNAi组A549细胞形成的集落数目为(100±20)个, 显著高于FBXL20-vector组所形成的(53±6)个集落数, 差异有统计学意义(P < 0.05, 图 3)。结果表明下调FBXL20的表达, 能够促进A549细胞的集落形成能力。
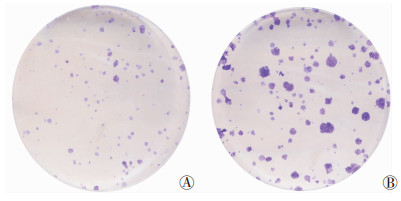
|
| A:FBXL20-vector组; B:FBXL20-RNAi组 图 3 不同处理组A549细胞集落形成能力(结晶紫) |
2.4 下调FBXL20显著减少了停留在G2/M期的A549细胞比例
我们已经发现FBXL20的下调会促进A549细胞的增殖, 因此采用流式细胞术检测FBXL20是否通过影响细胞周期来调控细胞的生长。结果显示, 相较于FBXL20-vector组, FBXL20-RNAi组G1期细胞比例无明显变化(47.11±1.09 vs 47.13±1.31)(P>0.05), G2/M期的细胞比例明显减少(5.65±1.35 vs 9.94±1.44), S期相对增多(47.23±0.56 vs 42.93±1.69), 差异有统计学意义(P < 0.05, 图 4A、B)。除此之外, TCGA及GSE31210的GSEA分析显示低表达FBXL20的样本富集于G2/M检查点的基因集(NES分别为-2.05和-2.99, P < 0.01)(图 4C、D), 证实了我们实验的结论。因此FBXL20的下调使得停留在G2/M期的细胞比例降低, 加快了周期的进程, 从而促进细胞的增殖。
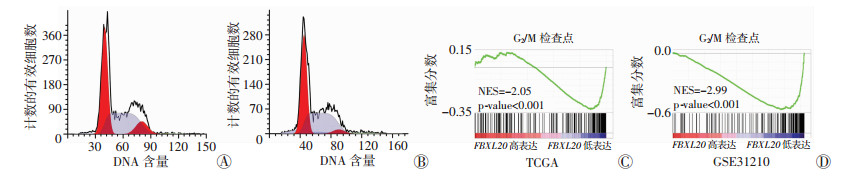
|
| A、B:流式细胞术检测FBXL20-vector、FBXL20-RNAi组细胞周期结果; C、D:TCGA、GSE中的GSEA分析结果(n=3, x±s) 图 4 流式细胞术检测不同处理组A549细胞周期及GSEA分析结果 |
2.5 干扰了FBXL20的表达后细胞周期相关蛋白的变化
Western blot结果显示, 相较于FBXL20-vector组, FBXL20-RNAi组中CDK2、Cyclin E、CDK1、Cyclin A、Cyclin B1的蛋白表达水平更高, 差异有统计学意义(P < 0.05), 而Cyclin D1无明显差异(P>0.05)。ERK1/2的磷酸化能抑制下游相关周期蛋白如CDK1、Cyclin A、Cyclin B1的表达, 因此我们检测了ERK1/2蛋白的变化。结果显示, 总的ERK1/2在干扰组和对照组无明显差异, 而干扰组p-ERK1/2显著低于对照组(图 5)。结果表明FBXL20的下调能够减少ERK蛋白的磷酸化, 从而增加G2/M周期相关蛋白的表达水平, 促进A549细胞增殖。

|
| A:Western blot检测结果; 1:FBXL20-vector组; 2:FBXL20-RNAi组; B:蛋白灰度值分析(n=3, x±s); 1:FBXL20;2:Cyclin D1;3:CDK2;4:Cyclin E; 5:CDK1;6:Cyclin A; 7:Cyclin B1;8:ERK1/2;9:p-ERK1/2;a:P < 0.05, 与FBXL20-vector组比较 图 5 Western blot检测不同处理组A549细胞相关蛋白表达量 |
3 讨论
FBXL20在肿瘤中扮演着不同的角色。ZHU等[6-8]研究发现, FBXL20基因在结直肠癌组织中的表达水平显著高于正常结直肠组织, 且能够通过Wnt通路和Caspase的激活促进结直肠癌的发生发展。除此之外, FBXL20可能通过介导E-cadherin的泛素化降解从而提高结直肠癌细胞的侵袭能力。有报道显示在正常核型急性髓系白血病中, 高表达的miR-3151是其不良结局的独立预后因子, 而FBXL20是miR-3151的直接靶标, miR-3151能降低FBXL20的表达, 因此FBXL20可能扮演着抑癌的角色[9]。同时, 有研究发现FBXL20在喉癌组织中的表达显著低于正常组织, 且与分化程度和有无淋巴结浸润相关, 可能是喉癌发生的一个抑制因子[10]。在本研究中, 我们首先利用慢病毒感染A549细胞, 通过Western blot验证干扰效果, 证实了在FBXL20-RNAi组中FBXL20表达降低, 随后研究FBXL20的降低对A549细胞生物学功能的影响。CCK-8和集落形成实验说明FBXL20的下调能促进A549细胞的生长能力, 流式细胞术结果显示下调FBXL20使得停留在G2/M期的细胞减少, 细胞周期加快。GSEA结果显示G2/M检查点基因集富集于低表达的FBXL20。以上结果提示FBXL20在NSCLC中可能起到了抑制癌症的作用, 与它在正常核型急性髓系白血病和喉癌中的角色相同。
为了理解FBXL20在NSCLC中的作用机制, 我们检测了细胞周期相关蛋白Cyclin D1、CDK2、Cyclin E、CDK1、Cyclin A、Cyclin B1的变化。Cyclin D1是细胞G1期所必需的蛋白, CDK2和Cyclin E结合形成复合体, 使细胞进入S期, 而CDK1、Cyclin A及Cyclin B1则是G2/M期的关键蛋白[11]。相较于FBXL20-vector组, 我们发现FBXL20-RNAi组中CyclinD1无明显变化, CDK2、Cyclin E、CDK1、Cyclin A及Cyclin B1显著增加, 说明FBXL20的下调没有影响到G1期, 而使得A549细胞加速进入了S期, 且加快了G2/M期的进程, 这与流式细胞术检测周期所得到的结果一致。早在1997年, WOODS等[12]就发现高度活化的Raf可以通过促进ERK1/2的磷酸化而上调p21的表达, 进而抑制Cyclin D-CDK4以及Cyclin E-CDK2复合物, 阻滞G1/S期。且研究发现在TP53缺失时, Raf/MEK/ERK的激活能够通过Sp1促进CDKN1A(p21)的转录而影响细胞周期[13]。不仅如此, 有文献报道称ERK1/2的磷酸化会导致p21的激活, 致使下游的CDK1、Cyclin A、Cyclin B1表达下降, 使周期阻滞于G2/M期[14-15]。因此我们检测了ERK1/2及p-ERK1/2的蛋白变化, 发现FBXL20-RNAi组中的ERK1/2较对照组无明显变化, 而p-ERK1/2则显著降低。
本研究发现, 下调的FBXL20能明显促进A549细胞的生长, 抑制ERK1/2的磷酸化并显著增加周期蛋白CDK2、Cyclin E、CDK1、Cyclin A及Cyclin B1的表达, 加快周期的进程, 初步揭示了FBXL20在NSCLC中可能通过调控ERK1/2的磷酸化影响细胞周期从而发挥抑癌作用的机制, 希望能为NSCLC的诊断和治疗提供参考。
| [1] | SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2013[J]. CA, 2013, 63(1): 11–30. DOI:10.3322/caac.21166 |
| [2] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | MOLINA J R, YANG P, CASSIVI S D, et al. Non-small cell lung cancer:epidemiology, risk factors, treatment, and survivorship[J]. Mayo Clinic Proceedings, 2008, 83(5): 584–594. DOI:10.4065/83.5.584 |
| [4] | YAO I, TAKAGI H, AGETA H, et al. SCRAPPER-dependent ubiquitination of active zone protein RIM1 regulates synaptic vesicle release[J]. Cell, 2007, 130(5): 943–957. DOI:10.1016/j.cell.2007.06.052 |
| [5] |
牛静静, 苗风济. siRNA靶向沉默fbxl20基因对肝癌SMMC-7721细胞生物学行为的影响[J].
川北医学院学报, 2012, 27(3): 221–225.
NIU J J, MIAO F J. Effect of siRNA targeted to fbxl20 on biological behavior of liver cancer SMMC-7721 cells[J]. J North Sichuan Med Coll, 2012, 27(3): 221–225. DOI:10.3969/j.issn.1005-3697.2012.03.007 |
| [6] |
朱晓华, 邓世山, 谢兴国, 等. 结直肠腺癌发病基因fbxl20和E-cadherin的相关性研究[J].
实用肿瘤学杂志, 2013, 28(6): 509–515.
ZHU X H, DENG S S, XIE X G, et al. The research about correlation of colorectal adenocarcinoma gene fbxl20 and E-cadherin[J]. J Pract Oncology, 2013, 28(6): 509–515. DOI:10.3969/j.issn.1002-3070.2013.06.007 |
| [7] | ZHU J J, LI K, DONG L, et al. Role of FBXL20 in human colorectal adenocarcinoma[J]. Oncol Rep, 2012, 28(6): 2290–2298. DOI:10.3892/or.2012.2065 |
| [8] | ZHU J J, DENG S S, DUAN J, et al. FBXL20 acts as an invasion inducer and mediates E-cadherin in colorectal adenocarcinoma[J]. Oncol Lett, 2014, 7(6): 2185–2191. DOI:10.3892/ol.2014.2031 |
| [9] | EISFELD A K, MARCUCCI G, MAHARRY K, et al. miR-3151 interplays with its host gene BAALC and independently affects outcome of patients with cytogenetically normal acute myeloid leukemia[J]. Blood, 2012, 120(2): 249–258. DOI:10.1182/blood-2012-02-408492 |
| [10] |
温蓓, 何刚. FBXL20在喉癌组织中的表达及意义[J].
成都医学院学报, 2016, 11(6): 706–708.
WEN B, HE G. The expression and significance of FBXL20 in laryngeal carcinoma tissues[J]. J Chengdu Med Coll, 2016, 11(6): 706–708. DOI:10.3969/j.issn.1674-2257.2016.06.015 |
| [11] |
高燕, 林莉萍, 丁健. 细胞周期调控的研究进展[J].
生命科学, 2005, 17(4): 318–322.
GAO Y, LIN L P, DING J. A review:cell cycle regulation[J]. Chin Bull Life Sci, 2005, 17(4): 318–322. DOI:10.3969/j.issn.1004-0374.2005.04.009 |
| [12] | WOODS D, PARRY D, CHERWINSKI H, et al. Raf-induced proliferation or cell cycle arrest is determined by the level of raf activity with arrest mediated by p21Cip1[J]. Mol Cell Biol, 1997, 17(9): 5598–5611. DOI:10.1128/MCB.17.9.5598 |
| [13] | KARKHANIS M, PARK J. Sp1 regulates Raf/MEK/ERK-induced p21CIP1 transcription in TP53-mutated cancer cells[J]. Cell Signall, 2015, 27(3): 479–486. DOI:10.1016/j.cellsig.2015.01.005 |
| [14] | WANG L, JIANG X, CHEN G, et al. Anti-tumor activity of SL4 against breast cancer cells:induction of G2/M arrest through modulation of the MAPK-dependent p21 signaling pathway[J]. Sci Rep, 2016, 6: 36486. DOI:10.1038/srep36486 |
| [15] | LV C, SUN W, SUN H, et al. Asperolide A, a marine-derived tetranorditerpenoid, induces G2/M arrest in human NCI-H460 lung carcinoma cells, is mediated by p53-p21 stabilization and modulated by Ras/Raf/MEK/ERK signaling pathway[J]. Marine Drugs, 2013, 11(2): 316–331. DOI:10.3390/md11020316 |



