2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院消化内科;
3. 402160 重庆,重庆医科大学附属永川医院药学部
2. Department of Gastroenterology, Second Affiliated Hospital, Army Military Medical University(Third Military Medical University), Chongqing, 400037;
3. Department of Pharmacy, Yongchuan Hospital Affiliated to Chongqing Medical University, Chongqing, 402160, China
YANG Yingbin, E-mail:yybin@swu.edu.cn
胃癌是我国最常见恶性肿瘤之一。据统计,胃癌5年总体生存率仅有10%~15%,且超过60%的胃癌患者在5年内发生复发、转移和死亡[1]。目前,越来越多的证据表明胃癌干细胞(gastric cancer stem cells, GCSCs)极有可能是胃癌抵抗化疗、复发和转移的根源[2]。因此,针对胃癌干细胞的治疗策略可在多个层面上发挥抗肿瘤的效应,具有广阔的临床前景,故胃癌干细胞的分子机制的研究也越来越受到重视。
蛋白精氨酸N-甲基转移酶(protein arginine N-methyltransferase, PRMTs)能够催化甲基从甲硫氨酸S-腺苷转移到精氨酸胍基氮原子上。PRMTs不仅在前体mRNA剪切、DNA损伤应答、细胞信号通路、细胞命运决定等关键细胞生物学事件中起着重要的作用[3-6];既往研究表明,PRMTs同样也参与了胚胎干细胞多能性的维持,并可显著促进肿瘤的侵袭转移过程[7-9]。特别是蛋白精氨酸N-甲基转移酶4(protein arginine N-methyltransferase 4, PRMT4)在乳腺癌、结肠癌和胃癌干细胞中表达明显增强[10-12],提示PRMT4的表达可能与肿瘤干细胞有密切的联系。基于以上基础,本研究拟探讨PRMT4对胃癌干细胞的调控作用及其可能的分子机制。
1 材料与方法 1.1 主要试剂人胃腺癌细胞系MKN45购于中国科学院典型培养物保藏委员会细胞库;总RNA提取试剂盒(货号9109)、反转录反应试剂盒(RR047A)及荧光定量PCR(qRT-PCR)试剂盒(RR820A)购于TaKaRa公司;anti-CD44(3570s)、anti-PRMT4(12495s)、anti-Nanog(8822s)、anti-Oct4(2750s)、anti-GAPDH(5174s)抗体购于Cell signaling technology公司,anti-Lgr5(ab75850)抗体购于Abcam公司;染色质免疫共沉淀试剂盒(17-375)购于Millipore公司;双荧光素酶报告基因检测试剂盒(E1910)购于Promega公司;ChIP-qPCR引物购于上海生物工程有限公司;高糖DMEM培养基、DMEM/F12培养基、胎牛血清购于HyClone公司;N2、B27、EGF、bFGF细胞因子购于Invitrogen公司。
1.2 细胞培养人胃腺癌MKN45细胞培养于含10%胎牛血清的高糖DMEM培养液中,置于37 ℃、5% CO2培养箱中培养,每隔2~3天传代。成球培养中,MKN45细胞置于DMEM/F12为基础的干细胞培养基(添加N2、B27、20 ng/mL EGF、20 ng/mL bFGF)中培养,每隔3天添加1次干细胞培养基。
1.3 荧光定量PCR(quantitative real-time PCR, qRT-PCR)采用RNA提取试剂盒提取细胞总RNA,检测总RNA浓度后,取500 ng总RNA反转录为cDNA,采用SYBR Green两步法进行PCR反应:95 ℃预变性5 min;95 ℃变性5 s;58 ℃退火30 s,72 ℃延伸10 s, 扩增40个循环。以GAPDH作为内参, 每个标本均设3个复孔,基因相对表达量以-2ΔΔCt法计算,引物序列见表 1。
| 基因名称 | 引物序列(5′-3′) | 扩增片段长度(bp) | |
| CD44 | 上游 | CCAGAAGGAACAGTGGTTTGGC | 151 |
| 下游 | ACTGTCCTCTGGGCTTGGTGTT | ||
| Lgr5 | 上游 | CCTGCTTGACTTTGAGGAAGACC | 100 |
| 下游 | CCAGCCATCAAGCAGGTGTTCA | ||
| Nanog | 上游 | CTCCAACATCCTGAACCTCAGC | 115 |
| 下游 | CGTCACACCATTGCTATTCTTCG | ||
| Oct4 | 上游 | CCTGAAGCAGAAGAGGATCACC | 106 |
| 下游 | AAAGCGGCAGATGGTCGTTTGG | ||
| PRMT4 | 上游 | TTCCAGTCACCACTGTTCGCCA | 139 |
| 下游 | CCAGGAGGTTACTGGACTTGGA | ||
| GAPDH | 上游 | GTCTCCTCTGACTTCAACAGCG | 131 |
| 下游 | ACCACCCTGTTGCTGTAGCCAA |
1.4 Western blot实验
使用SDS裂解液提取细胞总蛋白,100 ℃煮沸样品5 min使蛋白变性,RC/DC法测定蛋白浓度,每孔上样量为30 μg进行SDS-PAGE电泳。常规湿法100 V恒压转膜100 min,以5%的脱脂奶粉室温封闭2 h,加一抗(抗体浓度PRMT4 1 :1 000,Oct4 1 :1 000,Nanog 1 :1 000,CD44 1 :1 000,Lgr5 1 :1 000,GAPDH 1 :10 000) 4 ℃过夜,TBST洗膜3次,每次5 min,二抗(抗体浓度山羊抗鼠1 :10 000,山羊抗兔1 :10 000)室温孵育2 h后,ECL化学发光法显影。
1.5 双荧光素酶报告基因实验委托上海生物工程有限公司将八聚体结合转录因子4(octamer-binding transcription factor4, Oct4)基因启动子(本研究中,Oct4基因启动子区域为Oct4转录起始位点上游1 700 bp,下游300 bp,共2 000 bp)构建至pGL3-Basic,构建重组萤火虫荧光素报告质粒pGL3-Oct4-Promoter,构建好的载体测序鉴定。将MKN45细胞接种于48孔板中,每孔接种3×104个细胞,培养过夜后,将重组pGL3-Oct4-Promoter质粒及pRL-TK质粒共转染MKN45细胞,同时转染PRMT4过表达质粒pcDNA3.1-PRMT4及对照质粒pcDNA3.1-NC,转染48 h后,裂解细胞并检测双荧光素酶活性。
1.6 染色质免疫沉淀(chromatin immunoprecipitation, ChIP)实验在裂解MKN45细胞后,采用酶消化剪切基因组DNA的方法将DNA剪切为100~300 bp长度的片段。将上述产物过柱纯化后,留取样品为input组。其余产物与PRMT4抗体(稀释浓度1 :50)或同型对照IgG抗体4 ℃孵育3 h。在洗涤未结合的细胞染色质后继续qPCR实验,以未加引物组为阴性对照(ChIP-qPCR引物:上游5′-CGAGGCTACATTGAGCCAT-3′, 下游5′-TCCAGGACCTCAGTGCAGGT-3′,扩增区域为转录起始位点上游172~294 bp,产物长度123 bp)。
1.7 统计学处理采用SPSS 13.0统计软件分析数据,计量数据以x±s表示,两组间比较采用t检验。检验水准:α=0.05。
2 结果 2.1 过表达PRMT4后对肿瘤细胞成球能力的影响因肿瘤干细胞具有自我更新这一独特性质,故在含有多种生长因子的干细胞培养基中,肿瘤干细胞往往呈球状生长。而肿瘤细胞的成球能力便是该群细胞“干性(干细胞特性)”的直接体现。为探讨PRMT4对胃癌细胞株MKN45“干性”的影响,我们在成功转染PRMT4过表达质粒之后,采用无血清培养肿瘤干细胞的方法培养肿瘤干细胞。我们发现,MKN45细胞形成的干细胞球呈悬浮生长;而且在相同条件下,PRMT4过表达组MKN45细胞所形成的肿瘤干细胞球数量以及大小都明显高于对照组(图 1, 表 2)。

|
| A:pcDNA3.1-NC空载质粒转染组;B:pcDNA3.1-PRMT4过表达质粒转染组 图 1 过表达PRMT4对MKN45胃癌干细胞形成能力的影响 |
| MKN45细胞 | 细胞球孔数/总孔数每孔细胞数 | 每个细胞成球的概率 | 倍数 | P值 | |||||
| 1 000 | 100 | 10 | 1 | 评价 | (95%置信区间) | ||||
| PRMT4对照组 | 30/96 | 16/96 | 2/96 | 0/96 | 1/1 865 | (1/2 502-1/1 390) | 1 | < 0.0001 | |
| PRMT4过表达组 | 90/96 | 60/96 | 10/96 | 3/96 | 1/179 | (1/231-1/138) | 10.4 | ||
2.2 过表达PRMT4后胃癌干细胞标志物CD44、Lgr5 mRNA及蛋白表达水平的变化
干细胞标志物表达的高低也是一群细胞“干性”的强弱的反映。为进一步观察PRMT4对胃癌细胞“干性”的影响,我们还检测了PRMT4对经典的胃癌干细胞标志物如CD44、Lgr5表达的影响。将MKN45细胞分别转染PRMT4过表达质粒及对照质粒之后,我们分别采用qRT-PCR和Western blot两种方法检测了CD44、Lgr5 mRNA及蛋白的表达水平。在对mRNA水平的检测中,我们发现,过表达PRMT4可明显增加CD44、Lgr5的mRNA水平(图 2B),与mRNA水平一致的是,胃癌干细胞标志物CD44及Lgr5的蛋白表达也在PRMT4过表达时明显升高(图 2A)。这些结果提示,过表达PRMT4后,MKN45细胞的干性得到了显著增强。

|
|
1:pcDNA3.1-NC空载质粒转染组;2:pcDNA3.1-PRMT4过表达质粒转染组 A: Western blot检测PRMT4过表达后PRMT4、CD44和Lgr5蛋白表达;B:qPCR检测PRMT4过表达后PRMT4、CD44和Lgr5 mRNA表达 a: P < 0.01, 与转染pcDNA3.1-NC空载质粒组比较;b: P < 0.05, 与转染pcDNA3.1-NC空载质粒组比较;c : P < 0.05, 与转染pcDNA3.1-NC空载质粒组比较 图 2 过表达PRMT4对MKN45胃癌细胞CD44和Lgr5 mRNA及蛋白表达影响 |
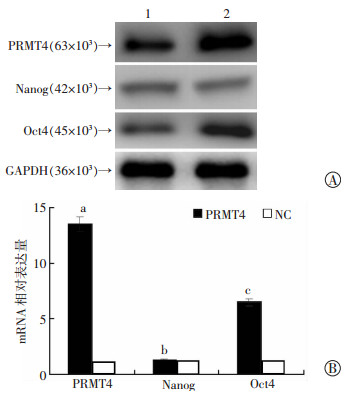
2.3 过表达PRMT4后“干性”维持分子Nanog和Oct4的变化
以核转录因子Nanog、Oct4为代表的一系列“干性”维持分子在肿瘤干细胞中表达明显上调,并通过多种途径维持“干性”。其表达水平的高低与“干性”直接相关,Nanog或Oct4的表达缺失,将直接导致“干性”丢失,干细胞分化。为探讨PRMT4促进胃癌细胞“干性”的机制,我们将MKN45细胞转染PRMT4或对照质粒,再使用qPCR及Western blot对Nanog、Oct4的表达进行检测结果显示,相比与对照组,PRMT4过表达组的Oct4分子在mRNA及蛋白水平均有明显上调,而Nanog并未出现明显变化(图 3)。以上结果提示,PRMT4能促进Oct4的表达,而并不显著影响Nanog的水平。
|
|
1:pcDNA3.1-NC空载质粒转染;2:pcDNA3.1-PRMT4过表达质粒转染 A: Western blot检测PRMT4过表达后PRMT4、Nanog和Oct4蛋白表达;B: qPCR检测PRMT4过表达后PRMT4、Nanog和Oct4 mRNA表达 a: P < 0.001, 与转染pcDNA3.1-NC空载质粒组比较;b: P>0.05, 与转染pcDNA3.1-NC空载质粒组比较;c: P < 0.01, 与转染pcDNA3.1-NC空载质粒组比较 图 3 过表达PRMT4对MKN45胃癌细胞Nanog和Oct4蛋白表达影响 |
2.4 过表达PRMT4能增强Oct4启动子活性
为深入研究PRMT4调控Oct4的机制,我们构建了含Oct4基因启动子序列的荧光素酶报告基因载体,转染MKN45细胞后,采用双荧光素酶实验检测PRMT4过表达对Oct4启动子的影响。可见,MKN45细胞在转染PRMT4后,Oct4启动子的双荧光素酶活性[(5.859±0.255)明显高于对照组(4.443±0.226), P < 0.05],提示PRMT4可通过促进Oct4的转录进而增强其表达。
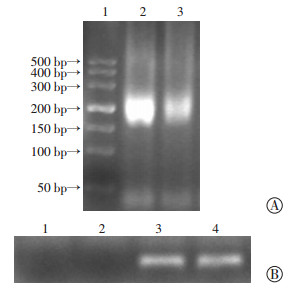
2.5 ChIP实验检测PRMT4与Oct4启动子相互作用我们采用ChIP技术,以进一步探讨PRMT4对Oct4启动子活性的调控作用。结果显示,采用酶消化剪切基因组DNA的方法能成功地将基因组DNA剪切为150~300 bp长度的片段(图 4A);阳性对照组(采用未经沉淀的基因组DNA为模板)有较为明显的扩增条带出现,而在使用非特异性IgG进行免疫沉淀及未加扩增引物的两个阴性对照组中,未观察到明显条带,提示该ChIP-PCR实验体系正确。而且,在使用PRMT4特异性抗体进行沉淀后,利用针对Oct4启动子序列设计的引物扩增,可见明显的扩增产物形成的电泳条带(图 4)。以上结果提示,PRMT4可与Oct4启动子区域特异性结合,从而发挥对后者转录活性的调控作用。PRMT4可结合至Oct4基因启动子上,通过增加启动子活性,从而促进Oct4转录及表达,进而增强胃癌细胞的干性。
|
| A:酶消化剪切基因组DNA琼脂糖电泳 1: DL500 DNA Marker;2、3:酶消化剪切基因组DNA片段;B:ChIP-PCR扩增产物电泳结果1:抗体IgG;2:抗体PRMT4(未加扩增引物);3:抗体PRMT4;4:阳性对照Input 图 4 ChIP实验检测PRMT4与Oct4启动子相互作用 |
3 讨论
CSCs首先在急性白血病粒细胞中被发现,随后在乳腺、脑、肺和胃肠等多种癌症中存在的CSCs也被相继发现[13]。GCSCs与不具有干性的胃癌细胞相比,能通过DNA损伤修复、抑制凋亡通路和产生耐药蛋白等自我保护机制,增强了肿瘤进展、转移、耐药和自我更新能力[14]。这解释了临床上胃癌治疗过程中,化疗抵抗、复发等导致胃癌治疗失败的原因[15]。先前的研究表明,在随着胃癌的进展、胃癌干细胞“干性”增强的过程中,PRMT4表达量明显上调,提示PRMT4有可能参与促进胃癌干细胞的“干性”,但其确切机制尚未得到充分研究[12]。
Oct4是POU转录因子家族中的一员,具有多个转录起始位点,转录不同的mRNA亚型,从而翻译成多种蛋白质。目前关于Oct4基因的研究主要针对isoform1,其主要表达于胚胎干细胞、生殖干细胞以或未分化胚胎癌组织中,是参与调控胚胎干细胞自我更新和维持其全能性的最为重要的转录因子之一[16],同时也是体外建立诱导多功能干细胞(induced pluripotent stem cells,IPS)的关键基因[17-18]。以上研究结果提示,Oct4基因在干细胞中起到极其重要的作用。TAI等[19]发现Oct4基因不仅在人乳腺干细胞和胃干细胞中表达,而且可在人毛囊组织中促进上皮干细胞和黑色素干细胞的自我修复和多向分化能力[20],说明Oct4也具有维持成体干细胞向多分化潜能的功能。此外,Oct4在恶性的肿瘤组织中也具有活跃的功能。近年来,人们在结直肠癌、肺癌、乳腺癌、胃癌等恶性肿瘤中也发现Oct4有异常表达,并且发现Oct4与肿瘤的发生、发展及患者的预后有密切关系[21]。CHEN等[22]报道,Oct4对于维持肺癌干细胞自我更新,肿瘤干细胞特性等方面发挥重要作用。另有研究表明,Oct4下调或缺失可能导致肿瘤干细胞转变成癌细胞[23]。以上研究提示,Oct4不仅是维持肿瘤细胞“干性”至关重要的转录因子,也是具有重要意义的靶向治疗潜在目标。故Oct4的转录调控机制研究显得尤为必要。
表观遗传修饰机制异常在肿瘤发生、发展过程中的共性:表观修饰的异常往往与失调的信号通路及促癌分子密切相关[24]。在此过程中,组蛋白的甲基化修饰起着重要的转录调控作用。负责催化蛋白精氨酸甲基化的PRMT4被招募到基因启动子区后,可会导致组蛋白H3的第17位精氨酸二甲基化修饰(H3R17m2)或者组蛋白H3的第26位精氨酸二甲基化修饰(H3R26m2),对基因起到转录激活的作用,参与“干性”相关信号通路的活性调控[25]。文献[26]报道通过在胃癌细胞系中的ChIP实验发现,Oct4的启动子区普遍存在上调的H3R17me2a和H3R26me2a修饰,而PRMT4可特异性地促进H3R17me2a和H3R26me2a修饰。我们研究发现,PRMT4可通过与“干性”维持分子Oct4启动子序列结合,促进后者的表达;这与文献[26]报道研究结果是一致的。除Oct4外,PRMT4功能的发挥也与很多核受体以及转录因子有关,包括p53、NF-κB、PPARc和c-Fos等[27]。这些结果均提示,PRMT4可通过调控多种转录因子及信号通路的活性,对“干性”进行不同层次的全面调控,具有独特的靶向价值。
在本研究中,我们发现了PRMT4可与Oct4启动子结合,但PRMT4并不是序列特异性的核转录因子,提示其与Oct4启动子的结合仍需其他分子的“引导”。既往文献[28-30]报道,序列特异性的核转录因子Sox2不仅可以与Oct4的启动子结合,进而促进Oct4的转录;也能与PRMT4结合,共同调控下游基因。而且,我们发现,上述研究所鉴定出的Sox2与Oct4的启动子结合部分与本实验所发现的PRMT4与Oct4启动子结合的位置有部分重叠,这充分提示PRMT4与Oct4启动子的结合可能是以PRMT4-Sox2-Oct4启动子复合物的形式实现的。
在本研究中,我们同时也观察到了PRMT4对胃癌“干性”标志物CD44及Lgr5在mRNA及蛋白水平表达的促进作用,提示PRMT4也可能通过CD44及Lgr5来促进胃癌细胞的“干性”。文献[31-32]报道,CD44和Lgr5是公认的Wnt信号下游基因,在Wnt信号激活时表达明显上调。而Wnt信号可通过其参与细胞存活、细胞命运决定、细胞周期调控相关的靶基因,发挥对胃癌“干性”的促进作用、调控胃癌干细胞的生物学行为。所有,我们推测,PRMT4也可能通过对Wnt-CD44/Lgr5轴而促进“干性”。我们将在后续研究中进一步探讨PRMT4上述作用中的具体机制。
本研究发现,PRMT4可与Oct4启动子结合,进而启动Oct4基因的转录、增强胃癌细胞的“干性”。本研究为阐明PRMT4在胃癌干细胞中的作用提供了实验依据,具有潜在的临床价值,值得深入研究。
| [1] | CUNNINGHAM D, STARLING N, RAO S, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer[J]. N Engl J Med, 2008, 358(1): 36–46. DOI:10.1056/NEJMoa073149 |
| [2] | TAKAISHI S, OKUMURA T, WANG T C. Gastric cancer stem cells[J]. J Clin Oncol, 2008, 26(17): 2876–2882. DOI:10.1200/JCO.2007.15.2603 |
| [3] | LARSEN S C, SYLVESTERSEN K B, MUND A, et al. Proteome-wide analysis of arginine monomethylation reveals widespread occurrence in human cells[J]. Sci Signal, 2016, 9(443): rs9. DOI:10.1126/scisignal.aaf7329 |
| [4] | SANCHEZ G, BONDY-CHORNEY E, LAFRAMBOISE J, et al. A novel role for CARM1 in promoting nonsense-mediated mRNA decay: potential implications for spinal muscular atrophy[J]. Nucleic Acids Res, 2016, 44(6): 2661–2676. DOI:10.1093/nar/gkv1334 |
| [5] | JACQUES S L, AQUINO K P, GUREASKO J, et al. CARM1 preferentially methylates H3R17 over H3R26 through a random kinetic mechanism[J]. Biochemistry, 2016, 55(11): 1635–1644. DOI:10.1021/acs.biochem.5b01071 |
| [6] | MIRANDA T B, KHUSIAL P, COOK J R, et al. Spliceosome sm proteins D1, D3, and B/B' are asymmetrically dimethylated at arginine residues in the nucleus[J]. Biochem Biophys Res Commun, 2004, 323(2): 382–387. DOI:10.1016/j.bbrc.2004.08.107 |
| [7] | KRAUSE C D, YANG Z H, KIM Y S, et al. Protein arginine methyltransferases: evolution and assessment of their pharmacological and therapeutic potential[J]. Pharmacol Ther, 2007, 113(1): 50–87. DOI:10.1016/j.pharmthera.2006.06.007 |
| [8] | WU Z, YANG M, LIU H, et al. Role of nuclear receptor coactivator 3 (Ncoa3) in pluripotency maintenance[J]. J Biol Chem, 2012, 287(45): 38295–38304. DOI:10.1074/jbc.M112.373092 |
| [9] | PFEIFFER M J, SIATKOWSKI M, PAUDEL Y, et al. Proteomic analysis of mouse oocytes reveals 28 candidate factors of the "reprogrammome"[J]. J Proteome Res, 2011, 10(5): 2140–2153. DOI:10.1021/pr100706k |
| [10] | BALDWIN R M, HAGHANDISH N, DANESHMAND M, et al. Protein arginine methyltransferase 7 promotes breast cancer cell invasion through the induction of MMP9 expression[J]. Oncotarget, 2015, 6(5): 3013–3032. DOI:10.18632/oncotarget.3072 |
| [11] | SHLENSKY D, MIRRIELEES J A, ZHAO Z, et al. Correction: differential CARM1 isoform expression in subcellular compartments and among malignant and benign breast tumors[J]. PLoS ONE, 2015, 10(6): e0131955. DOI:10.1371/journal.pone.0131955 |
| [12] | BLANC R S, RICHARD S. Arginine methylation: the coming of age[J]. Mol Cell, 2017, 65(1): 8–24. DOI:10.1016/j.molcel.2016.11.003 |
| [13] | LEE H E, KIM J H, KIM Y J, et al. An increase in cancer stem cell population after primary systemic therapy is a poor prognostic factor in breast cancer[J]. Br J Cancer, 2011, 104(11): 1730–1738. DOI:10.1038/bjc.2011.159 |
| [14] | VERMEULEN L, DE SOUSA E MELO F, RICHEL D J, et al. The developing cancer stem-cell model: clinical challenges and opportunities[J]. Lancet Oncol, 2012, 13(2): e83–e89. DOI:10.1016/S1470-2045(11)70257-1 |
| [15] | WILLIAMS K, MOTIANI K, GIRIDHAR P V, et al. CD44 integrates signaling in normal stem cell, cancer stem cell and (pre)metastatic niches[J]. Exp Biol Med (Maywood), 2013, 238(3): 324–338. DOI:10.1177/1535370213480714 |
| [16] | LIU L, ZHANG J, FANG C, et al. OCT4 mediates FSH-induced epithelial-mesenchymal transition and invasion through the ERK1/2 signaling pathway in epithelial ovarian cancer[J]. Biochem Biophys Res Commun, 2015, 461(3): 525–532. DOI:10.1016/j.bbrc.2015.04.061 |
| [17] | YU J, VODYANIK M A, SMUGA-OTTO K, et al. Induced pluripotent stem cell lines derived from human somatic cells[J]. Science, 2007, 318(5858): 1917–1920. DOI:10.1126/science.1151526 |
| [18] | TAKAHASHI K, YAMANAKA S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4): 663–676. DOI:10.1016/j.cell.2006.07.024 |
| [19] | TAI M H, CHANG C C, KIUPEL M, et al. Oct4 expression in adult human stem cells: evidence in support of the stem cell theory of carcinogenesis[J]. Carcinogenesis, 2005, 26(2): 495–502. DOI:10.1093/carcin/bgh321 |
| [20] | YU H, FANG D, KUMAR S M, et al. Isolation of a novel population of multipotent adult stem cells from human hair follicles[J]. Am J Pathol, 2006, 168(6): 1879–1888. DOI:10.2353/ajpath.2006.051170 |
| [21] | HU T, LIU S, BREITER D R, et al. Octamer 4 small interfering RNA results in cancer stem cell-like cell apoptosis[J]. Cancer Res, 2008, 68(16): 6533–6540. DOI:10.1158/0008-5472.CAN-07-6642 |
| [22] | CHEN Y C, HSU H S, CHEN Y W, et al. Oct-4 expression maintained cancer stem-like properties in lung cancer-derived CD133-positive cells[J]. PLoS ONE, 2008, 3(7): e2637. DOI:10.1371/journal.pone.0002637 |
| [23] | VILLODRE E S, KIPPER F C, PEREIRA M B, et al. Roles of OCT4 in tumorigenesis, cancer therapy resistance and prognosis[J]. Cancer Treat Rev, 2016, 51: 1–9. DOI:10.1016/j.ctrv.2016.10.003 |
| [24] | FEINBERG A P, KOLDOBSKIY M A, G ND R A. Epigenetic modulators, modifiers and mediators in cancer aetiology and progression[J]. Nat Rev Genet, 2016, 17(5): 284–299. DOI:10.1038/nrg.2016.13 |
| [25] | BEDFORD M T, RICHARD S. Arginine methylation an emerging regulator of protein function[J]. Mol Cell, 2005, 18(3): 263–272. DOI:10.1016/j.molcel.2005.04.003 |
| [26] | WU Q, BRUCE A W, JEDRUSIK A, et al. CARM1 is required in embryonic stem cells to maintain pluripotency and resist differentiation[J]. Stem Cells, 2009, 27(11): 2637–2645. DOI:10.1002/stem.131 |
| [27] | BEDFORD M T, CLARKE S G. Protein arginine methylation in mammals: who, what, and why[J]. Mol Cell, 2009, 33(1): 1–13. DOI:10.1016/j.molcel.2008.12.013 |
| [28] | TOMIOKA M, NISHIMOTO M, MIYAGI S, et al. Identification of Sox-2 regulatory region which is under the control of Oct-3/4-Sox-2 complex[J]. Nucleic Acids Res, 2002, 30(14): 3202–3213. DOI:10.1093/nar/gkf435 |
| [29] | ZHAO H Y, ZHANG Y J, DAI H, et al. CARM1 mediates modulation of Sox2[J]. PLoS ONE, 2011, 6(10): e27026. DOI:10.1371/journal.pone.0027026 |
| [30] | BOYER L A, LEE T I, COLE M F, et al. Core transcriptional regulatory circuitry in human embryonic stem cells[J]. Cell, 2005, 122(6): 947–956. DOI:10.1016/j.cell.2005.08.020 |
| [31] |
方兴贵. CD44在肿瘤干细胞的研究进展[J].
医学综述, 2012, 18(20): 3385–3387.
FANG X G. Research progress of cd44 in tumor stem cells[J]. Med Recapitulate, 2012, 18(20): 3385–3387. |
| [32] |
牛磊, 郗洪庆, 陈凛. Lgr5-Wnt/β-catenin信号通路与胃癌干细胞的研究进展[J].
解放军医学院学报, 2014, 35(12): 1268–1272.
NIU L, XI H Q, CHEN L. Lgr5-Wnt/β-catenin signal pathway and gastric cancer stem cells[J]. Acad J Chin PLA Med Sch, 2014, 35(12): 1268–1272. DOI:10.3969/j.issn.2095-5227.2014.12.026 |



