癫痫形成机制目前尚不完全明确,现有抗癫痫药物主要作用机制是通过抑制癫痫反复发作控制并减少癫痫形成,暂无真正意义的抑制癫痫形成的药物。神经元突触重塑及病理性放电环路形成是癫痫形成中最重要的病理改变,癫痫形成过程中突触发生何种重塑的研究对抗癫痫药物的疗效评估及癫痫相关研究意义重大。树突棘是兴奋性突触后结构的基础,其数量、形态、功能、突触后膜受体表达等在神经系统发育及各种疾病过程中不断变化[1],其主要调控机制是神经电活动,上述变化在神经环路的形成与重塑中起重要作用。钙离子是细胞内重要信号传导成分,在多种细胞功能调节中起重要作用。已有研究表明,癫痫发作后神经元细胞内存在钙超载现象,而这种异常的钙离子内流是神经元同步化放电的重要机制,同时细胞内持续的该超载也能在癫痫过程中介导神经元发生一系列病理生理改变,其中包括神经元突触重塑[2],因此癫痫模型中钙离子内流的动力学研究及其与神经元棘突间的动态变化关系的研究对于了解神经元癫痫形成过程中电生理-形态学改变情况及其相关性十分重要。
本实验拟采用SD大鼠建立锂-匹罗卡品慢性动物癫痫模型,同时采用SD胎鼠海马神经元进行原代培养并建立无镁癫痫模型。对癫痫大鼠海马神经元棘突密度、形态及突触相关蛋白表达进行分析,对原代培养海马神经元细胞内钙离子浓度及棘突密度情况进行分析,讨论突触形态功能在癫痫模型中如何变化及探讨其在脑内异常电兴奋性环路形成中的可能作用。
1 材料与方法 1.1 材料健康SD鼠,雄性,6~8周龄,体质量25~30 g。健康SD孕鼠,孕16~18 d, 均购自重庆医科大学实验动物中心。饲养于12 h昼夜交替,空气温度24 ℃,湿度55%环境,标准鼠粮喂养,所有实验程序符合国际和重庆医科大学动物使用标准。
主要试剂与材料:氯化锂(Sigma,美国),匹罗卡品(Sigma,美国),DMEM/F12、D-Hank’s(HyClone,美国),B27、Neuro-basal培养基、胎牛血清(Gibco,美国),Fluo-3 AM(碧云天,上海),高尔基染色试剂盒(Hitobiotec,美国),MAP2一抗(Abcam,美国),突触后致密物-95(postsynaptic density protein 95, PSD95)一抗(Millipore,美国),突触囊泡蛋白(synaptophysin SYP)一抗(Millipore,美国),RNA提取试剂(TRIzol, 碧云天,上海),qRT-PCR逆转录试剂盒(TaKaRa,日本),SYBR® Premix Ex TaqTM Ⅱ TaKaRa,日本),激光扫描共聚焦显微镜(Bio-Rad,美国)。
1.2 动物慢性癫痫模型建立健康雄性SD大鼠,每只分别称量计算用药量,127 mg/kg的氯化锂, 200 mg/kg匹罗卡品腹腔注射,30 min后若无癫痫持续状态(status epilepticus, SE)发作继续予以100 mg/kg匹罗卡品腹腔注射,所有诱发发作鼠1.5 h后给予安定10 mg/kg注射终止发作。对照组予以生理盐水腹腔注射。在SE发作后60 d内进行行为学观察,Racine评分计数4级及以上发作,出现反复自发性发作视为慢性癫痫模型建立。
1.3 原代培养海马神经元无镁癫痫模型孕16~18 d SD大鼠,取胎鼠脑分离海马,消化接种, 密度(1~5)×105个/mL, 4~6 h后换接种培养基为提前配好的Neurobasal无血清培养基。培养72 h后培养基中加入10 μmol/L的阿糖胞苷,抑制非神经细胞和胶质细胞增生。每周半量换液2次。原代海马神经元培养至第12天时,按如下配方配置无镁细胞外液:NaCl 145 mmol/L,KCl 2.5 mmol/L,CaCl2 2 mmol/L,HEPES 10 mmol/L,Glucose 10 mmol/L,Glycine 0.001 mmol/L, 对照组细胞外液在上述无镁细胞外液基础上加入1 mmol/L的MgCl2。用配置的细胞外液代替培养基处理培养第12天原代海马神经元,3 h后换正常培养基继续培养,48 h内行膜片钳检测神经元电兴奋性。膜片钳细胞外液:NaCl140 mmol/L,KCl 5 mmol/L,CaCl2 2 mmol/L,MgCl2 1 mmol/L,HEPES 10 mmol/L,Glucose 10 mmol/L,Tetraethyl-ammoniμm (TEA) Cl 10 mmol/L。膜片钳电极内液:CaCl2 1 mmol/L,KCl 30 mmol/L,MgCl2 2 mmol/L,Hepes 10 mmol/L,KAsp 110 mmol/L,ATP-Na2 5 mmol/L,EGTA 10 mmol/L,Tetraethyl-ammoniμm (TEA) Cl 10 mmol/L。全细胞膜片钳记录神经元动作电位,检测癫痫模型是否建立成功。
1.4 高尔基染色及棘突形态学分析于SE发作60 d后处死小鼠,并进行高尔基染色,操作如下:①提前1d将试剂盒中溶液1和溶液2混合,静止后去上清,避光静置保存备用。②小鼠直接断头取脑,迅速用预冷生理盐水清洗脑组织表面血液,用手术刀冠状平面切取含海马部位约1 cm厚的脑组织,置于提前配制的溶液1、2混合液中,避光静置24 h后换新的溶液1、2混合液,继续避光静置14~21 d。③把脑组织小心转移入溶液3中避光4 ℃保存,24 h后换新的溶液3,继续室温静置7 d。④把脑组织小心取出,用滤纸吸干表面溶液,外裹组织包埋剂于-80 ℃冰箱冻硬。⑤把组织包埋到丙丁切片机托上切片机设定-19 ℃,厚度100 μm。用毛笔将切片转移至载玻片上,15°斜放切片,避光晾干48 h后切片用双蒸水小心冲洗2次,每次3 min。⑥溶液4和溶液5各5 mL混匀,再加入15 mL双蒸水混匀。⑦切片于浸泡于混合液中避光15 min,双蒸水小心冲洗2次,每次3 min。⑧50%-75%-95%-100%酒精梯度脱水,二甲苯透明,中性树胶封片,晾干后于显微镜下观察并拍照,Imaris software v7.2.3软件对树突棘形态进行分析[3]。丝状伪足、瘦长型棘突、短粗型棘突、蘑菇型棘突分类标准:丝状伪足头部宽度 <平均宽度,棘突长度>2倍头部宽度,长度>2 μm;瘦长型棘突头部宽度<平均宽度,棘突长度<2倍头部宽度;短粗型棘突突起长度<1 μm;蘑菇型棘突头部宽度>2倍颈部宽度[4]。分别计数不同类型棘突密度。
1.5 培养海马神经元荧光染色原代培养至第7天时,采用神经元特异性标记物微管相关蛋白2(microtubule-associated protein-2,MAP2)免疫荧光染色鉴定神经元纯度。原代培养至第12天建立无镁癫痫模型后采用MAP2及PSD95荧光双标染色计数棘突数量,Imaris software v7.2.3软件对树突棘数量进行分析。细胞爬片用PBS冲洗3次;4%多聚甲醛室温固定爬片20 min,PBS冲洗3次;0.2% Triton X-100处理细胞爬片10 min破膜(冰上操作),PBS冲洗3次;山羊血清37 ℃孵育60 min封闭;抗Map2一抗工作液(1 :200)4 ℃冰箱孵育过夜;PBS冲洗3次;荧光二抗工作液37 ℃暗盒孵育1 h,PBS冲洗3次;DAPI染核,避光操作,固定爬片,立即荧光显像并拍照。
1.6 qRT-PCR取大鼠海马组织,采用实时荧光定量PCR(quantitative Real-time PCR,qRT-PCR)检测PSD95及SYP在基因水平表达变化情况。TRIzol提取总RNA, 采用TaKaRa逆转录试剂盒(RR047A)进行逆转录反应,选择SYBR® Premix Ex TaqTM Ⅱ进行实时荧光定量PCR反应,反应完毕后确认扩增曲线和溶解曲线,用Bio-Rad CFX软件分析结果,数据以平均2-ΔΔCt±标准偏差表示。引物序列:PSD95上游5′-GCCGTTTGAGTTCTCCTTT-3′, 下游5′-AGCATTTCCTGTCCTCCC-3′;SYP上游5′-CATTCCTCAGCCCCTATCTG-3′, 下游5′-AAGTCACACCAACCCACTCC-3′。
1.7 Western blot取大鼠海马组织,采用Western blot检测PSD95及SYP在蛋白水平表达变化情况。蛋白裂解液提取总蛋白,BCA法测定总蛋白浓度并配平使每个样品最终蛋白浓度相等,将已配平蛋白于沸水中水浴10 min使其蛋白充分变性,-20 ℃保存备用。非连续的Tris-SDS聚丙烯酰凝胶垂直平板电泳,转膜,BSA封闭液的清洁孵育盒中,于常温封闭1~2 h或4 ℃冰箱过夜,一抗工作液中,于37 ℃孵箱中孵育2 h或4 ℃冰箱孵育过夜,二抗工作液中,于37 ℃孵箱中孵育1 h后显影,行统计分析,实验重复2次。
1.8 原代培养海马神经元细胞内钙离子浓度测定原代海马神经元于共聚焦专用培养皿中培养至第12天时建立无镁癫痫模型,建模前及建模后6 h、1 d、3 d、7 d模型组及对照组神经元时采用Fluo-3 AM钙离子荧光探针分别检测细胞内钙离子浓度,Neurobasal培养基稀释Fluo-3 AM至1μmol/L,带钙离子荧光探针培养基进行全量换液,于培养箱中孵育30 min后移除培养基,PBS缓冲液冲洗培养板2~3次后加入正常培养基继续培养,并尽快观察。选择488 nm的激发波长激发Fluo-3, 通过共聚焦显微镜观察和检测细胞内钙离子浓度。
1.9 统计学处理实验结果以x±s表示。采用SPSS 18.0统计软件。计量资料首先用Kolmogorov-Smirrov test分析是否满足正态分布,正态分布数据使用参数检验,非正态分布使用非参数检验。正态分布资料:两组间用Student’s t检验进行比较分析,3组及以上比较用单因素方差分析,差异有统计学意义时,用Turkey’s test进行多重比较。非正态分布资料:Mann-Whitney U检验进行两组间比较,Kruskal-Wallis rank test进行3组及以上比较。检验水准:α=0.05。
2 结果 2.1 锂-匹罗卡品慢性癫痫动物模型建立及行为学分析20只健康雄性SD大鼠采用随机数字表法分为癫痫组12只及对照组8只,癫痫组腹腔注射锂-匹罗卡品诱导SE发作1.5 h后给予安定10 mg/kg注射终止发作,成功诱发SE发作小鼠9只。对照组予以等量生理盐水腹腔注射。在SE发作后60 d内进行行为学观察,Racine评分计数4级及以上发作,出现反复自发性发作视为慢性癫痫模型建立,癫痫组共7只大鼠出现反复自发性发作,对照组无大鼠出现自发性发作。
2.2 原代培养海马神经元无镁癫痫模型建立成功培养原代海马神经元,细胞状态良好,培养至第7天时采用MAP2荧光染色鉴定神经元纯度,达到(95±3)%以上(图 1)。原代海马神经元培养至第10天时采用无镁细胞外液建立细胞癫痫模型,对照组采用含镁细胞外液。建模后48 h内行全细胞膜片钳检测细胞动作电位结果显示无镁细胞外液处理组,神经元均出现自发性反复癫痫样放电(spontaneous recurrent epileptiform discharges,SREDs)[5],对照组培养神经元仅偶有动作电位发放(图 1),癫痫细胞模型建立成功。

|
| A:原代培养海马神经元MAP2荧光染色(绿),DAPI染核(蓝);B:无镁细胞外液孵育神经元出现SREDSs,对照组神经元细胞膜偶见动作电位发放 图 1 原代培养海马神经元无镁癫痫模型 |
2.3 高尔基染色
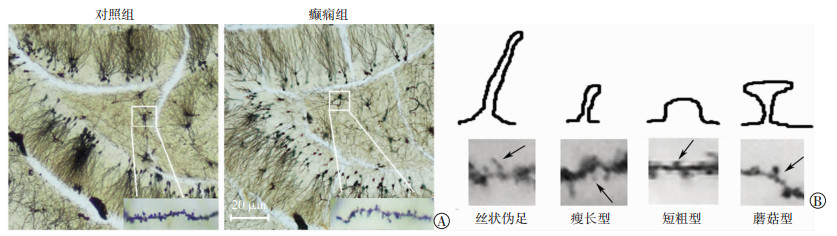
建模后出现自发性反复发作(spontaneous recurrent seizure,SRS)癫痫组小鼠共7只及对照组小鼠共8只,分别观察60 d后断头取海马区脑片行高尔基染色并在光学显微镜下观察拍照分析齿状回(dendritic gyrus,DG)区棘突密度及形态,各个样本在齿状回区域随机选取10段长15 μm的轴突进行分析,计数不同形态类型棘突密度、短粗型、蘑菇型、瘦长型、丝状伪足及总棘突密度,慢性癫痫及对照组间进行分析比较。结果显示对照组齿状回神经元棘突密度(0.62±0.03)个/μm,其中短粗型棘突(0.12±0.04)个/μm,蘑菇型棘突(0.26±0.01)个/μm,瘦长型棘突(0.09± 0.01)个/μm,丝状伪足(0.15±0.03)个/μm。慢性癫痫组齿状回神经元棘突密度(0.70±0.03)个/μm,其中短粗型棘突(0.09±0.03)个/μm,蘑菇型棘突(0.15±0.01)个/μm,瘦长型棘突(0.18±0.01)个/μm,丝状伪足(0.27±0.01)个/μm。慢性癫痫组比对照组齿状回区棘突密度增加(P < 0.05),但蘑菇棘突较对照组明显减少(P < 0.05),瘦长型棘突及丝状伪足较对照组明显增加(P < 0.01,图 2)。
|
| A:齿状回区神经元棘突密度及不同形态的棘突密度在对照组及癫痫组之间的差异;B:丝状伪足、瘦长型、短粗型、蘑菇型棘突示意图及示例图 图 2 大鼠脑组织神经元棘突高尔基染色结果及不同形态棘突示意图、示例图 |
2.4 qRT-PCR及Western blot检测
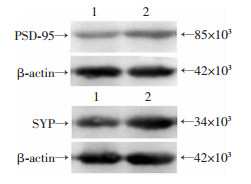
SD慢性癫痫大鼠SE发作后进行行为学观察,60 d后取癫痫组及对照组大鼠海马组织提取总RNA,qRT-PCR检测PSD95及SYP基因表达,结果提示癫痫组两者表达较对照组明显升高(P < 0.05)。提取总蛋白,Western blot检测PSD95及SYP蛋白表达,结果提示,与对照组PSD95相对表达量(0.36±0.03)及SYP相对表达量(0.61±0.02)比较,癫痫组PSD95表达(0.45±0.03)及SYP表达(0.95±0.03)明显增加(P < 0.05,图 3)。
|
| 1:对照组;2:癫痫组 图 3 Western blot检测PSD95及SYP在癫痫组及对照组表达差异 |
2.5 原代培养海马神经元细胞内钙离子浓度测定
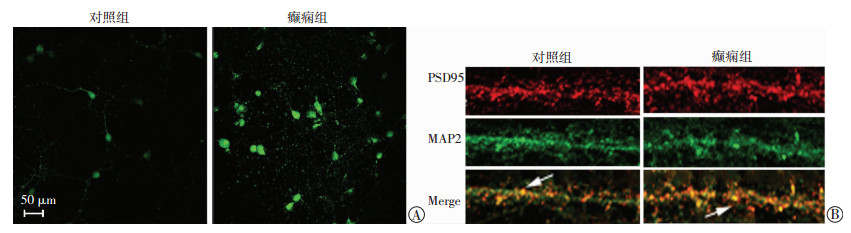
原代培养海马神经元于培养至第12天时建立无镁癫痫模型并于建模前及建模后1、3、7 d分别检测细胞内钙离子浓度(图 4),结果提示癫痫模型组神经元建模后钙离子浓度较对照组升高,且随时间推移差异越来越明显,差异有统计学意义(P < 0.01,表 1)。建模前及建模后1、3、7 d采用MAP2、PSD95荧光双标染色,计数神经元树突表达突触后致密体密度作为功能性棘突数量,结果提示癫痫组神经元棘突数量较对照组明显升高(P < 0.05)。统计癫痫组不同时间点的钙离子浓度和棘突密度,以Spearman秩相关分析进行相关性检测,两组数据呈正相关关系(r=0.613,P < 0.05)。
|
| A:建模前及建模后3 d癫痫组及对照组细胞内钙离子浓度检测; B:神经元棘突密度测定,MAP2(绿色)标记树突,PSD95(红色)标记突触后致密体,计数棘突数量(箭头代表棘突) 图 4 原代海马神经元细胞钙离子浓度检测及棘突计数 |
| 时间点 | 钙离子浓度 | 棘突密度/15μm | |||
| 癫痫组 | 对照组 | 癫痫组 | 对照组 | ||
| 建模前 | 61.08±2.45 | 60.65±1.78 | 9.08±1.56 | 8.68±2.01 | |
| 1 d | 118.35±2.33b | 82.32±3.47 | 11.03±1.98a | 9.98±1.70 | |
| 3 d | 131.23±2.98b | 95.03±3.45 | 11.91±1.13a | 10.31±0.98 | |
| 7 d | 150.74±1.89b | 108.35±2.89 | 13.41±2.13a | 11.01±1.03 | |
| a: P < 0.05, b: P < 0.01,与对照组比较 | |||||
3 讨论
癫痫作为一种常见神经系统疾病,其发病机制尚未完全明确。近年来,神经元突触可塑性与癫痫形成机制的研究备受关注。树突棘作为突触可塑性及神经神经病理性环路形成的基础结构,了解其在致痫事件及癫痫反复发作的病理状态下其形态与功能变化情况对研究癫痫形成机制十分重要。正常脑组织中不同树突棘的体积形态各异,有的从棘突发出狭窄的颈部连接泡状的树突棘头部、有的呈简单柱状、有的颈部连接多个凸起,其长度、颈部宽度、头部宽度、头部体积等都不一样。在突触发生过程中,较长(大于2 μm)的形态呈动态变化的丝状伪足首先从树突及轴突发出,伪足中富含肌动蛋白基质可以沿伪足逐步形成新生突触并逐步具备相关神经信息传递功能,在突触及突触连接逐渐成熟的过程中丝状伪足的形态及功能也逐渐发生变化,缩短、增粗,变成具有兴奋性突触前膨出的树突棘,因此蘑菇型的树突棘被认为是具有形成兴奋性突触联系及传递神经电信号的棘突[6]。短粗型的棘突可能和丝状伪足一样是成熟棘突的前体,也可能和蘑菇型棘突一样是成熟棘突,瘦长型棘突被认为是一种特殊类型的不稳定棘突但其功能尚需进一步研究[1]。总的来说,丝状伪足和瘦长型棘突通常被认为是不稳定棘突,在正常成熟神经元中所占比例较少,而蘑菇型及短粗型棘突结构和功能相对稳定[7]。树突棘形态与数量受神经电活动变化,棘突形态发育异常则会影响其功能进而对突触功能及整个神经环路产生影响,这些改变最终会以各种神经系统疾病临床症状的形式表现出来[8]。本实验通过对慢性颞叶癫痫海马DG区树突棘形态分析,探讨了癫痫形成过程中树突棘病理改变情况。研究发现慢性癫痫模型中树突棘密度较正常明显增加,但蘑菇型棘突较正常明显减少,丝状伪足及瘦长型棘突较正常明显增加。这表明神经元反复癫痫样放电及电兴奋异常活跃状态会诱导神经突起不断形成,但丝状伪足及瘦长型棘突的数量增加表明该状态下棘突的塑造处于病理性异常活跃状态,难以形成功能稳定性棘突,同时已形成稳定型树突棘及突触也可能发生功能及形态的改变,参与并促进神经异常电兴奋性环路的形成。
PSD95及SYP是突触后及突触前膜表达重要蛋白,在突触的结构、功能和可塑性方面发挥着重要作用。PSD95是突触后膜上表达的脚手架蛋白为突触后膜受体表达必要蛋白结构[9],将谷氨酸受体和信号转导有关的多种调节蛋白集中于突触后膜。对于谷氨酸受体功能的调节和突触可塑性有重要意义[10-11]。SYP为特异性突触前囊泡膜蛋白,可在一定程度上反映突触的数量、分布、密度及突触传递的效能[12-13],PSD95及SYP表达异常升高,提示突触形成及重塑异常活跃。
既往已有研究表明,神经损伤引起神经元内钙稳态失调可能与癫痫的发生于维持机制密切相关,谷氨酸受体浓度增高及细胞内钙超载也是引起神经元凋亡的重要机制[14-15]。钙离子内流可降低神经元电兴奋阈值,引起动作电位发放,且动作电位发放后突触前残留钙离子可继续参与增强突触功能的过程,诱导长时程增强(long-term potentiation,LTP)在突触重塑过程中发挥重要作用,但损伤稍轻的未凋亡神经元钙离子其胞内钙离子稳态及动力学变化情况会如何变化,钙稳态失调是致痫事件导致的急性事件,还是长期改变?本研究证实,对照组神经元随着培养时间的延长,其胞内钙离子浓度会逐渐升高,表明钙离子受神经电活动调控可能在神经元成熟过程中呈动态变化,与神经突起发育突触成熟等过程关系密切,而癫痫模型建立后神经内钙离子浓度较对照组明显增高且在损伤刺激解除后持续增加。同时癫痫模型建立后神经元树突棘密度也较对照组明显增加。钙离子作为细胞内最重要的第二信号分子,参与众多神经生理调控过程,对棘突发育及突触成熟过程起重要作用[16-17],神经元内长期钙超载可能对神经元长期可塑性造成影响,对癫痫形成过程中突触重塑产生影响,参与癫痫形成及反复发作的维持。
癫痫形成与神经元反复异常放电及脑内异常电生理环路形成密切相关,癫痫形成过程中神经突触重塑是癫痫形成研究及抑制癫痫形成药物研发的重点及难点。本研究表明,慢性癫痫形成过程中神经元新生树突棘形成活跃,突触膜受体相关蛋白表达亦明显增加,但正常功能性树突棘比例却减少,与异常电兴奋性神经环路形成可能密切相关。神经元内钙稳态在致痫事件发生后长期失调,且随时间推移变化明显,作为参与神经发育重要信号分子,钙离子可能在突触重塑及癫痫形成中起重要作用,但具体机制还需更进一步研究。
| [1] | KUWAJIMA M, SPACEK J, HARRIS KM. Beyond counts and shapes: studying pathology of dendritic spines in the context of the surrounding neuropil through serial section electron microscopy[J]. Neuroscience, 2013, 251: 75–89. DOI:10.1016/j.neuroscience.2012.04.061 |
| [2] | JEANS A F, VAN HEUSDEN F C, AL-MUBARAK B, et al. Homeostatic presynaptic plasticity is specifically regulated by P/Q-type Ca2+ channels at mammalian hippocampal synapses[J]. Cell Reports, 2017, 21(2): 341–350. DOI:10.1016/j.celrep.2017.09.061 |
| [3] | KANJHAN R, NOAKES P G, BELLINGHAM M C. Emerging roles of filopodia and dendritic spines in motoneuron plasticity during development and disease[J]. Neural Plasticity, 2016, 2016: 1–31. DOI:10.1155/2016/3423267 |
| [4] | SEBASTIAN V, ESTIL J B, CHEN D, et al. Acute physiological stress promotes clustering of synaptic markers and alters spine morphology in the hippocampus[J]. PLoS ONE, 2013, 8(10): e79077. DOI:10.1371/journal.pone.0079077 |
| [5] | XIE W, SONG YJ, LI D, et al. The suppression of epileptiform discharges in cultured hippocampal neurons is regulated via alterations in full-length tropomyosin-related kinase type B receptors signalling activity[J]. Eur J Neurosci, 2014, 40(3): 2564–2575. DOI:10.1111/ejn.12620 |
| [6] | EBRAHIMI S, OKABE S. Structural dynamics of dendritic spines: molecular composition, geometry and functional regulation[J]. Biochim Biophys Acta, 2014, 1838(10): 2391–2398. DOI:10.1016/j.bbamem.2014.06.002 |
| [7] | NISHIYAMA N, COLONNA J, SHEN E, et al. Long-term in vivo time-lapse imaging of synapse development and plasticity in the cerebellum[J]. J Neurophysiol, 2014, 111(1): 208–216. DOI:10.1152/jn.00588.2013 |
| [8] | CHEN J L, NEDIVI E. Neuronal structural remodeling: is it all about access[J]. Curr Opin Neurobiol, 2010, 20(5): 557–562. DOI:10.1016/j.conb.2010.06.002 |
| [9] |
柴继侠, 王元元, 李徽徽, 等. 突触后致密蛋白95(PSD95)和突触小泡蛋白在神经元成熟过程中的分布[J].
细胞与分子免疫学杂志, 2016, 32(12): 1619–1622.
CHAI J X, WANG Y Y, Li H H, et al. Distribution of postsynaptic density protein 95 (psd95) and synaptophysin during neuronal maturation[J]. Chin J Cell Mol Immunol, 2016, 32(12): 1619–1622. |
| [10] | NAIR D, HOSY E, PETERSEN J D, et al. Super-Resolution Imaging Reveals That AMPA Receptors Inside Synapses Are Dynamically Organized in Nanodomains Regulated by PSD95[J]. J Neurosci, 2013, 33(32): 13204–13224. DOI:10.1523/jneurosci.2381-12.2013 |
| [11] | BUSTOS F J, VARELA-NALLAR L, CAMPOS M, et al. PSD95 suppresses dendritic arbor development in mature hippocampal neurons by occluding the clustering of NR2B-NMDA receptors[J]. PLoS ONE, 2014, 9(4): e94037. DOI:10.1371/journal.pone.0094037 |
| [12] | YI ES, OH S, LEE J K, et al. Chronic stress-induced dendritic reorganization and abundance of synaptosomal PKA-dependent CP-AMPA receptor in the basolateral amygdala in a mouse model of depression[J]. Biochem Biophys Res Commun, 2017, 486(3): 671–678. DOI:10.1016/j.bbrc.2017.03.093 |
| [13] | BELL J E S, SEIFERT J L, SHIMIZU E N, et al. Atraumatic spine distraction induces metabolic distress in spinal motor neurons[J]. J Neurotrauma, 2017, 34(12): 2034–2044. DOI:10.1089/neu.2016.4779 |
| [14] | HIGLEY MJ, SABATINI BL. Calcium signaling in dendritic spines[J]. Cold Spring Harb Perspect Biol, 2012, 4(4): a005686. DOI:10.1101/cshperspect.a005686 |
| [15] |
肖淳, 王文, 石全红, 等. STIM1在幼年和成年大鼠外伤性癫痫中的表达[J].
第三军医大学学报, 2013, 35(14): 1493–1497.
XIAO C, WANG W, SHI Q H, et al. Expression of stim1 in young and adult rats with posttraumatic epilepsy[J]. J Thrid Mil Med Univ, 2013, 35(14): 1493–1497. |
| [16] | CHEN X, ROCHEFORT N L, SAKMANN B, et al. Reactivation of the same synapses during spontaneous up states and sensory stimuli[J]. Cell Rep, 2013, 4(1): 31–39. DOI:10.1016/j.celrep.2013.05.042 |
| [17] | HIGLEY M J, SABATINI B L. Calcium signaling in dendrites and spines: practical and functional considerations[J]. Neuron, 2008, 59(6): 902–913. DOI:10.1016/j.neuron.2008.08.020 |



