前列腺癌是威胁中老年男性健康的常见肿瘤。在美国成年男性人群中,前列腺癌发病率已超过肺癌,病死率仅次于肺癌,成为首位危害男性健康的肿瘤[1]。在我国其发病率虽低于西方国家,但随着生活方式及人口老龄化等因素的改变,前列腺癌患者呈显著增长的趋势。紫杉醇(paclitaxel, PTX)类化疗药物作为治疗前列腺癌的最后一种手段,可显著提高晚期前列腺癌的生存收益,减少转移所致死亡,但最终都会产生耐药,不能遏制肿瘤发展[2]。近来研究发现,超声波辐照能够造成细胞膜通透性增高, 影响细胞膜表面的酶活性从而引起肿瘤细胞内药物浓度增加,增强抗肿瘤药物对肿瘤细胞的杀伤作用,并可诱导肿瘤细胞凋亡,从而增加化疗药物的敏感性,逆转肿瘤耐药[3],但其具体机制尚不明确。本研究通过低频超声(low-frequency ultrasounds, LFUS)联合微泡剂(ultrasound contrast agent, UCA)辅助紫杉醇干预前列腺癌紫杉醇耐药细胞株PC-3R,探讨低频超声联合微泡剂逆转肿瘤耐药的内在机制,为超声辅助化疗提供理论基础。
1 材料与方法 1.1 试剂和仪器紫杉醇纯品(上海永叶生物科技有限公司),微泡剂(陆军军医大学附属第二医院高文宏教授馈赠),1640培养基、胎牛血清(Gibco),GRP78 siRNA慢病毒(上海吉玛生物科技有限公司),CCK-8试剂(东仁化学科技有限公司),Annexin V-FICT/PI双染细胞凋亡检测试剂盒、qRT-PCR所用引物由上海天昊公司合成,RNA提取试剂盒(Sigma),SYBR Green qPCR试剂盒(Thermo),逆转录试剂盒(Fermentas),DL2000 DNA标准(TINGEN),Bcl-2抗体、GRP78抗体、c-jun抗体(Abcam)。iU22低频超声治疗仪(Philips, Bothell, Washington, USA),酶标仪(Thermo MULTISKAN MK3)、流式细胞仪(BD Biosciences FACSCalibur)等。
1.2 细胞培养前列腺癌紫杉醇耐药细胞株PC-3R(紫杉醇IC50:81.2 nmol/L),购自广西南宁隆吉维特生物科技有限公司。细胞置于37 ℃、5% CO2及饱和湿度条件的恒温培养箱中,用含有10%胎牛血清的1640培养基培养。每2天更换1次培养液,取对数生长期的细胞进行实验。
1.3 CCK-8法筛选非毒性照射时间取处于对数生长期,生长状态良好的PC-3R细胞,用1640培养基调整细胞至5×105/mL,接入3.5 cm培养皿中,每皿2 mL,然后加入1 mL 1640培养基并混匀;以脱气无菌水作为耦合剂,用超声探头在培养皿底部辐射,按作用时间分为6组,包括PC-3R正常组:不做任何处理;PC-3R低频超声组,超声时间分别为10、20、30、40、50、60 s;PC-3R微泡剂组:每皿加入CO2微泡剂10 μL,然后使用超声探头在培养皿底部辐射,超声时间分别为10、20、30、40、50、60 s。超声条件:频率:1 MHz,强度1.2 W/cm2,效率调整至50%,贴合率100%时开始计时超声。同时设置正常组。处理完成后,按上述分组,用1640培养基分别调整细胞密度到5×104/mL,并接入96孔板,每孔100 μL细胞悬液,每组3个复孔,同时设空白组,37 ℃培养24 h(在细胞孔周围孔内加入100 μL无菌PBS);每孔加入10 mL cck-8,37 ℃培养4 h;酶标仪测定各孔吸光值[D(450)]。细胞毒性=1-各组D(450)值/PC-3R对照组D(450)值。
1.4 细胞分组和转染取处于对数生长期,生长状态良好的PC-3R细胞,分别接入3.5 cm培养皿中,每皿106个细胞、3 mL培养基。细胞进行如下分组:对照组,正常培养;PTX组,加入紫杉醇(终浓度为81 nmol/L)培养;LFUS组,细胞直接加低频超声处理10 s;PTX+LFUS组,加入紫杉醇(终浓度为81 nmol/L)培养并低频超声处理10 s;PTX+LFUS+UCA组,加入紫杉醇(终浓度为81 nmol/L),加入微泡剂10 μL,培养并低频超声处理10 s。按上述分组处理培养48 h。将编码GRP78-siRNA或空载体的慢病毒感染到PC-3R细胞中,根据说明书使用Lipofectamine 2000(Thermo Fisher Scientific),将其转染入细胞48 h,获得相应稳定表达的细胞株,加入微泡剂10 μL,培养并低频超声处理10 s,培养48 h。
1.5 Annexin V-FITC/PI双染法检测各组细胞凋亡率用不含EDTA的0.25%胰酶消化细胞,终止消化后收集细胞,1 500 r/min离心5 min,去上清,加PBS重悬;用PBS将细胞润洗2次,1 500 r/min离心5 min,按照AnnexinV-FITC/PI细胞凋亡检测试剂盒操作说明进行:加入500 μL Binding Buffer,重悬细胞;5 μL AnnexinV-FITC混匀后加入5 μL PI,混匀;室温避光反应5~15 min,同时设阴性对照,即正常细胞不加Annexin和PI,流式细胞仪上机检测。
1.6 q-PCR法检测各组细胞多耐药基因表达收集各组细胞,用PBS吹洗2次,离心后按照RNA提取试剂盒剂说明书提取RNA,用紫外分光光度计测定RNA的纯度和浓度。根据逆转录试剂盒说明书进行逆转录,利用SYBR Green qPCR试剂盒配置反应体系,并分别加入1 μL β-actin(上游:5′-AGCGAGCATCCCCCAAAGTT-3′,下游:5′-GGGCACGAAGGCTCATCATT-3′,片段大小285 bp)、MRP3(上游:5′-TTCCTGGTGGCTGGGCTGATGT-3′;下游R:5′-GACGCAC-GTTTGACTGAGTTGG-3′,片段大小164 bp)、MRP7 (上游:5′-AGAGTACACCTGTGACCTGC-3′;下游:5′-GA AG-AGCACCAACAACAGGG-3′,片段大小226 bp)、P-glycoprotein(上游:5′-GAGCCTACTTGGTGGCACAT-3′;下游:5′-TCCTTCCAATGTGTTCGGCA-3′,片段大小221 bp)引物和1 μL cDNA点样,每个样本的每个基因保证3个复孔,在MX3000P实时荧光定量PCR仪进行q-PCR反应,结果数据采用2-ΔΔCt法进行分析。
1.7 Western blot检测每组细胞加400 μL含PMSF的裂解液,提取总蛋白;BCA法检测蛋白浓度;各组取总蛋白40 μg进行SDS-PAGE凝胶电泳,转膜,用含5%脱脂奶粉的TBST封闭2 h。封闭液稀释β-actin(1 :2 000)、抗兔GRP78多抗(1 :1 000)、抗兔Bcl-2多抗、GAPDH(1 :2 000)和抗兔c-jun单抗(1 :1 000)一抗,4 ℃孵育过夜;用封闭液稀释HRP标记抗兔二抗(1 :5 000),37 ℃摇床孵育2 h,洗膜,ECL显色系统显色,用BandScan分析胶片灰度值。
1.8 统计学分析采用SPSS 21.0统计软件进行数据分析,计量资料数据以x±s表示,不同组间两两比较采用单因素方差分析中的LSD法(最小显著性法),P < 0.05为差异有统计学意义。
2 结果 2.1 低频超声非毒性照射时间筛选以频率1 MHz,强度1.2 W/cm2照射PC-3R细胞时,不同照射时间微泡剂组对细胞毒性均大于单纯低频超声照射组,各组进行比较均有统计学意义(P < 0.01,表 1)。且当照射时间为10 s时单纯照射组毒性为3.51%,微泡剂组为7.47%,均小于10%,对细胞生长活性影响较小,故用于后续实验。
| 组别 | 10 s | 20 s | 30 s | 40 s | 50 s | 60 s |
| LFUS组 | 3.51±1.52 | 9.29±1.12 | 17.21±1.45 | 30.16±0.56 | 39.07±0.63 | 48.36±0.30 |
| LFUS+UCA组 | 7.47±0.90a | 14.76±1.90a | 26.65±2.18a | 37.56±0.88a | 44.28±0.93a | 51.83±1.60a |
| a: P < 0.01,与LFUS组比较 | ||||||
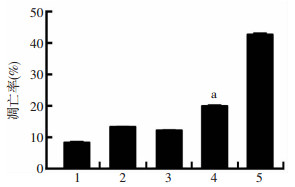
2.2 超声联合微泡剂辅助紫杉醇化疗可增加PC-3R细胞的凋亡率
单独药物处理组和单独超声照射组细胞凋亡较少,PTX+LFUS组前列腺癌细胞凋亡率增高,应用微泡剂后,凋亡率进一步明显增高,凋亡率可达(42.61± 0.51)%,与其他各处理组比较差异有显著性(P < 0.01, 图 1)。
|
|
1:对照组;2:PTX组;3:LFUS组;4:PTX+LFUS组;5:PTX+LFUS+UCA组 a:P < 0.01,与PTX组及PTX+LFUS+UCA组比较 图 1 低频超声联合微泡剂对PC-3R细胞凋亡的影响 |
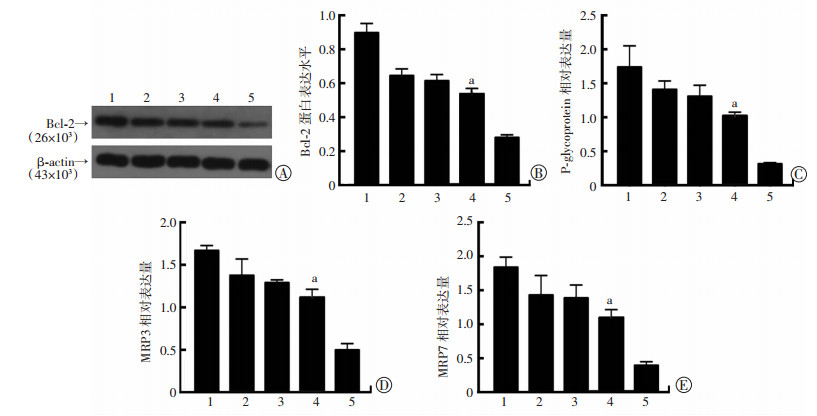
2.3 超声联合微泡剂辅助紫杉醇化疗显著下调PC-3R细胞Bcl-2和多耐药基因的表达
单独药物处理组和单独超声照射组细胞Bcl-2和MRPs变化较小,PTX+LFUS组各基因显著下调(P < 0.01),应用微泡剂后,各基因进一步下调,与其他各处理组比较差异有显著性(P < 0.01,图 2)。
|
|
1:对照组;2:PTX组;3:LFUS组;4:PTX+LFUS组;5:PTX+LFUS+UCA组 a:P < 0.01,与PTX组及PTX+LFUS+UCA组比较 A、B:Western blot检测各组Bcl-2蛋白的表达;C、D、E:q-PCR法检测各组P-glycoprotein、MRP3、MRP7基因的表达变化 图 2 低频超声联合微泡剂对PC-3R细胞Bcl-2蛋白及P-glycoprotein、MRP3和MRP7基因表达的影响 |
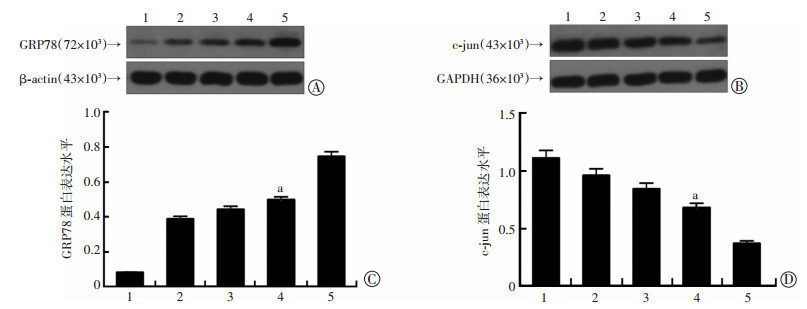
2.4 超声联合微泡剂可以引起PC-3R细胞GRP78表达上调和c-jun蛋白表达的下调
紫杉醇和低频超声联合应用时,GRP78表达升高,c-jun表达下降,应用微泡剂后,两种蛋白表达变化更加明显,与其他各处理组比较差异性有显著(P < 0.01,图 3)。
|
|
1:对照组;2:PTX组;3:LFUS组;4:PTX+LFUS组;5:PTX+LFUS+UCA组 a:P < 0.01,与PTX组及PTX+LFUS+UCA组比较 A、C:各组GRP78的表达;B、D:各组c-jun的表达 图 3 Western blot检测低频超声联合微泡剂对PC-3R细胞GRP78和c-jun蛋白表达的影响 |
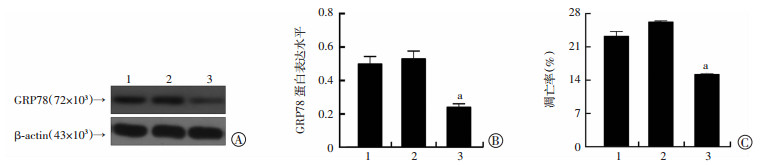
2.4 GRP78 siRNA慢病毒感染后低频超声联合微泡剂的促凋亡作用下降
GRP78 siRNA慢病毒转然后,GRP78表达显著下降(P < 0.01),抑制GRP78的表达可明显抑制低频超声联合微泡剂的促凋亡作用[(26.21±0.27)vs(15.19± 0.15),P < 0.01,图 4]。
|
|
1:正常对照组;2:空白病毒阴性对照组;3:GRP78 siRNA干扰组 a:P < 0.01,与空白病毒阴性对照组比较 A、B:Western blot检测siRNA慢病毒转染后对低频超声联合微泡剂处理的细胞GRP78的表达;C:流式细胞术检测siRNA慢病毒转染后对低频超声联合微泡剂处理的细胞的凋亡的影响 图 4 siRNA慢病毒转染后对PC-3R细胞GRP78蛋白表达和凋亡的影响 |
3 讨论
低频超声由于对恶性肿瘤细胞敏感,而对周围正常组织无损害[4],在肿瘤治疗中有很大潜力,因此近年来受到广泛关注。超声生物效应按作用机制分为热效应、机械效应、空化效应、声流效应和触变效应等,其中“空化效应”是低频超声发挥作用的主要机制,指在超声波的正压期间分子结构形成空虚, 发射强超声波于液体中产生溶解气体或液体蒸气的气泡成长而爆裂、消灭的现象[5]。众多研究证实空化作用能使肿瘤细胞膜ATPase活性降低,通透性提高,细胞内药物浓度增加;或直接推动药物进入细胞,引起细胞线粒体和某些酶的破坏,间接或直接诱导细胞凋亡[6]。已有研究报道,低频超声联合微泡剂可以增加化疗药物诱导凋亡的作用,增加细胞对其的敏感性[7-8],本实验结果在PC-3R细胞中也证明了这一点。其机制可能是微泡剂增加了空化核的数量,空化初始阶段所需能量减少,低频超声所产生的空化效应增强[9],但除空化作用使细胞膜结构改变致其通透性改变外,是否有其他因素参与,目前尚未有明确的报道。
内质网是细胞内一种重要的细胞器,参与细胞内蛋白质合成后折叠与聚集、细胞应激等多种细胞进程,对维持细胞正常生理功能有重要作用。营养物质缺乏、翻译修饰障碍或细胞毒性物质等因素都会诱发内质网发生应激(endoplasmic reticulum stress,ERS),内质网应激过强过久可通过其下游多种通路诱导细胞凋亡[10]。葡萄糖调节蛋白78(GRP78)是存在于内质网中的分子伴侣,可被内质网应激反应所诱导,是公认的内质网应激标志物[11]。本实验结果显示,紫杉醇和低频超声联合应用处理前列腺癌细胞,GRP78蛋白表达升高,提示内质网应激增强;而微泡剂的使用进一步增强GRP78蛋白表达。当应用siRNA抑制GRP78的表达时,低频超声联合微泡剂的促凋亡作用也受到抑制。c-jun是核转录激活蛋白1(activation protein, AP-1)家族成员,与多种肿瘤的增殖、凋亡及耐药性有着密切的联系,其表达受到c-jun的N-末端激酶(JNK)的调控[12],是内质网应激一条重要的下游通路,GRP78可抑制JNK/c-jun通路活性[13],本研究Western blot检测结果证明c-jun的表达随内质网应激的水平上升而下降,在紫杉醇与低频超声联合微泡剂联合应用时达到最低水平。P-糖蛋白(P-glycoprotein, P-gp)和多药耐药相关蛋白家族(MRPs)是ABC(adenosinetriphosphate-binding cassette)家族的重要成员,它们作为药物排出泵, 导致细胞内的化疗药物浓度降低, 使肿瘤细胞对多种抗肿瘤药物产生耐药[14]。有研究报道ABC家族蛋白受c-jun蛋白调节,抑制该JNK/c-jun通路活性可以下调肿瘤细胞中P-gp和MRPs的表达[15]。本研究结果显示P-gp和MRPs的表达趋势与c-jun的表达相同,低频超声与微泡剂的使用可以明显降低多耐药相关蛋白的表达。因此,可以推测,低频超声联合紫杉醇应用于前列腺癌耐药细胞株,增强内质网应激,抑制JNK/c-jun通路,下调P-gp和MRPs的表达,从而降低前列腺癌耐药细胞株对紫杉醇的排出作用,提高药物在细胞内的浓度,进而使细胞凋亡率增加,逆转其耐药性,微泡剂的使用加强了这一作用。另一方面,本实验还观察到,低频超声联合紫杉醇可以下调抗凋亡蛋白Bcl-2,而微泡剂的加入可使Bcl-2进一步显著下调,可能是内质网应激通过激活Caspase-12通路下调抑制凋亡蛋白Bcl-2的表达,从而诱导细胞凋亡[16]。
综上所述,低频超声联合微泡剂辅助紫杉醇化疗不仅可以通过空化作用提高细胞膜通透性继而提高细胞内化疗药物浓度诱导细胞凋亡,还可以增强肿瘤细胞内质网应激,激活其下游通路下调多耐药蛋白及凋亡抑制蛋白,进而提高化疗药物诱导细胞凋亡的作用,逆转肿瘤细胞的耐药性。
| [1] | SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9–29. DOI:10.3322/caac.21208 |
| [2] | LEE S, KIM K, HO JN, et al. Analysis of resistance-associated gene expression in docetaxel-resistant prostate cancer cells[J]. Oncol Lett, 2017, 14(3): 3011–3018. DOI:10.3892/ol.2017.6541 |
| [3] | SHEN Z Y, XIA G L, WU M F, et al. The effects of low-frequency ultrasound and microbubbles on rabbit hepatic tumors[J]. ExpBiol Med (Maywood), 2014, 239(6): 747–757. DOI:10.1177/1535370214525320 |
| [4] | WAN G Y, LIU Y, CHEN B W, et al. Recent advances of sonodynamic therapy in cancer treatment[J]. Cancer Biol Med, 2016, 13(3): 325–338. DOI:10.20892/j.issn.2095-3941.2016.0068 |
| [5] | MCHALE A P, CALLAN J F, NOMIKOU N, et al. Sono-dynamic therapy: concept, mechanism and application to cancer treatment[J]. Adv Exp Med Biol, 2016, 880: 429–450. DOI:10.1007/978-3-319-22536-4_22 |
| [6] | PITT W G, HUSSEINI G A, ROEDER B L, et al. Preliminary results of combining low frequency low intensity ultrasound and liposomal drug delivery to treat tumors in rats[J]. J Nanosci Nanotechnol, 2011, 11(3): 1866–1870. DOI:10.1166/jnn.2011.3117 |
| [7] | HOU R, XU Y, LU Q, et al. Effect of low-frequency low-intensity ultrasound with microbubbles on prostate cancer hypoxia[J]. Tumour Biol, 2017, 39(10): 1–9. DOI:10.1177/1010428317719275 |
| [8] |
朱燕, 刘政, 杨鹰, 等. 低频超声联合微泡增强宫颈癌Hela细胞对顺铂敏感性的实验研究[J].
第三军医大学学报, 2016, 38(15): 1741–1745.
ZHU Y, LIU Z, YANG Y, et al. Low-frequency ultrasound combined with microbubble agent enhances cytotoxicity of cisplatin to Hela cells[J]. J Third Mil Med Univ, 2016, 38(15): 1741–1745. DOI:10.16016/j.1000-5404.201511184 |
| [9] | SNIPSTAD S, BERG S, MORCH Y, et al. Ultrasound Improves the Delivery and Therapeutic Effect of Nanoparticle-Stabilized Microbubbles in Breast Cancer Xenografts[J]. Ultrasound Med Biol, 2017, 43(11): 2651–2669. DOI:10.1016/j.ultrasmedbio.2017.06.029 |
| [10] | HU J L, HU X L, GUO A Y, et al. Endoplasmic reticulum stress promotes autophagy and apoptosis and reverses chemoresistance in human ovarian cancer cells[J]. Oncotarget, 2017, 8(30): 49380–49394. DOI:10.18632/oncotarget.17673 |
| [11] | OGAWA H, KAIRA K, TAKAHASHI K, et al. Prognostic role of BiP/GRP78 expression as ER stress in patients with gastric adenocarcinoma[J]. Cancer Biomark, 2017, 20(3): 273–281. DOI:10.3233/CBM-170062 |
| [12] | CAI J, DU S, WANG H, et al. Tenascin-C induces migration and invasion through JNK/c-Jun signalling in pancreatic cancer[J]. Oncotarget, 2017, 8(43): 74406. |
| [13] | XIONG Z, JIANG R, LI X, et al. Different roles of GRP78 on cell proliferation and apoptosis in cartilage development[J]. Int J MolSci, 2015, 16(9): 21153–21176. DOI:10.3390/ijms160921153 |
| [14] | POZNIAK B, PAWLAK A, OBMINSKA-MRUKOWICA B. Flow cytometric assessment of P-glycoprotein and multidrug resistance-associated protein activity and expression in canine lymphoma[J]. In Vivo, 2015, 29(1): 149–153. |
| [15] | SUI H, CAI G X, PAN S F, et al. miR200c attenuates P-gp-mediated MDR and metastasis by targeting JNK2/c-Jun signaling pathway in colorectal cancer[J]. Mol Cancer Ther, 2014, 13(12): 3137–3151. DOI:10.1158/1535-7163.MCT-14-0167 |
| [16] |
朱江, 陈青, 田思, 等. 光敏剂MPPa介导光动力诱导人乳腺癌细胞MCF-7的内质网应激途径凋亡[J].
第三军医大学学报, 2015, 37(21): 2115–2120.
ZHU J, CHEN Q, TIAN S, et al. Pyropheophorbide-a methyl ester-mediated photodynamic therapy induces apoptosis in human breast cancer MCF-7 cells through endoplasmic reticulum stress pathway[J]. J Third Mil Med Univ, 2015, 37(21): 2115–2120. DOI:10.16016/j.1000-5404.201503144 |



