急性冠脉综合征(acute coronary syndrome, ACS)是由急性冠状动脉血流减少导致心肌缺血或坏死的临床症候群, 依据冠脉影像学检查主要血管狭窄程度是否>50%分为阻塞性急性冠脉综合征(obstructive ACS, ObACS)与非阻塞性急性冠脉综合征(non-obstructive ACS, NobACS)[1]。研究发现, 侵入性冠状动脉造影或冠脉CT血管造影检查ACS患者中5%~25%为非阻塞性[2-3]。BUGIARDINI等[4]回顾既往文献显示NobACS患者在1年以上随访中, 有超过40%患者多次住院及30%以上反复进行侵入性冠脉造影检查。NobACS患者的预后大体上较ObACS患者预后良好[5], 但由于潜在危险因素不同, NobACS患者预后仍有较大差异[6]。因此, 在临床上急需找到有效的危险因素或者生物标志物将NobACS患者进行危险分层以便后续治疗及管理。
NobACS患者确切的病理机制不清, 内皮功能紊乱被认为是该疾病的发病机制之一[2, 7-8]。血管内皮是维持心血管系统稳态的基本条件, 内皮功能损伤被认为是动脉粥样硬化的早期事件[9]。外周动脉反应性充血(reactive hyperemia-peripheral arterial tonometry, RH-PAT)作为血管内皮功能无创测量方法之一, 已被观察到可以较好的预测非阻塞性冠状动脉性疾病女性患者是否存在心肌缺血[10]。经RH-PAT检测的反应性充血指数(reactive hyperemia index, RHI)<1.67被判定为内皮功能障碍(abnormal endothelial function, AEF)[11], RUBINSHTEIN等[12]认为RHI可作为心血管危险分层以及预后判断的重要指标之一。然而, 目前尚未见RHI对NobACS患者预后预测价值的文献报道。由于RH-PAT作为内皮功能测量的方法之一, 而RHI水平与心血管疾病预后相关, 所以我们假设RHI能够预测NobACS患者不良心血管事件, 以对该类患者进行更好的临床风险分层。
1 资料与方法 1.1 研究对象本研究为前瞻性观察性队列研究, 已通过陆军军医大学第二附属医院伦理委员会伦理审查及批准(伦审研第201611号), 纳入前进行详细的知情告知并签字。连续纳入陆军军医大学第二附属医院心血管内科2015年10月至2017年7月NobACS住院患者526例。ACS诊断标准:采用2014年AHA/ACC指南对于ACS的诊断标准[1]。入选标准:①符合ACS诊断标准; ②侵入性冠状动脉造影或冠状动脉CT造影提示主要冠脉狭窄程度≤50%。排除标准:①既往有PCI史或CABG史; ②肢体残缺影响RH-PAT检查; ③免疫结缔组织疾病。入选需同时符合2条入选标准, 排除标准符合上述任一条即排除。最终有290例患者纳入研究, 所有患者在出院前完善RH-PAT检查, 以RHI=1.67分为内皮功能障碍组(AEF组, RHI<1.67)及内皮功能正常组(normal endothelial function group, NEF组, RHI≥1.67), 分别有166例和124例。通过(14.0±4.5)个月随访, AEF和NEF组分别失访10例和7例, 最终有156例和117例纳入最后统计分析。
1.2 基线资料基线资料包括:性别、年龄、吸烟史、高血压史、糖尿病史、体质指数(BMI)、空腹血糖、血清肌酐、总胆固醇、甘油三酯、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、脑利钠肽, 以上实验室资料均为入院后24 h内的首次结果。录入患者的诊断及临床分型。录入患者长期服药情况包括:阿司匹林、氯吡格雷、替格瑞洛、他汀、β受体阻滞剂、血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor)/血管紧张素Ⅱ受体阻滞剂(angiotensin Ⅱ receptor blocker)(ACEI/ARB)、钙离子拮抗剂、硝酸酯类治疗药物。
1.3 随访方法及终点事件定义所有患者采用电话、门诊或查看再次住院病历3种方式进行, 随访截止时间为2017年10月8日。随访AEs事件为复合终点事件:①全因死亡; ②非致命性心肌梗死; ③缺血性卒中; ④因心血管事件再次住院, 包括:因心力衰竭、心绞痛、心律失常再次住院。随访过程中, 如有2个及其以上终点事件发生, 记录首次出现的终点事件。
1.4 RHI检测方法RH-PAT检查设备采用EndoPAT2000(以色列, 伊塔马医疗)。EndoPAT2000是目前唯一获得美国FDA认证的无创血管内皮功能诊断系统。EndoPAT通过无创检测反应性充血过程中外周动脉张力的变化来评估内皮功能, 该方法易操作, 结果不受操作者影响, 可多次进行检查, 便于实际临床工作中开展。检查前要求:①患者病情稳定; ②检查当日清晨需禁食; ③检查前12 h内禁饮咖啡、吸烟和饮酒; ④检查前12 h停用短效硝酸酯类药物; ⑤安静休息10 min以上可安排检查。检查步骤:患者平卧, 将传感器分别嵌套在双手的食指末端, 先采集5 min的张力基线数据, 而后将袖带充气加压至200 mmHg或收缩压的60 mmHg以上来阻断一侧肱动脉血流5 min, 最后将袖带放气, 传感器再记录数据5 min。同时测量对侧手臂相应数据, 以校正非内皮因素的影响。EndoPAT通过对比闭塞前后的信号幅度的变化, 得出反应性充血指数(RHI), 通过RHI反映内皮功能。
1.5 统计学分析连续变量资料采用Shapiro-Wilk法来检验是否符合正态分布, 正态分布数据用x±s表示, 采用t检验; 非正态分布数据用M(P25~P75)表示, 采用Mann-Whitney U检验。计数资料采用χ2检验或Fisher确切概率法评价差异性。两组间生存分析差异性比较采用LogRank检验。分别进行RHI的单因素Cox风险比例回归和多因素Cox回归分析以确定RHI<1.67是否对AEs事件有预测价值。将P < 0.05的基线资料纳入多因素Cox比例风险回归模型中, 采用向前逐步回归法, 记录最终Cox模型校正的HR值。以上数据均采用SPSS(IBM公司, 版本号22.0)处理。用c-index指标评价Cox模型预测AEs事件能力[13]。抗血小板治疗方案的组间两两比较及不良事件的亚组分析采用Bonferroni法校正检验水准, 检验水准取双侧P=0.05。
2 结果 2.1 两组间基线资料比较两组一般基线资料见表 1。273例患者中, AEF组有156例, NEF组有117例纳入最后基线资料统计。AEF组的平均年龄67.0(60~74)岁, NEF组平均年龄64.0(54~70)岁, AEF组年龄偏大, 与NEF组比较有统计学差异(P=0.006), 两组间抗血小板治疗方案构成比有统计学差异(P=0.005), AEF组双联抗血小板比例较高(P=0.001), 其余基线资料无统计学差异。
| 组别 | n | 年龄(岁) | 男性(例) | BMI(kg/m2) | 吸烟史 | 高血压 | 糖尿病 | 空腹血糖(mmol/L) | 血清肌酐(μmol/L) | 总胆固醇(mmol/L) | 甘油三酯(mmol/L) | HDL-C(mmol/L) | LDL-C(mmol/L) | BNP(pg/mL) | 诊断分型 | 抗血小板药物a | β受体阻滞剂 | ACEI/ARB | 钙离子拮抗剂 | 他汀类 | 硝酸酯类 | |||
| 不稳定性心绞痛 | 急性心肌梗死 | 无 | 一种 | 双联 | ||||||||||||||||||||
| AEF组 | 156 | 67(60~74) | 93(59.62) | 24.3±3.2 | 59(37.82) | 93(59.62) | 25(16.03) | 4.93(4.47~5.40) | 73.45(63.85~84.95) | 3.99±0.94 | 1.30(0.93~1.90) | 1.04(0.89~1.25) | 2.59±0.72 | 20.95(7.70~59.05) | 151(96.79) | 5(3.21) | 12(7.69) | 95(60.90) | 49(31.41)b | 81(51.92) | 105(67.31) | 34(21.79) | 114(92.31) | 34(21.79) |
| NEF组 | 117 | 64(54~70) | 63(53.85) | 24.9±3.2 | 40(34.19) | 82(70.09) | 26(22.22) | 5.01(4.49~5.65) | 72.20(61.40~81.20) | 4.03±0.97 | 1.33(0.98~1.82) | 1.03(0.91~1.22) | 2.64±0.74 | 19.40(7.00~54.10) | 114(97.44) | 3(2.56) | 9(7.69) | 91(77.77) | 17(14.53) | 57(48.72) | 82(70.09) | 36(30.77) | 111(94.87) | 25(21.37) |
| 统计量 | -2.76 | 0.91 | -1.49 | 0.38 | 3.19 | 1.70 | -0.36 | -1.29 | -0.40 | -0.53 | -0.38 | -0.47 | -0.69 | 0.10 | 10.68 | 0.28 | 0.24 | 2.82 | 0.71 | 0.01 | ||||
| P | 0.006 | 0.340 | 0.138 | 0.537 | 0.074 | 0.194 | 0.719 | 0.196 | 0.689 | 0.598 | 0.703 | 0.639 | 0.491 | 0.756 | 0.005 | 0.600 | 0.625 | 0.093 | 0.398 | 0.932 | ||||
| a:抗血小板药物种类数, 一种抗血小板药物为阿司匹林或氯吡格雷, 双联为阿司匹林+氯吡格雷或阿司匹林+替格瑞洛; b:P=0.001, 与NEF组比较 | ||||||||||||||||||||||||
2.2 内皮功能对预后的影响
两组间AEs事件见表 2、图 1。两组间因心血管事件再次住院有统计学差异(P=0.010);全因死亡、缺血性卒中及非致命性心肌梗死无统计学差异(P>0.05);总体AEs事件有统计学差异(P=0.002), AEF组AEs事件发生率高。
| 组别 | n | AEs | 再次住院 | 全因死亡 | 缺血性卒中 | 非致命性心肌梗死 |
| AEF组 | 156 | 43(29.49) | 30(19.23) | 3(1.92) | 7(4.48) | 3(1.92) |
| NEF组 | 117 | 16(17.09) | 11(9.40) | 3(2.56) | 1(0.85) | 1(0.85) |
| LogRank值 | 9.36 | 6.62 | 0.02 | 3.77 | 0.72 | |
| P | 0.002 | 0.010 | 0.895 | 0.052 | 0.397 |
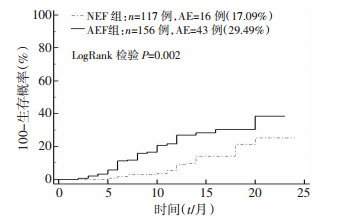
|
| 图 1 AEF组与NEF组AEs事件的Kaplan Meier生存分析 |
2.3 Cox比例风险回归模型和c-index评价预测价值
为进一步消除混杂因素对AEs事件的影响, 分别进行单因素、多因素Cox比例风险回归, 结果见表 3。单因素Cox比例风险回归模型提示RHI<1.67是AEs事件的预测因子(HR=2.36, 95%CI 1.33~4.19, P=0.003), 多因素Cox比例风险回归提示RHI<1.67(HR=2.20, 95%CI 1.24~3.92, P=0.007)、年龄(HR=1.04, 95%CI 1.01~1.07, P=0.005)分别是AEs事件的独立预测因子。RHI<1.67通过Cox比例风险回归模型预测AEs事件能力c-index=0.63, 95% CI 0.56~0.69, P=0.003。
| 变量 | B | SE | Wald | HR | 95%CI | P |
| RHI<1.67a | 0.86 | 0.29 | 8.58 | 2.36 | 1.33~4.19 | 0.003 |
| RHI<1.67b | 0.79 | 0.29 | 7.23 | 2.20 | 1.24~3.92 | 0.007 |
| 抗血小板治疗b | — | — | — | — | — | 0.983 |
| 年龄b | 0.04 | 0.01 | 7.97 | 1.04 | 1.01~1.07 | 0.005 |
| a:单因素Cox比例风险回归模型; b:多因素Cox回归模型 | ||||||
3 讨论
本研究显示NobACS患者的全因死亡、非致命性心肌梗死、缺血性卒中及再次住院率分别为2.1%、1.4%、2.9%及21.6%, 与既往研究结果相近[3-5]。通过本研究, 揭示NobACS中远期预后不良。
NobACS患者的病理生理机制支持其可用RHI来预测预后。内皮功能障碍被认为是冠脉不稳定斑块的重要特征[11, 14], 因此, 内皮功能障碍可能推动冠状动脉粥样硬化性疾病患者ACS事件的发生。血管内皮细胞由血管腔内单侧上皮细胞组成, 它在抗凝、物质转运、血管修复、维持血管张力、调节血流以及分泌血管活性物质方面起重要作用[15]。血管内皮细胞通过分泌多种血管活性物质来影响血管舒缩功能, 其中最重要的分子是NO[16]。内皮损伤导致NO活性降低与心脏不良事件相关[17]。内皮功能被认为是心血管危险因素的综合体现, 可作为心血管危险分层的敏感指标[18]。目前对内皮功能的测量可分为有创、无创两种方式[9, 18]。经典的有创方式是通过冠脉内注射乙酰胆碱法测量[18], 它也是目前内皮功能测量“金标准”, 但其有创、不能反复重复测量, 严重限制了这种方法在临床中的广泛开展。无创内皮功能测量方面包括血流介导的血管扩张(flow-mediated dilation, FMD)及RH-PAT两种。FMD存在操作者依赖、重复性差、标准不统一等缺点, 而RH-PAT克服了上述缺点[9], 所以也是本研究采用RH-PAT的主要原因。EndoPAT通过RHI来反映血管内皮的NO活性, AEF组(RHI<1.67)NO活性降低, 其预后相对较差。
既往的多项临床研究结果支持RHI与心血管疾病的预后相关。SHECHTER等[8]在可疑冠心病1年的随访后发现, RHI较低者预后较差。KOMURA等[19]在对冠心病经皮冠状动脉支架植入(percutaneous coronary intervention, PCI)术后支架内再狭窄随访后发现, RHI可预测支架内再狭窄。AKIYAMA等[13]在对射血分数保留的心衰患者随访后同样发现, RHI可预测该类患者的预后, 并且与BNP有联合预测价值。MATSUZAWA等[10, 20]进一步发现, 内皮功能可用于诊断心肌缺血。由此, 可以推断, RHI通过反映心肌缺血的严重程度来预测心血管疾病的预后。RHI不仅对心血管疾病有预测价值, 同样也对脑血管疾病有预测价值。TUTTOLOMONDO等[21]观察性研究中发现急性缺血性脑卒中患者的RHI显著降低。ROQUER等[22]认为FMD与脑血管疾病预后相关。本研究中, 虽未观察2组脑卒中有统计学差异(P=0.052), 但AEF组较NEF组发病率有升高趋势, 提示RHI可能预测NobACS患者的卒中风险。本研究发现RHI<1.67作为NobACS预后的独立预测因子, 其结果是在上述研究基础上, 拓展了无创血管内皮功能在心血管疾病的应用领域。
本研究不足之处:首先, 患者的样本量较小, 且为单中心研究, 其结果仍需在大样本、多中心研究中得以证实; 其次, 本研究仅记录住院一次的RHI值, 即发现对NobACS患者的危险分层的价值, 但我们尚未明确RHI的动态改变是否同样会对预后造成影响; 再次, 本研究中, 采用连续纳入方法以避免选择性偏移, 两组间大部分资料均无统计学差异(年龄除外), 虽已通过多因素Cox回归矫正年龄的影响, 但我们仍然不能排除年龄对结果可能的干扰; 最后, 所有患者仅要求停用短效硝酸酯类药物, 未停用其他影响血管舒缩药物, RHI的测量值可能会受影响, 但在临床实际中要求每位患者均停药不符合指南要求。尽管在本研究中我们未观察到两组患者的CCB、ACEI/ARB类血管舒缩药物有任何统计学差异, 但我们仍然不能排除药物对RHI测量的影响。综上所述, 反应性充血指数(RHI)可用于NobACS患者的中远期预后的判断, RHI<1.67是NobACS预后的独立预测因子。
| [1] | AMSTERDAM E A, WENGER N K, BRINDIS R G, et al. 2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes:a report of the american college of cardiology/american heart association task force on practice guidelines[J]. J Am Coll Cardiol, 2014, 64(24): e139–e228. DOI:10.1016/j.jacc.2014.09.017 |
| [2] | NICCOLI G, SCALONE G, CREA F. Acute myocardial infarction with no obstructive coronary atherosclerosis:mechanisms and management[J]. Eur Heart J, 2015, 36(8): 475–481. DOI:10.1093/eurheartj/ehu469 |
| [3] | PASUPATHY S, AIR T, DREYER R, et al. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries[J]. Circulation, 2015, 132(19): 861–870. DOI:10.1161/CIRCULATIONAHA.114.011201 |
| [4] | BUGIARDINI R, BAIREY MERZ C N. Angina with "normal" coronary arteries:a changing philosophy[J]. JAMA, 2005, 293(4): 477–484. DOI:10.1001/jama.293.4.477 |
| [5] | PIZZI C, XHYHERI B, COSTA G M, et al. Nonobstructive versus obstructive coronary artery disease in acute coronary syndrome:A Meta-Analysis[J]. J Am Heart Assoc, 2016, 5(12): e004185. DOI:10.1161/JAHA.116.004185 |
| [6] | JOHNSTON N, JÖNELID B, CHRISTERSSON C, et al. Effect of gender on patients with ST-elevation and non-ST-elevation myocardial infarction without obstructive coronary artery disease[J]. Am J Cardiol, 2015, 115(12): 1661–1666. DOI:10.1016/j.amjcard.2015.03.006 |
| [7] | CREA F, CAMICI P G, BAIREY MERZ C N. Coronary microvascular dysfunction:an update[J]. Eur Heart J, 2014, 35(17): 1101–1111. DOI:10.1093/eurheartj/eht513 |
| [8] | SHECHTER M, MATEZKY S, PRASAD M, et al. Endothelial function predicts 1-year adverse clinical outcome in patients hospitalized in the emergency department chest pain unit[J]. Int J Cardiol, 2017, 240: 14–19. DOI:10.1016/j.ijcard.2017.04.101 |
| [9] | VEERASAMY M, BAGNALL A, NEELY D, et al. Endothelial dysfunction and coronary artery disease:a state of the art review[J]. Cardiol Rev, 2015, 23(3): 119–129. DOI:10.1097/CRD.0000000000000047 |
| [10] | MATSUZAWA Y, SUGIYAMA S, SUGAMURA K, et al. Digital assessment of endothelial function and ischemic heart disease in women[J]. J Am Coll Cardiol, 2010, 55(16): 1688–1696. DOI:10.1016/j.jacc.2009.10.073 |
| [11] | SCHOENENBERGER A W, URBANEK N, BERGNER M, et al. Associations of reactive hyperemia index and intravascular ultrasound-assessed coronary plaque morphology in patients with coronary artery disease[J]. Am J Cardiol, 2012, 109(12): 1711–1716. DOI:10.1016/j.amjcard.2012.02.011 |
| [12] | RUBINSHTEIN R, KUVIN JT, SOFFLER M, et al. Assessment of endothelial function by non-invasive peripheral arterial tonometry predicts late cardiovascular adverse events[J]. Eur Heart J, 2010, 31(9): 1142–1148. DOI:10.1093/eurheartj/ehq010 |
| [13] | AKIYAMA E, SUGIYAMA S, MATSUZAWA Y, et al. Incremental prognostic significance of peripheral endothelial dysfunction in patients with heart failure with normal left ventricular ejection fraction[J]. J Am Coll Cardiol, 2012, 60(18): 1778–1786. DOI:10.1016/j.jacc.2012.07.036 |
| [14] | LAVI S, BAE J H, RIHAL C S, et al. Segmental coronary endothelial dysfunction in patients with minimal atherosclerosis is associated with necrotic core plaques[J]. Heart, 2009, 95(18): 1525–1530. DOI:10.1136/hrt.2009.166017 |
| [15] | HIGASHI Y. Assessment of endothelial function.History, methodological aspects, and clinical perspectives[J]. Int Heart J, 2015, 56(2): 125–134. DOI:10.1536/ihj.14-385 |
| [16] | FLAMMER A J, ANDERSON T, CELERMAJER D S, et al. The assessment of endothelial function:from research into clinical practice[J]. Circulation, 2012, 126(6): 753–767. DOI:10.1161/CIRCULATIONAHA.112.093245 |
| [17] | DAVIGNON J, GANZ P. Role of endothelial dysfunction in atherosclerosis[J]. Circulation, 2004, 109(23 Suppl 1): 27–32. DOI:10.1161/01.CIR.0000131515.03336.f8 |
| [18] | LERMAN A, ZEIHER A M. Endothelial function:cardiac events[J]. Circulation, 2005, 111(3): 363–368. DOI:10.1161/01.CIR.0000153339.27064.14 |
| [19] | KOMURA N, TSUJITA K, YAMANAGA K, et al. Impaired peripheral endothelial function assessed by digital reactive hyperemia peripheral arterial tonometry and risk of in-stent restenosis[J]. J Am Heart Assoc, 2016, 5(6): e003202. DOI:10.1161/JAHA.116.003202 |
| [20] | SARA J D S, PRASAD M, ZHANG M, et al. High-sensitivity C-reactive protein is an independent marker of abnormal coronary vasoreactivity in patients with non-obstructive coronary artery disease[J]. Am Heart J, 2017, 190: 1–11. DOI:10.1016/j.ahj.2017.02.035 |
| [21] | TUTTOLOMONDO A, CASUCCIO A, DELLA C V, et al. Endothelial function and arterial stiffness indexes in subjects with acute ischemic stroke:relationship with TOAST subtype[J]. Atherosclerosis, 2017, 256: 94–99. DOI:10.1016/j.atherosclerosis.2016.10.044 |
| [22] | ROQUER J, SEGURA T, SERENA J, et al. Endothelial dysfunction, vascular disease and stroke:the ARTICO study[J]. Cerebrovasc Dis, 2009, 27(Suppl 1): 25–37. DOI:10.1159/000200439 |



