2. 710032 西安, 空军军医大学(第四军医大学)口腔医院牙周病黏膜病科
2. Department of Mucosal Diseases, Stomatological Hospital, Air Force Medical University (Fourth Military Medical University), Xi'an, Shaanxi Province, 710032, China
神经嵴来源的外胚间充质干细胞(ectomesenchymal stem cells, EMSCs)可以与牙源性上皮相互作用形成牙乳头和牙囊, 进一步分化发育为牙本质、牙骨质、牙髓等组织结构, 被认为是牙齿发育的始祖细胞[1]。体外研究表明, 颅神经嵴来源的外胚间充质干细胞具有较强的自我复制能力和多向分化潜能, 可以向成脂肪细胞、成肌细胞、成软骨细胞、成骨细胞分化[2-3], 并且在成牙方面也显示出较高的应用潜能[4], 说明EMSCs在组织工程化牙齿中作为种子细胞具有良好的应用前景。
p75NTR(p75 neurotrophin receptor)是一种低亲和力神经营养因子受体, 属于肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily, TNFRSF)成员。在胚胎发育早期, 广泛参与多种组织的发生发育, 并与神经营养因子及神经营养因子前体蛋白结合, 广泛调控细胞生长、增殖、分化[5]、凋亡[6-7]、神经和突触重构[8]等功能。近年来研究发现:在诱导不同融合状态脂肪干细胞向施旺细胞分化时, 细胞在不同融合状态, p75NTR表达量不同, 其诱导结果有明显差异[9]。研究表明:细胞在不同融合状态时p75NTR表达存在明显差异, 可能会影响其调控细胞的多重生物学效应。
前期课题组已证实p75NTR在SD大鼠钟状期牙胚的釉牙本质界处的细胞中强表达[10], 提示p75NTR可能参与牙胚的矿化, 调控牙齿发育的启动, 但其具体的调控牙齿发育的机制尚不明确。本研究选用SD大鼠E12.5d EMSCs 4种融合状态进行体外矿化诱导实验, 检测矿化诱导前后p75NTR、Runx2、ALP、Col1在mRNA水平和蛋白水平的表达, 为进一步探明EMSCs细胞间的相互作用对其p75NTR表达及矿化能力的影响, 同时为干细胞体外矿化诱导实验选择最适宜细胞融合状态提供实验依据。
1 材料与方法 1.1 实验动物和主要试剂孕12.5 d SD大鼠由陆军军医大学第三附属医院(野战外科研究所)实验动物中心提供(实验动物生产许可证号:SCXK-PLA-20120031;使用许可证号:SCXK-PLA-20120011), 实验设计、实验过程及动物处死方法, 均经过陆军军医大学实验动物福利伦理审查委员会审核, 符合动物伦理和动物福利管理及使用要求(2016-12-10)。胎牛血清和胰蛋白酶购自美国Gibco公司; DMEM/F12培养基和PBS购自美国HyClone公司; 地塞米松、β-甘油磷酸钠、抗坏血酸和茜素红购自中国索莱宝公司; CD29、CD90购自美国Santa Cruz公司; CD45-FITC、CD146、p75NTR-FITC购自美国Bioworld公司; 二抗(Alexa Fluor 647标记)购自美国CST公司; RIPA裂解液及PMSF购自碧云天公司。Western blot用一抗:p75NTR兔源性多克隆抗体、Runx2兔源性多克隆抗体、Col1小鼠源性单克隆抗体和GAPDH抗体购自美国Abcam公司; 二抗购自美国Bioworld公司; 其余Western blot相关试剂购自康为公司; TrizolReagent购自美国Invitrogen公司; 荧光定量PCR试剂盒购自日本TaKaRa公司; SybrgreenⅠ及引物由重庆Western Biotechnology公司根据相关设计合成。
1.2 通过酶消化法获取EMSCs将孕12.5 d SD大鼠脱颈处死, 无菌条件下取出含胚胎的子宫, 在超净工作台内用磷酸盐缓冲液(PBS)冲洗含胎鼠的子宫3次, 然后取出胎鼠并切取其颌突组织, 切成大小约0.1 mm×0.1 mm×0.1 mm的组织块。加入适量含1%EDTA的0.25%胰蛋白酶(没过组织即可)置于37 ℃、5%CO2孵育箱中孵育6 min(每2 min摇1次), 消化后加入等体积含10%FBS的DMEM/F12终止消化, 加入适量PBS充分吹打, 800 r/min室温离心5 min, 弃去上清, 再加入3 mL含10%FBS的DMEM/F12培养液制成细胞悬液, 100目不锈钢筛网过滤, 再按消化法培养EMSCs[11], 每隔3天换液, 当EMSCs生长到约90%融合时细胞传代培养备用。
1.3 细胞来源鉴定取E12.5d EMSCs生长良好的第3代细胞进行流式细胞术检测, 细胞消化、离心后加入4%多聚甲醛, 置于4 ℃冰箱内固定半小时, 800 r/min离心5 min, 弃去上清后加入适量含3%FBS的PBS, 制成浓度为5×105/mL的细胞悬液, 细胞悬液分成6支, 其中1支用于阴性对照, 每支1 mL分别加入一抗CD29、CD45-FITC、CD90、CD146、p75NTR-FITC各2 μL, 充分混匀后4 ℃冰箱避光过夜, PBS漂洗后加入二抗, 室温孵育2 h, PBS漂洗后流式细胞仪检测细胞表面抗原, 鉴定细胞来源、性质。
1.4 RT-PCR检测4种融合状态EMSCs矿化诱导前后p75NTR、Runx2、ALP mRNA表达水平取E12.5d EMSCs第3代细胞以细胞密度1.0×104/cm2(半融合状态)、1.5×104/cm2(融合前状态)、2.5×104/cm2(融合状态)、3.5×104/cm2(融合后状态)接种于100 mm细胞培养皿, 静置培养24 h贴壁后即获得4种融合状态细胞。对4种融合状态细胞进行矿化诱导(每1 000 mL矿化诱导液含β-甘油磷酸钠:10 mmol, 地塞米松:1×10-8mol, 维生素C:50 mg, 青霉素:10×104单位, 链霉素:100 mg, 胎牛血清:50 mL, DMEM/F12:950 mL), 分别于诱导0、3、7 d提取细胞总RNA。按PCR试剂盒说明书提纯并逆转录mRNA为cDNA, qRT-PCR仪定量检测矿化诱导前后p75NTR、Runx2、ALP mRNA表达水平, GAPDH基因作为内参并计算2-ΔΔCq值, 各基因表达量以未诱导半融合组为1计算其余各组相对值, 所用引物序列见表 1[11]。每组实验重复3次。
| 基因 | 引物序列 |
| p75NTR | 上游5′-GAGGGCACATACTCAGACGA-3′ 下游5′-CTCTTCGCATTCAGCATCAG-3′ |
| Runx2 | 上游5′-CTGCCACCTCTGACTTCTGC-3′ 下游5′-GATGAAATGCCTGGGAACTG-3′ |
| ALP | 上游5′-GGCTCTGCCGTTGTTTCTCT-3′ 下游5′-AAGGTGCTTTGGGAATCTGC-3′ |
| GAPDH | 上游5′-ACAGCAACAGGGTGGTGGAC-3′ 下游5′-TTTGAGGGTGCAGCGAACTT-3′ |
1.5 Western blot检测4种融合状态EMSCs矿化诱导前后p75NTR、Runx2、Col1蛋白表达水平
取第3代细胞按上述方法铺板获取4种融合状态细胞并进行矿化诱导培养, 分别在诱导0、3、7 d提取细胞总蛋白, BCA法定量蛋白浓度, 蛋白质印记法检测矿化诱导前后p75NTR、Runx2、Col1蛋白表达情况, 以GAPDH为内参, 定量分析蛋白相对灰度值。每组实验重复3次。
1.6 茜素红染色检测钙盐沉积取第3代细胞按上述方法铺板获取4种融合状态细胞并进行矿化诱导培养, 每3天更换矿化诱导液1次, 矿化诱导培养21 d后, 对4种融合状态细胞进行茜素红染色, 观察钙盐沉积情况, 具体操作按试剂说明进行。每组实验重复3次。
1.7 统计学方法使用SPSS 13.0软件进行统计学分析, 对实验所得4组样本的蛋白质印迹条带和RT-PCR检测数据进行方差分析和独立样本t检验, 检验水准α=0.05。
2 结果 2.1 EMSCs的表面抗原检测结果通过流式细胞术检测E12.5d EMSCs细胞表面抗原, CD29、CD90、CD146、p75NTR表达阳性率分别为95.14%、97.61%、96.10%、26.39%, CD45表达0.01%。CD29、CD90、CD146高阳性表达, CD45表达阴性, 表明该细胞为间充质来源干细胞(图 1)。
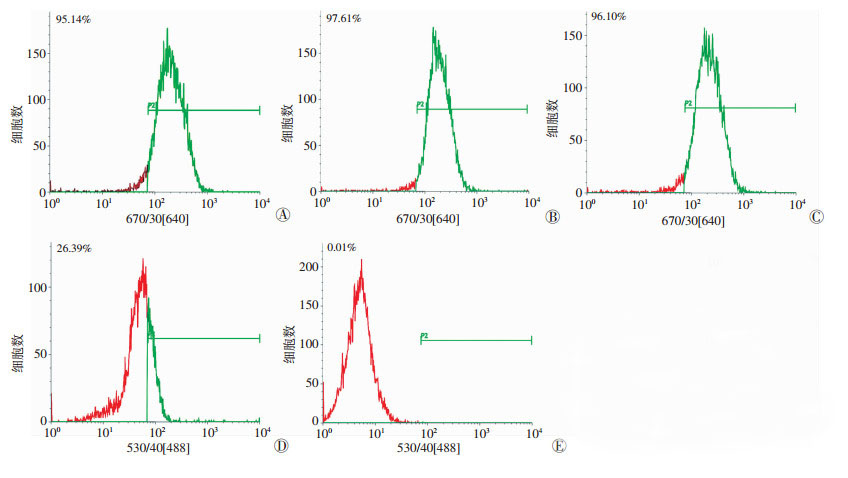
|
| A:CD29表达;B:CD90表达;C:CD146表达;D:p75NTR表达;E:CD45表达 图 1 流式细胞术检测E12.5d EMSCs细胞表面抗原 |
2.2 4种融合状态细胞生长情况
以细胞密度1.0×104/cm2、1.5×104/cm2、2.5×104/cm2、3.5×104/cm2接种于100 mm细胞培养皿, 贴壁后即对应获得半融合状态、融合前状态、融合状态和融合后状态4种融合状态细胞(图 2)。其中半融合状态、融合前状态、融合状态组细胞形态较均一, 呈梭形; 在融合后状态组, 由于细胞密度较大, 细胞拥挤而不能完全铺展开, 呈不规则圆形。
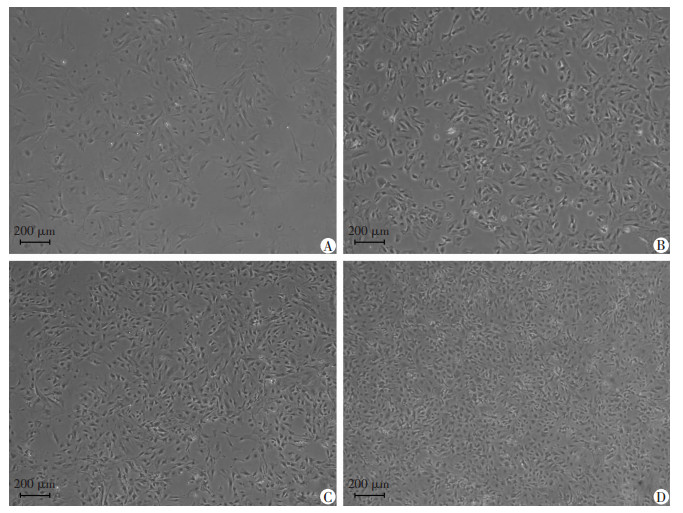
|
| A:半融合状态组; B:融合前状态组; C:融合状态组; D:融合后状态组 图 2 倒置相差显微镜观察4种融合状态细胞生长情况 |
2.3 4种融合状态细胞矿化诱导前后p75NTR、Runx2、ALP的mRNA表达水平
4种融合状态EMSCs在矿化诱导0 d时, p75NTR表达量与初始铺板细胞密度相关, 并且在融合状态组p75NTR表达最高; 当初始铺板细胞密度继续增加, 到融合后状态时, p75NTR表达反而降低。4种融合状态细胞Runx2、ALP在矿化诱导0 d时表达无差异。在矿化诱导3、7 d时, 融合状态组的p75NTR、Runx2、ALP表达较其他3组更高, 差异有统计学意义(P < 0.05, 图 3)。
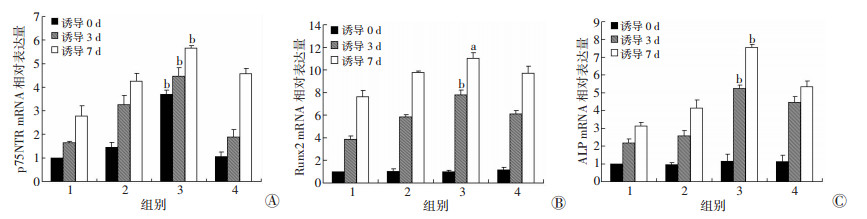
|
| 1:半融合状态组; 2:融合前状态组; 3:融合状态组; 4:融合后状态组; a:P < 0.05, b:P < 0.01, 与其他3组比较 图 3 4种融合状态细胞矿化诱导0、3、7 d时p75NTR(A)、Runx2(B)、ALP(C)mRNA表达 |
2.4 不同融合状态时p75NTR、Runx2、Col1蛋白表达水平及钙盐沉积情况
p75NTR、Runx2、Col在矿化诱导0、3、7 d时的蛋白表达见图 4A~C; 其蛋白条带灰度值分析结果见图 4D~F(以GAPDH为内参计算相对灰度值)。蛋白质印迹法结果及相对灰度值分析显示:在矿化诱导0 d时, p75NTR蛋白表达在融合状态组最高, 较其他3种融合状态差异有统计学意义(P < 0.05);Runx2、Col1蛋白表达无明显差异。在矿化诱导3、7 d时, p75NTR、Runx2、Col1蛋白表达水平均是在融合状态组最高, 差异有统计学意义(P < 0.05)。在矿化诱导21 d后, 茜素红染色检测钙盐沉积, 融合状态组钙盐沉积量明显高于其他3组(P < 0.01)(图 5)。
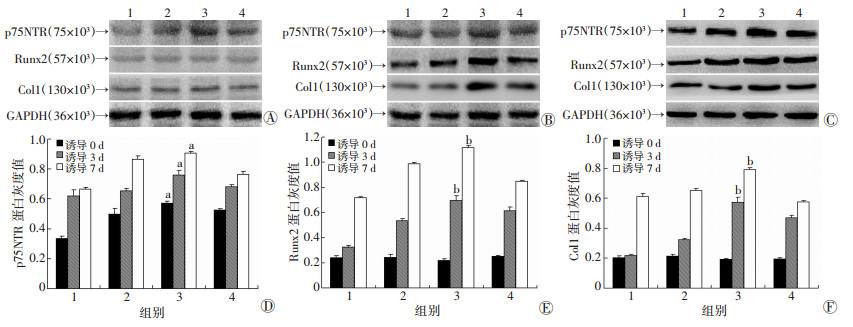
|
| A~C:分别为诱导0、3、7 d时p75NTR、Runx2、Col1蛋白表达; D~F:分别为矿化诱导0、3、7 d时p75NTR、Runx2、Col1蛋白灰度值比较; 1:半融合状态组, 2:融合前状态组, 3:融合状态组, 4:融合后状态组; a:P < 0.05, b:P < 0.01, 与其他3组比较 图 4 Western blot检测4种融合状态细胞矿化诱导0、3、7 d蛋白表达及蛋白灰度值比较 |
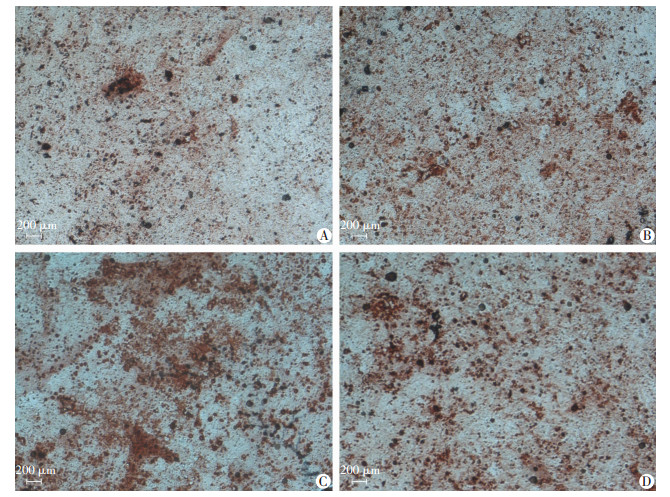
|
| A:半融合状态组; B:融合前状态组; C:融合状态组; D:融合后状态组 图 5 4种融合状态细胞矿化诱导21 d茜素红染色观察 |
3 讨论
神经嵴是脊椎动物胚胎发育过程中的一个暂时性结构[12], 起源于神经板两侧神经褶, 是机体内最具多向分化潜能的结构之一, 其衍生物具有3个胚层衍生物结构的性质。颅神经嵴向腹外侧迁移到达面突的中胚层后, 被称为外胚间充质。颅颌面部的大部分组织结构可以由神经嵴来源的外胚间充质组织发育而来, 包括肌肉、骨、软骨等[13-14]。LIN等[15]研究发现:转录因子Pitx1和Pitx2是牙齿发育信号启动的关键调节分子, Pitx表达于口腔上皮细胞和颅神经嵴来源的外胚间充质细胞中, 表明是上皮-间充质的相互作用启动了牙齿形成。刘畅等[16]通过对SD大鼠免疫组化研究发现:p75NTR在蕾状期(E13.5d)开始表达于成釉器旁边的间质; 帽状期及钟状期则广泛表达于牙乳头、牙囊、内釉上皮、釉结、星网状层。XING等[4]体外研究发现在SD大鼠E11.5d时, 流式分选EMSCs中p75NTR+细胞, 其阳性率为24.5%。本研究发现在E12.5d时p75NTR的阳性率为26.39%, 与YANG等[10]研究发现一致, 此时牙胚发育处于板状期, 矿化尚未启动。然而鞠迎新等[17]研究发现在SD大鼠E15.5d时EMSCs中p75NTR+细胞率为81.43%, 在E18.5d时其细胞阳性率为84.04%, 表明p75NTR自蕾状期以后高表达于牙齿发育的整个过程。实验选用E12.5d时期矿化尚未启动的EMSCs, 此时p75NTR+细胞比例较低, 对比4种融合状态细胞在矿化诱导0 d时, 融合状态组EMSCs p75NTR在基因表达水平和蛋白表达水平最高。推测可能是细胞间的相互作用能够促进p75NTR的表达。
p75NTR作为神经营养因子受体之一, 早期研究主要集中于神经系统的发生发育过程, 但在其他组织的作用如在牙齿的发生发育过程中的作用则鲜有报道。MIKAMI等[5]研究发现:p75NTR对MC3T3E-1细胞的体外矿化有促进作用。AKIYAMA等[18]研究发现:过表达p75NTR可以促进MG63细胞矿化能力。王莹莹等[19]在动物研究中发现:p75NTR基因敲除小鼠p75NTR-/-股骨矿化程度较p75NTR+/+矿化程度明显降低, 说明p75NTR基因敲除后可能会抑制小鼠股骨矿化。而相反的报道称:在诱导小鼠间充质干细胞系C3H10T1/2成骨分化的过程中, 过表达p75NTR会抑制其成骨分化能力[20]。课题组LI等[21]研究发现:p75NTR可以参与经典Wnt/β-catenin信号通路, 在过表达p75NTR后, 细胞核内β-catenin表达升高, 沉默p75NTR, 细胞核内β-catenin表达降低, 而Wnt信号抑制剂IWR-1-endo可以减弱p75NTR对细胞核内β-catenin的升高效应。p75NTR通过经典Wnt/β-catenin通路直接参与调控下游矿化启动基因Runx2, 并促进EMSCs成骨分化。本实验发现:当EMSCs处于融合状态时, 对比其他3种融合状态, 其p75NTR的表达最高; 进一步检测融合状态下的EMSCs, 在矿化诱导早期, 其矿化基因Runx2、ALP、Col1表达最高; 在矿化诱导后期进行钙盐沉积检测, 其结果亦为融合状态组矿化能力最强。表明p75NTR可能参与并促进EMSCs矿化, 与前期课题组研究结论一致。
细胞在体外不同的融合状态表现出各异的细胞生物学特征。细胞处于半融合状态时, 细胞间接触较少, 细胞间相互作用弱; 细胞处于融合后状态时, 细胞间会产生接触抑制, 其可能的原因包括氧气和营养成分的供给不足、细胞代谢废物的累积与排出障碍、细胞间可溶细胞因子对细胞的作用等[22]。而在细胞处于融合状态时, 细胞间的相互作用可以促进细胞的分化能力。PARUL等[23]在诱导视网膜色素上皮干细胞向上皮细胞分化时, 融合状态组细胞向视网膜上皮细胞分化, 而半融合状态组细胞未分化。DENKER等[24]对间充质细胞研究发现:诱导C3H10T1/2细胞向软骨细胞分化过程中, 细胞在融合状态时成软骨分化能力最强。TRUZZI等[25]诱导4种融合状态上皮干细胞向角化细胞分化过程中, 在半融合状态组, p75NTR的表达较低, 上皮干细胞最终分化为角化不全细胞(牛皮癣细胞); 而在融合状态组, p75NTR的表达较高, 上皮干细胞最终分化角化细胞。本研究通过对比4种融合状态EMSCs体外矿化诱导3 d时p75NTR以及矿化相关基因Runx2、ALP、Col1的表达情况, 发现均是在融合状态组p75NTR表达最高, 且矿化相关基因同样表达最高, 提示EMSCs矿化能力最强。在矿化诱导7 d时, p75NTR以及矿化相关基因Runx2、ALP、Col1仍然是在融合状态组表达最高。在矿化诱导21 d时, 融合状态组钙盐沉积量最多, 与矿化诱导早期时的基因和蛋白检测结果趋势一致, 提示融合状态组细胞矿化能力最强。表明EMSCs在融合状态的初始细胞密度条件下, 细胞间的相互作用可以促进p75NTR表达, 同时还可以促进EMSCs矿化。
综上所述, 本研究通过探讨SD大鼠E12.5d EMSCs在4种融合状态时p75NTR的表达差异及对EMSCs体外矿化的影响, 发现在融合状态时细胞间的相互作用可以促进p75NTR表达; 矿化诱导3、7 d后, 矿化相关基因和蛋白检测结果显示融合状态组细胞较其他3组细胞矿化能力更强; 矿化诱导21 d后, 钙盐沉积检测显示在融合状态组矿化能力较其他3组更强。EMSCs的矿化能力与初始细胞密度相关。因此我们推测:在不同融合状态下, p75NTR的表达差异以及EMSCs矿化能力的差异, 可能与细胞间相互作用的差异有关。但细胞间的相互作用是如何促进EMSCs的矿化能力还需要进一步研究。
| [1] | MANTESSO A, SHARPE P. Dental stem cells for tooth regeneration and repair[J]. Expert Opin Biol Ther, 2009, 9(9): 1143–1154. DOI:10.1517/14712590903103795 |
| [2] | CHEN Q, ZHOU H, HU P. Stemness distinctions between the ectomesenchymal stem cells from neonatal and adult mice[J]. Acta Histochem, 2017, 119(8): 822–830. DOI:10.1016/j.acthis.2017.10.008 |
| [3] | NIE X, XING Y, DENG M, et al. Ecto-mesenchymal stem cells from facial process:potential for muscle regeneration[J]. Cell Biochem Biophys, 2014, 70(1): 615–622. DOI:10.1007/s12013-014-9964-x |
| [4] | XING Y, NIE X, CHEN G, et al. Comparison of P75 NTR-positive and -negative etcomesenchymal stem cell odontogenic differentiation through epithelial-mesenchymal interaction[J]. Cell Prolif, 2016, 49(2): 185–194. DOI:10.1111/cpr.12248 |
| [5] | MIKAMI Y, SUZUKI S, ISHⅡ Y, et al. The p75 neurotrophin receptor regulates MC3T3-E1 osteoblastic differentiation[J]. Differentiation, 2012, 84(5): 392–399. DOI:10.1016/j.diff.2012.07.001 |
| [6] | EDALAT H, HAJEBRAHIMI Z, MOVAHEDIN M, et al. p75NTR suppression in rat bone marrow stromal stem cells significantly reduced their rate of apoptosis during neural differentiation[J]. Neurosci Lett, 2011, 498(1): 15–19. DOI:10.1016/j.neulet.2011.04.050 |
| [7] | BARRETT G L. The p75 neurotrophin receptor and neuronal apoptosis[J]. Prog Neurobiol, 2000, 61(2): 205–229. DOI:10.1016/S0301-0082(99)00056-8 |
| [8] | NEUSER F, POLACK M, ANNAHEIM C, et al. Region-specific integration of embryonic stem cell-derived neuronal precursors into a pre-existing neuronal circuit[J]. PLoS ONE, 2013, 8(6): e66497. DOI:10.1371/journal.pone.0066497 |
| [9] | NAJAFABADI M M, BAYATI V, ORAZIZADEH M, et al. Impact of cell density on differentiation efficiency of rat adipose-derived stem cells into schwann-like cells[J]. Int J Stem Cells, 2016, 9(2): 213–220. DOI:10.15283/ijsc16031 |
| [10] | YANG K, WANG Y, JU Y, et al. p75 neurotrophin receptor regulates differential mineralization of rat ectomesenchymal stem cells[J]. Cell Prolif, 2017, 50(1): e12290. DOI:10.1111/cpr.12290 |
| [11] | WEN X, LIU L, DENG M, et al. Characterization of p75+ ectomesenchymal stem cells from rat embryonic facial process tissue[J]. Biochem Biophys Res Commun, 2012, 427(1): 5–10. DOI:10.1016/j.bbrc.2012.08.109 |
| [12] | CHAMBERS S M, MICA Y, LEE G, et al. Dual-SMAD inhibition/WNT activation-based methods to induce neural crest and derivatives from human pluripotent stem cells[J]. Methods Mol Biol, 2016, 1307: 329–343. DOI:10.1007/7651_2013_59 |
| [13] | THEVENEAU E, MAYOR R. Collective cell migration of the cephalic neural crest:the art of integrating information[J]. Genesis, 2011, 49(4): 164–176. DOI:10.1002/dvg.20700 |
| [14] | ISHⅡ M, ARIAS A C, LIU L, et al. A stable cranial neural crest cell line from mouse[J]. Stem Cells Dev, 2012, 21(17): 3069–3080. DOI:10.1089/scd.2012.0155 |
| [15] | LIN C R, KIOUSSI C, O'CONNELL S, et al. Pitx2 regulates lung asymmetry, cardiac positioning and pituitary and tooth morphogenesis[J]. Nature, 1999, 401(6750): 279–282. DOI:10.1038/45803 |
| [16] |
刘畅, 杨琨, 李刚, 等. 大鼠胚胎下颌磨牙发育初期p75NTR及RUNX2时空表达[J].
基因组学与应用生物学, 2017(7): 2640–2647.
LIU C, YANG K, LI G, et al. The spatio-temporal expression of p75NTR and RUNX2 during mandibular first molar tooth germ early development in rat[J]. Genomic App Biol, 2017(7): 2640–2647. DOI:10.13417/j.gab.036.002640 |
| [17] |
鞠迎新, 温秀杰, 杨琨, 等. p75神经营养受体在胎鼠颌突外胚间充质干细胞体外矿化过程中表达变化的研究[J].
中华口腔医学杂志, 2016, 51(7): 426–431.
JU Y X, WEN X J, YANG K, et al. Expression of p75 neurotrophin receptor during the mineralization of ectomesenchymal stem cells in vitro[J]. Chin J Stomatol, 2016, 51(7): 426–431. DOI:10.3760/cma.j.issn.1002-0098.2016.07.010 |
| [18] | AKIYAMA Y, MIKAMI Y, WATANABE E, et al. The P75 neurotrophin receptor regulates proliferation of the human MG63 osteoblast cell line[J]. Differentiation, 2014, 87(3/4): 111–118. DOI:10.1016/j.diff.2014.01.002 |
| [19] |
王莹莹, 储庆, 杨琨, 等. p75NTR敲除对小鼠股骨矿化发育的抑制作用[J].
第三军医大学学报, 2017, 39(12): 1245–1250.
WANG Y Y, CHU Q, YANG K, et al. Knocking out p75 neurotrophin receptor suppresses mineralization in the femurs of mice[J]. J Third Mil Med Univ, 2017, 39(12): 1245–1250. DOI:10.16016/j.1000-5404.201702160 |
| [20] | MIKAMI Y, ISHⅡ Y, WATANABE N, et al. CD271/p75(NTR) inhibits the differentiation of mesenchymal stem cells into osteogenic, adipogenic, chondrogenic, and myogenic lineages[J]. Stem Cells Dev, 2011, 20(5): 901–913. DOI:10.1089/scd.2010.0299 |
| [21] | LI G, LIU J, WANG Y, et al. LNGFR targets the Wnt/β-catenin pathway and promotes the osteogenic differentiation in rat ectomesenchymal stem cells[J]. Sci Rep, 2017, 7(1): 11021. DOI:10.1038/s41598-017-11555-9 |
| [22] | MCCLATCHEY A I, YAP A S. Contact inhibition (of proliferation) redux[J]. Curr Opin Cell Biol, 2012, 24(5): 685–694. DOI:10.1016/j.ceb.2012.06.009 |
| [23] | PARUL C, ALEX G, EMMA I, et al. Targeting the cAMP and transforming growth factor-beta pathway increases proliferation to promote re-epithelialization of human stem cell-derived retinal pigment epithelium[J]. Stem Cells Transl Med, 2016, 5(7): 925–937. DOI:10.5966/sctm.2015-0247 |
| [24] | DENKER A E, HAAS A R, NICOLL S B, et al. Chondrogenic differentiation of murine C3H10T1/2 multipotential mesenchymal cells:Ⅰ.Stimulation by bone morphogenetic protein-2 in high-density micromass cultures[J]. Differentiation, 1999, 64(2): 67–76. DOI:10.1046/j.1432-0436.1999.6420067.x |
| [25] | TRUZZI F, SALTARI A, PALAZZO E, et al. CD271 mediates stem cells to early progeny transition in human epidermis[J]. J Invest Dermatol, 2015, 135(3): 786–795. DOI:10.1038/jid.2014.454 |



