原发性肝癌是一种高度恶性肿瘤[1]。长期慢性的乙型肝炎病毒感染是导致肝癌的主要危险因素,且长期慢性的乙型肝炎病毒感染同样可导致患者免疫功能的改变[2]。近年来,随着对原发性肝癌发病机制的深入研究,发现免疫学因素在肝癌的发生、发展中发挥重要的作用,自然杀伤细胞、树突状细胞、骨髓抑制细胞、调节性T细胞等多种细胞相互作用形成肝脏肿瘤特异的免疫微环境,这个微环境减弱机体固有的免疫杀伤能力,帮助肿瘤细胞逃逸免疫系统监视,导致了疾病的发生、发展。研究表明HBV相关性肝癌的发生、发展可能与免疫微环境的改变有关[3]。最近有研究表明调节性B细胞通过分泌抑制性因子IL-10,在自身免疫性疾病和炎症性疾病中发挥保护作用,但这种负调节作用在肿瘤性疾病中反而可能会促进疾病的进展[4]。而调节性B细胞在HBV相关性肝癌中的作用目前还尚不清楚。本研究通过检测HBV相关性肝癌患者中CD19+CD24+CD38+调节性B细胞(Bregs细胞)和IL-10的表达,探讨其在肝癌疾病发展中的临床意义。
1 材料与方法 1.1 研究对象收集2016年1月至2017年6月陆军军医大学大坪医院野战外科研究所肝胆科、肿瘤科和消化科收治的93例HBV相关性肝癌患者及47例HBV相关性肝硬化患者的外周血,HBsAg阳性。所有肝癌患者经病理学证实为肝细胞性肝癌,其中74例有肝硬化基础,19例无明显证据表明有肝硬化基础,并排除其他肝炎病毒感染及合并酒精性肝炎、自身免疫性肝病,同时患者在入组前未经任何抗肿瘤相关性治疗。同时入组的57例健康对照人员均来自大坪医院体检中心,年龄、性别与HBV相关性肝硬化组、HBV相关性肝癌组相匹配。93例HBV相关性肝癌患者根据2011年美国肝病研究会推荐的巴塞罗那分期标准(BCLC分期)分为0、A、B、C、D期。收集本院手术切除HBV相关性肝癌标本20例, 每例标本同时收集癌组织、癌旁组织、远癌组织3个部位。
1.2 仪器和试剂NAVIOS流式细胞仪(Beckman Coulter公司,美国),CFX96 Real-time System(Bio-Rad公司,美国),IMMULITE1000化学发光分析仪(Siemens公司,德国),DXI800化学发光免疫分析仪(Beckman Coulter公司,美国),I2000全自动化学发光免疫分析仪(Abbott公司,美国),Ficoll淋巴细胞分离液(GE公司,美国),甲胎蛋白(alpha fetoprotein,AFP)化学发光试剂盒(Beckman Coulter公司,美国),HBsAg化学发光试剂盒(Abbott公司,美国),HBV DNA荧光定量试剂盒(湖南圣湘生物科技有限公司,中国),IL-10化学发光试剂盒(Siemens公司,德国),CD45-PC7、CD19-ECD、CD24-PE和CD38-FITC,同型对照IgG1,溶血素Optilyse C均购自美国Beckman Coulter公司。
1.3 检测方法 1.3.1 样本采集及处理分别采集各研究对象清晨空腹不抗凝血3~4 mL,分离血清,-80 ℃保存,同时采集EDTA-K2抗凝全血1.5~2 mL;收集HBV相关性肝癌患者组织标本,每例标本同时收集癌组织、癌旁组织(距离肿瘤2 cm组织)、远癌组织(距离肿瘤5 cm以上)。
1.3.2 外周血和组织中CD19+CD24+CD38+Bregs细胞检测取CD45-PC7/CD19-ECD/CD24-PE/CD38-FITC抗体各10 μL加入流式专用试管底部,以IgG1-ECD/IgG1-PE/IgG1-FITC各10 μL作为同型对照管。每管加入EDTA-K2抗凝全血100 μL,漩涡混匀后,室温避光反应15 min,加入溶血素Optilyse C,室温避光10 min,360×g离心5 min,弃上清液,加入500 μL PBS,混匀后流式细胞仪检测,以CD45和SS两个参数设门,识别淋巴细胞,进一步再以CD19+CD24+CD38+抗体识别调节性B细胞。
1.3.3 HBV血清标志物HBsAg、HBV DNA及血清IL-10检测化学发光法检测HBV血清标志物HBsAg,荧光定量PCR检测HBV DNA病毒载量,化学发光法检测血清IL-10、AFP, 所有检测按照试剂盒说明书操作。
1.3.4 组织中CD19+CD24+CD38+Bregs细胞检测将获得的癌组织、癌旁组织和远癌组织剪碎,碾磨200目滤网过滤,PBS稀释成细胞悬液,轻轻加于Ficoll淋巴细胞分离液上层,注意动作轻柔,保持清楚的界面,细胞悬液与Ficoll淋巴细胞分离液体积比为2 :1, 400×g水平离心30 min,离心后吸取中间白膜层为单个核细胞,加入5倍体积PBS,300×g离心5 min,洗涤细胞,PBS重悬,流式细胞仪检测方法同外周血。
1.4 统计学方法采用SPSS 13.0统计软件进行统计学分析。患者年龄为计量资料且呈正态分布,以x±s表示,各组间的比较采用单因素方差分析。患者的Bregs细胞比例、血清IL-10水平、HBV DNA、AFP为计量资料且呈非正态分布,以M(P25~P75)表示,采用非参数检验,两组间显著性差异分析采用Mann-Whiteny非参数U检验,多组间显著性差异分析采用Kruskal-Wallis非参数检验,相关性用Spearman相关分析。检验水准:α=0.05。
2 结果 2.1 各组基本临床资料HBV相关性肝癌组93例,其中男性86例,女性7例,年龄(51.96±11.58)岁,HBV DNA高于检测下限68例,低于检测下限25例;HBV相关性肝硬化组47例,其中男性39例,女性8例,年龄(50.89±10.17)岁,HBV DNA高于检测下限30例,低于检测下限17例;健康对照组57例,其中男性47例,女性10例,年龄(52.68±9.44)岁。各组间性别、年龄、HBV DNA差异均无统计学意义(P>0.05)。93例HBV相关性肝癌根据巴塞罗那分期标准(BCLC)分为0期4例,A期28例,B期41例,C期19例,D期1例,因0期和D期例数较少,将0期与A期合并为早期,C期和D期合并为晚期,即早期(0+A期)32例,中期(B期)41例,晚期(C+D期)20例。
2.2 各组外周血调节性B细胞分布频率和血清IL-10表达水平HBV相关性肝癌组外周血CD19+CD24+CD38+Bregs细胞占CD45+淋巴细胞的比例[2.43(1.62~ 4.14)%]显著高于HBV相关性肝硬化组[1.65(0.89~ 3.41)%,P < 0.05]和健康对照组[1.44(0.79~2.35)%,P < 0.01], HBV相关性肝硬化组和健康对照组之间差异没有统计学意义(P>0.05);HBV相关性肝癌组血清IL-10水平[2.60(1.82~3.76)pg/mL]和HBV相关性肝硬化组[2.87(1.83~6.05)pg/mL]显著高于健康对照组[1.19(1.0~1.48)pg/mL, P < 0.01,图 1]。
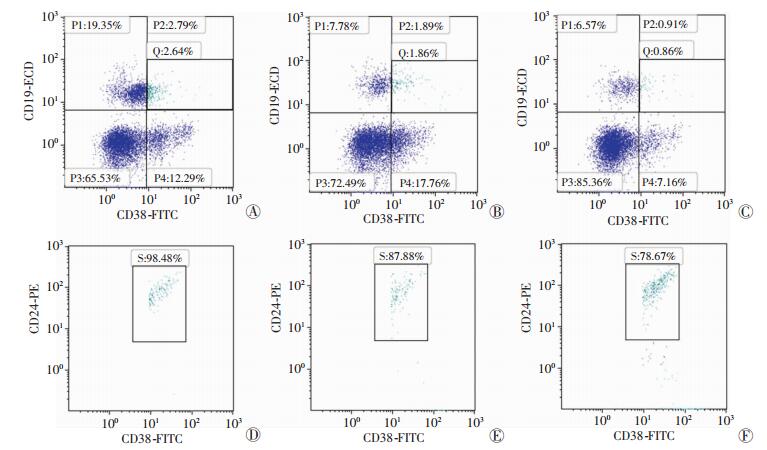
|
| A、D:HBV相关肝癌组;B、E:HBV相关肝硬化组;C、F:健康对照组;A~C:外周血中CD19+CD38+细胞在CD45+细胞中的表达频率;D~F:外周血中CD24+细胞在CD19+CD38+细胞中的表达频率 图 1 各组CD19+CD24+CD38+Bregs细胞分布频率 |
2.3 HBV相关性肝癌组不同分期患者外周血调节性B细胞分布频率和血清IL-10表达水平
HBV相关性肝癌晚期患者(C+D期)外周血CD19+CD24+CD38+Bregs细胞占CD45+淋巴细胞的比例[3.74(2.81~6.78)%]显著高于中期[B期,2.29(1.80~3.71)%,P < 0.05]和早期[0+A期,1.83(0.93~3.25)%,P < 0.01];晚期血清IL-10水平[3.52(2.44~10.72)pg/mL]较中期升高[2.62(1.86~ 3.67)pg/mL, P>0.05],且显著高于早期[2.26(1.53~3.16)pg/mL,P < 0.01]。
2.4 HBV相关性肝癌患者外周血CD19+CD24+CD38+Bregs细胞和血清IL-10与临床各参数的关系HBV相关性肝癌患者外周血CD19+CD24+CD38+Bregs细胞频率和血清IL-10与肿瘤是否多发和是否有血管侵犯有密切关系(P < 0.05),而目前无证据表明与HBV DNA是否阳性、AFP是否升高、肿瘤体积和病理类型有关(P>0.05,表 1)。
| 临床参数 | CD19+CD24+CD38+Bregs | IL-10 |
| HBV DNA | ||
| < 100 U/mL(n=25) | 2.48(1.14~3.94) | 2.83(1.93~3.76) |
| ≥100 U/mL(n=68) | 2.37(1.74~4.24) | 2.51(1.70~3.77) |
| AFP | ||
| < 15 ng/mL(n=32) | 2.46(1.61~3.56) | 2.49(1.53~3.24) |
| ≥15 ng/mL(n=61) | 2.32(1.62~4.34) | 2.61(1.94~4.00) |
| 肿瘤体积 | ||
| < 5 cm(n=48) | 2.29(1.07~4.06) | 2.51(1.70~3.28) |
| ≥5 cm(n=45) | 2.56(1.86~4.33) | 2.62(1.94~4.42) |
| 肿瘤个数 | ||
| 单发(n=63) | 2.10(1.03~2.88)b | 2.41(1.00~3.29)a |
| 多发(n=30) | 4.15(2.57~5.12) | 2.94(2.29~5.05) |
| 血管侵犯 | ||
| 未侵犯(n=75) | 2.21(1.25~3.48)d | 2.56(1.68~3.47)c |
| 侵犯(n=18) | 4.15(2.86~7.20) | 3.52(2.35~6.22) |
| 病理类型 | ||
| 低分化(n=14) | 3.19(1.79~4.48) | 2.47(1.57~3.87) |
| 中分化(n=63) | 2.31(1.64~4.15) | 2.61(1.89~4.64) |
| 高分化(n=16) | 2.29(1.25~3.57) | 2.52(1.40~3.00) |
| 有无肝硬化基础 | ||
| 无肝硬化(n=19) | 1.89(0.96~4.43) | 2.12(1.39~3.27) |
| 有肝硬化(n=74) | 2.43(1.72~4.14) | 2.61(1.87~3.83) |
| a:P < 0.05, b:P < 0.01, 与多发肿瘤比较;c:P < 0.05, d:P < 0.01, 与血管侵犯比较 | ||
2.5 外周血CD19+CD24+CD38+Bregs细胞与血清IL-10相关性分析
直线相关性分析结果显示,HBV相关性肝癌患者外周血CD19+CD24+CD38+Bregs细胞频率与血清IL-10呈正相关(r=0.46, P < 0.01)。
2.6 HBV相关性肝癌组织中调节性B细胞分布频率HBV相关性肝癌组织中,癌组织和癌旁组织CD19+CD24+CD38+Bregs细胞占CD45+淋巴细胞的比例分别为1.34 (0.52~2.55)%、1.36(1.01~3.08)%,显著高于远癌组织[0.57(0.33~1.01)%,P < 0.01,图 2]。
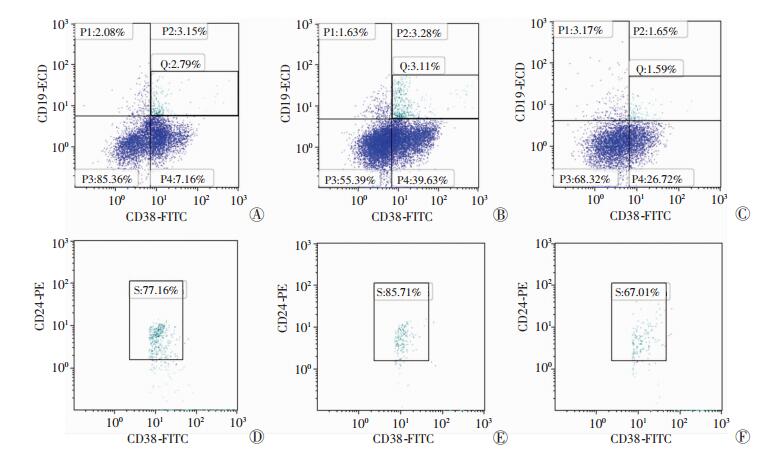
|
| A、D:癌组织;B、E:癌旁组织;C、F:远癌组织;A~C:CD19+CD38+细胞在CD45+细胞中的表达频率;D~F:CD24+在CD19+CD38+细胞中的表达频率 图 2 HBV相关性肝癌组织中CD19+CD24+CD38+Bregs细胞分布频率 |
3 讨论
免疫系统和癌症之间的关系,在过去的几十年里一直被人们所关注,免疫系统在抑制肿瘤方面中发挥着重要作用,它可以通过肿瘤细胞所表达的肿瘤相关抗原和分子,特异性地识别和清除肿瘤细胞[5]。肿瘤的发生与免疫逃逸密切相关,而免疫效应细胞在肿瘤免疫逃逸中发挥着重要的作用。调节性B细胞是近年来发现的一类新的免疫细胞亚群,目前的研究表明,其主要通过分泌IL-10等抑制性因子[6],调控调节性T细胞(Tregs细胞)、效应性T细胞等免疫细胞,维护机体的免疫平衡,在炎症性疾病和自身免疫性疾病中发挥保护性负向调控作用,但这种负向调控作用在肿瘤中反而可能促进肿瘤的发展。DILILLO等[7]的研究表明慢性淋巴细胞白血病中调节性B细胞可促进肿瘤的侵袭转移。陈葆国等[8]的研究表明CD19+CD5+CD1d+Bregs细胞在肺癌患者外周血中较健康对照显著升高,且与肺癌临床分期密切相关。石家振等[9]也在食管癌中发现了同样的现象。原发性肝癌患者外周血CD38+IgD-B细胞明显升高[10],而CD27+IgM+B细胞明显降低[11]。调节性B细胞根据表面标记的不同分为多种亚型,其在肝癌中的作用并没有明确阐明。有研究表明,CD19+CD24+CD38+Bregs细胞大量分泌IL-10[12]。
据此,本研究检测了HBV相关性肝癌、HBV相关性肝硬化和健康对照组中CD19+CD24+CD38+Bregs细胞和血清IL-10的表达,结果发现在HBV相关性肝癌患者的外周血中CD19+CD24+CD38+Bregs细胞显著高于肝硬化组和健康对照组,且晚期肝癌较早中期肝癌显著升高。同时,本研究结果也显示HBV相关性肝癌患者血清IL-10水平显著高于健康对照组,且晚期肝癌也较早期肝癌显著升高,而HBV相关性肝硬化组显著高于HBV相关性肝癌组和健康对照组,与李建高等[13]的研究结果一致,分析可能是在HBV相关性肝硬化组中病毒刺激机体的自我保护机制,增强IL-10的分泌,抑制肝损伤与肝纤维化的进展,但在是否有肝硬化基础的HBV相关性肝癌的分组比较中,IL-10的表达水平是没有差异的,说明在肿瘤特殊的微环境中,可能存在复杂的免疫调控网络,影响细胞因子的表达。本研究也发现CD19+CD24+CD38+Bregs细胞和血清IL-10与肿瘤是否多发、有无血管侵犯等有密切关系,说明CD19+CD24+CD38+Bregs细胞和血清IL-10可能在肿瘤的发生、发展中扮演着重要的角色。相关性分析表明CD19+CD24+CD38+Bregs频率与血清IL-10呈正相关,提示CD19+CD24+CD38+Bregs细胞可能通过分泌IL-10在HBV相关性肝癌免疫微环境中发挥调节作用,参与肿瘤的发生、发展。本研究也对HBV相关性肝癌的癌组织、癌旁组织和远癌组织中CD19+CD24+CD38+Bregs细胞的表达进行了检测分析,发现癌组织和癌旁组织显著高于远癌组织,且CD19+CD24+CD38+Bregs细胞在癌旁组织较癌组织中表达频率更高。我们推测正是调节性B细胞在肝组织内这种特殊的分布方式,有利于肿瘤细胞不断地向外扩展,提示CD19+CD24+CD38+Bregs细胞可能在肿瘤发展、转移中扮演着重要的角色。这种分布特征和PENG等[14]报道的Tregs在肝癌内主要位于癌巢周围组织并浸润生长的分布特征基本相同。Tregs作为一种重要的免疫抑制细胞,能够抑制T细胞的功能从而引起肿瘤的扩散、生长[15],研究者们推测Bregs和Tregs有相同的功能,即在肝癌微环境中发挥免疫抑制功能,促进肿瘤的扩散、发展。
综上所述,本研究表明,HBV相关性肝癌患者中CD19+CD24+CD38+Bregs细胞和血清IL-10表达显著升高,可能会抑制患者体内抗肿瘤免疫细胞的功能,帮助肿瘤细胞免疫逃逸,促进疾病进展。临床上检测调节性B细胞可能有助于对肿瘤诊断和预后的判断。此外,若能够将调节性B细胞特异性地去除,或许能够有效增强机体的抗肿瘤免疫反应,为肿瘤治疗提供一种新的免疫治疗方法。
| [1] | RONG G, WANG H, BOWLUS C L, et al. Incidence and risk factors for hepatocellular carcinoma in primary biliary cirrhosis[J]. Clin Rev Allergy Immunol, 2015, 48(2/3): 132–141. DOI:10.1007/s12016-015-8483-x |
| [2] | KALLAS E, HUIK K, TVRK S, et al. T cell distribution in relation to HIV/HBV/HCV coinfections and intravenous drug use[J]. Viral Immunol, 2016, 29(8): 464–470. DOI:10.1089/vim.2016.0057 |
| [3] | SHAO Y, LO C M, LING C C, et al. Regulatory B cells accelerate hepatocellular carcinoma progression via CD40/CD154 signaling pathway[J]. Cancer Lett, 2014, 355(2): 264–272. DOI:10.1016/j.canlet.2014.09.026 |
| [4] | MAURI C, BOSMA A. Immune regulatory function of B cells[J]. Annu Rev Immunol, 2012, 30: 221–241. DOI:10.1146/annurev-immunol-020711-074934 |
| [5] | DISIS M L. Immune regulation of cancer[J]. J Clin Oncol, 2010, 28(29): 4531–4538. DOI:10.1200/JCO.2009.27.2146 |
| [6] | FLOUDAS A, AMU S, FALLON P G. New insights into IL-10 dependent and IL-10 independent mechanisms of regulatory B cell immune suppression[J]. J Clin Immunol, 2016, 36(Suppl 1): 25–33. DOI:10.1007/s10875-016-0263-8 |
| [7] | DILILLO D J, WEINBERG J B, YOSHIZAKI A, et al. Chronic lymphocytic leukemia and regulatory B cells share IL-10 competence and immunosuppressive function[J]. Leukemia, 2013, 27(1): 170–182. DOI:10.1038/leu.2012.165 |
| [8] |
陈葆国, 梅丽萍, 郑瑞, 等. 肺癌患者外周血调节性B细胞的表达及其临床意义[J].
解放军医学杂志, 2015, 40(5): 396–399.
CHEN B G, MEI L P, ZHENG R, et al. Expression of the regulatory B cells in peripheral blood of patients with lung cancer and its clinical significance[J]. Med J Chin PLA, 2015, 40(5): 396–399. DOI:10.11855/j.issn.0577-7402.2015.05.13 |
| [9] |
石家振, 李世宝, 周彦. 食管癌患者外周血中调节性B细胞检测的临床意义[J].
南京医科大学学报(自然科学版), 2013, 33(2): 210–212.
SHI J Z, LI S B, ZHOU Y. Expression of the regulatory B cells in peripheral blood of patients with esophageal cancer and its clinical significance[J]. Acta Univ Med Nanjing, 2013, 33(2): 210–212. DOI:10.7655/NYDXBNS20130214 |
| [10] | WANG K, YANG R L, PEI H, et al. The expression profile of Fc receptor-like Y in B lymphocytes with hepatitis B virus induced diseases[J]. Folia Histochem Cytobiol, 2011, 49(3): 405–409. DOI:10.5603/fhc.2011.0057 |
| [11] | DOI H, IYER T K, CARPENTER E, et al. Dysfunctional B-cell activation in cirrhosis resulting from hepatitis C infection associated with disappearance of CD27-positive B-cell population[J]. Hepatology, 2012, 55(3): 709–719. DOI:10.1002/hep.24689 |
| [12] | BLAIR P A, NOREÑA L Y, FLORES-BORJA F, et al. CD19+CD24hiCD38hi B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic Lupus Erythematosus patients[J]. Immunity, 2010, 32(1): 129–140. DOI:10.1016/j.immuni.2009.11.009 |
| [13] |
李建高, 樊必夫, 管丽华, 等. 慢性乙型肝炎、肝硬化、肝癌患者血清IL-8、IL-10和leptin水平变化及其临床意义[J].
放射免疫学杂志, 2012, 25(2): 127–130.
LI J G, FAN B F, GUAN L H, et al. Clinical significance of changes on serum levels of IL-8, IL-10 and leptin in patients with chronic hepatitis B(CHB), liver cirrhosis(LC) and primary hepatocellular carcinoma(PHC)[J]. J Radioimmunol, 2012, 25(2): 127–130. DOI:10.3969/j.issn.1008-9810.2012.02.04 |
| [14] | PENG G, LI S, WU W, et al. Circulating CD4+ CD25+ regulatory T cells correlate with chronic hepatitis B infection[J]. Immunology, 2008, 123(1): 57–65. DOI:10.1111/j.1365-2567.2007.02691.x |
| [15] | ELKORD E, ALCANTAR-OROZCO E M, DOVEDI S J, et al. T regulatory cells in cancer: recent advances and therapeutic potential[J]. Expert Opin Biol Ther, 2010, 10(11): 1573–1586. DOI:10.1517/14712598.2010.529126 |



