2. 400038 重庆,陆军军医大学(第三军医大学):高原军事医学系,高原特殊药品与装备研究室,全军高原医学重点实验室;
3. 400038 重庆,陆军军医大学(第三军医大学):基础医学院免疫学教研室
2. Department of High Altitude Special Drug and Equipment Research, Key Laboratory of High Altitude Medicine of PLA, College of High Altitude Military Medicine, Chongqing, 400038, China;
3. Department of Immunology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
低氧性肺动脉高压(hypoxic pulmonary arterial hypertension,HPH)是由慢性持续低氧引起肺动脉压力与肺血管阻力持续增高的病理过程。HPH包括低氧性肺血管收缩(hypoxic pulmonary vasoconstriction,HPV)和低氧性肺血管结构改建(hypoxic pulmonary vascular remodeling,HPVR)两个发病阶段,是高原心脏病发病的中心环节。按WHO最新诊断标准,HPH以右心导管测定平均肺动脉压(mPAP)为诊断金指标,海平面静息状态下mPAP≥25 mmHg[1]。HPH是一种由慢性低氧引起的多因素参与的复杂综合征,临床治疗效果不佳,病死率高,严重危害高原环境暴露人群的身体健康。近年来,大量的研究显示,肺组织炎症在HPH的形成发展中发挥重要作用。低氧促进肺组织中炎症细胞浸润和炎症因子分泌增加,是导致肺血管改建的重要机制[2]。
LIGHT(homologous to lymphotoxins,exhibits Inducible expression,and competes with HSV Glycoprotein D for HVEM,a receptor expressed by T lymphocytes),又名TNFSF14,是肿瘤坏死因子超家族成员。LIGHT通过调节炎症反应,在糖尿病、脂肪肝、肺纤维化、炎症性肠病等诸多疾病的发生发展中发挥作用[3-5]。近年的研究发现,肺动脉高压患者的血浆中LIGHT水平增高[6]。然而,LIGHT的表达是否受低氧影响?LIGHT是否在低氧性肺动脉高压的形成中发挥作用?目前尚不清楚。本研究旨在通过观察低氧对LIGHT及其受体表达的影响,以及LIGHT在低氧性肺血管结构改变以及肺组织炎症反应中的作用,初步探讨LIGHT在低氧性肺动脉高压形成中的作用及其机制。
1 材料与方法 1.1 实验动物及分组20只8周龄雌性C57BL/6J小鼠[体质量(17.90± 0.91)g]由陆军军医大学实验动物中心提供,20只8周龄雌性LIGHT-/- C57BL/6J小鼠[体质量(17.55± 0.93)g]由德国Duesseldorf大学Klaus Pfeffer教授和陆军军医大学免疫学研究所许桂莲教授赠送。实验分为野生小鼠常氧组(WT-C组)、野生小鼠低氧组(WT-H组)、LIGHT KO小鼠常氧组(LIGHT KO-C组)和LIGHT KO小鼠低氧组(LIGHT KO-H组),每组10只。WT-H组和LIGHT KO-H组小鼠置于模拟6 000 m低压舱内连续低氧饲养30 d,WT-C组和LIGHT KO-C组小鼠于陆军军医大学实验动物中心SPF级动物房(海拔308 m)常规饲养。
1.2 实验方法 1.2.1 右心室压力测定方法15%乌拉坦0.01 mL/g腹腔注射麻醉后,小鼠仰卧固定于手术台上,经右颈外静脉插入心导管至右心室,用Power Lab/8SP多导生理记录仪(AD)测定右心室收缩压(right ventricular systolic pressure,RVSP),间接反映平均肺动脉压(mean pulmonary artery pressure,mPAP)。
1.2.2 肺循环灌注方法右心室压力检测完毕后,暴露小鼠胸腔,在左心室剪一小口,从右心室插入灌注针,用20 mL注射器缓慢推注肝素化生理盐水15 mL,整个肺叶变白,停止灌注。游离肺组织备用。
1.2.3 右心肥厚指数的测定测定右心室收缩压,以及行肺循环灌注后,游离小鼠心脏,完整去除心房组织,然后沿室间隔边缘剪下右心室,用滤纸吸干血液,分别称取右心室(right ventricle,RV)、左心室(left ventricle,LV)和室间膈(interventricular septum,S)重量(LV+S)。根据公式RV/(LV+S)计算右心室肥厚指数(right ventricular hypertrophy index,RVHI),反映右心室肥厚水平。
1.2.4 肺组织单细胞分离及其流式细胞检测分离肺循环灌注后的左肺全叶,放入含1 mLⅠ型胶原酶(Gibco,1 mg/mL)的试管中,剪刀充分剪碎后,置于摇床上,37 ℃孵育1 h。待组织充分消化分散后,70 μm尼龙滤网过滤,500×g,4 ℃,离心5 min,收集细胞沉淀。加入红细胞裂解液(灏洋生物,NH4CL2009)裂解红细胞,500×g,4 ℃,离心5 min,收集细胞沉淀。PBS洗涤细胞,加入适当体积PBS重悬细胞,获得肺组织单细胞悬液。取100 μL细胞悬液,加入TruStain fcXTM (anti-mouse CD16/32)(Biolegend)冰上孵育10 min以封闭细胞Fc段受体。然后依次加入小鼠FITC-CD11b,PE-F4/80,PerCP/Cy5.5-Gr-1,PE/Cy7-CD11c,APC-MHC-Ⅱ和APC/Cy7-CD45抗体(Biolegend),冰上避光孵育20 min,加入1 mL PBS,500 g,4 ℃,离心5 min,去上清,适量PBS重悬细胞,加入DAPI后,立即经BD FACSVerse流式细胞仪检测各标记物标记的阳性细胞比例。
1.2.5 实时荧光定量PCR(real-time PCR)检测转录水平采用Trizol法提取肺组织总RNA。取1 μg总RNA,采用PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)逆转录试剂盒(TaKaRa,RR047A),参照试剂盒说明书,逆转录获得cDNA。按SYBR® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)(TaKaRa,RR820A)试剂盒说明书操作,检测目的基因的表达水平。PCR引物由life Technologies公司合成。LIGHT的上游引物为5′-AACGCCAGCTTGATAGGTATTG-3′,下游引物为3′-GGATGTGCGCTTGTATAGTCCA-5′,IL-6的上游引物为5′-GAGGATACCACTCCCAACAGACC-3′,下游引物为3′-AAGTGCATCATCGTTGTTCATACA-5′,以β-actin的表达水平作为内参,β-actin的上游引物为5′-TATGCCAACACAGTGCTGTCTGG-3′,下游引物为3′-TACTCCTGCTTGCTGATCCACAT-5′。反应程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,重复39个循环。
1.2.6 Western blot检测蛋白水平称取30 mg肺组织,加入300 μL RIPA裂解液(Beyotime,P0013B)充分匀浆后冰上裂解2 h,冰上超声30 s,12 000 g,4 ℃,离心30 min,收集上清即为肺组织总蛋白。BCA蛋白浓度测定试剂盒(Beyotime,P0012)检测蛋白浓度。加入1/4体积的SDS-PAGE蛋白上样缓冲液(5×),100 ℃煮蛋白10 min。取40 μg蛋白样品上样,行SDS-PAGE电泳,采用湿转法,100 V电压转膜1 h。用含5%脱脂奶粉的TBST溶液(含0.1% Tween-20的TBS)室温封闭PVDF膜1 h。分别加入抗LIGHT抗体(Abcam,ab203578,1 :250),抗HVEM抗体(Abcam,ab47677,1 :500),抗LTβR抗体(Abcam,ab70063,1 :500),抗IL-6抗体(Santa Cruz,sc-1266,1 :200)和抗β-actin抗体(Beyotime,AF0003,1 :2000),4 ℃孵育过夜。TBST洗3次,加辣根过氧化酶标记山羊抗兔(中杉金桥,ZB-2301,1 :1 000)或兔抗山羊(中杉金桥,ZB-2306,1 :1 000)或山羊抗小鼠(中杉金桥,ZB-2305,1 :2 000)抗体,室温孵育1 h,TBST洗3次,New-Super ECL(凯基生物,KGP1128)显影,Bio-Rad凝胶成像仪显影照相。采用Quantity one软件,以β-actin为内参,分析各目的基因的蛋白水平。
1.2.7 肺组织HE染色灌注后的右肺组织,放入4%多聚甲醛溶液固定,石蜡包埋切片,经HE染色后,光学显微镜下观察肺血管结构,并照相。
1.2.8 免疫组织化学检测石蜡切片经枸橼酸盐缓冲液处理以修复抗原,加入适量的内源性过氧化物酶阻断剂,室温孵育10 min,PBS缓冲液冲洗3次,加入正常山羊血清封闭15 min,吸干血清,分别加入抗LIGHT抗体(Abcam,ab203578,1 :100),抗HVEM抗体(Santa Cruz,sc-365971,1 :300)和抗LTβR抗体(Abcam,ab70063,1 :600),4 ℃孵育过夜,PBS缓冲液冲洗3次,分别加入生物素标记山羊抗兔(中杉金桥,SP-9001)或山羊抗小鼠(中杉金桥,SP-9002)IGg聚合物,室温孵育10 min,PBS缓冲液冲洗3次,滴加辣根酶标记链霉卵白素工作液,室温孵育10 min,PBS缓冲液冲洗3次,DAB显色5 min。用苏木精复染核,封片,光学显微镜下观察并照相。
1.3 统计学处理结果以x±s表示。采用SPSS 13.0统计软件对实验数据进行双因素方差分析和独立样本t检验。
2 结果 2.1 低氧对肺组织中LIGHT表达的影响与WT-C组相比,WT-H组小鼠肺组织中LIGHT mRNA水平显著增高,差异具有统计学意义[(2.79±0.52)vs (1.01±0.16),P < 0.05]。与mRNA水平改变一致的是,WT-H组小鼠肺组织中LIGHT蛋白水平显著增高,与WT-C组相比,差异具有统计学意义[(2.22±0.71)vs (1.00±0.29),P < 0.05](图 1)。免疫组织化学结果显示,与WT-C组相比,WT-H组小鼠肺组织中LIGHT的表达增加(图 2)。这些结果表明,慢性低氧可以上调小鼠肺组织中LIGHT的表达。
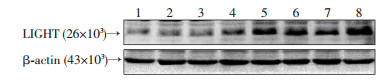
|
| 1~4:常氧;5~8:低氧 图 1 Western blot检测常氧和低氧条件下野生小鼠肺组织中LIGHT蛋白水平 |
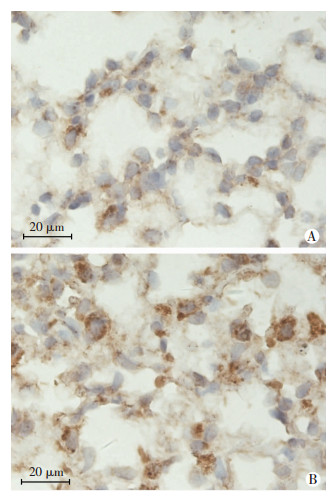
|
| A:常氧;B:低氧 图 2 免疫组织化学检测常氧和低氧条件下野生小鼠肺组织LIGHT表达水平 |
2.2 LIGHT敲除对低氧肺动脉压力和肺血管结构改变的影响
通过检测RVSP来间接反映mPAP。与WT-C组相比,LIGHT KO-C组小鼠RVSP [(25.81±2.59)mmHg vs (25.32±2.80)mmHg]和RVHI[(24.03±1.13)% vs (23.80±2.19)%]无明显差异。低氧处理30 d后,WT-H组与WT-C组相比{ RVSP[(42.36±3.58)mmHg vs (25.32±2.80)mmHg]、RVHI [(33.64±3.13)% vs (23.80±2.19)%] },LIGHT KO-H组与LIGHT KO-C组相比{ RVSP [(37.92±3.01)mmHg vs (25.81±2.59)mmHg]、RVHI[(28.91±1.43)% vs (24.03±1.13)%] },RVSP和RVHI都明显升高,差异均具有统计学意义(P < 0.05,图 3),表明WT和LIGHT KO小鼠都对低氧具有显著反应性。但LIGHT KO-H组与WT-H组相比,RVSP[(37.92±3.01)mmHg vs (42.36±3.58)mmHg]和RVHI[(28.91±1.43)% vs (33.64±3.13)%]明显降低,差异均具有统计学意义(P < 0.05,图 3)。肺组织切片HE染色结果显示,与WT-C组小鼠相比,LIGHT KO-C组小鼠肺小动脉厚度无明显改变,低氧处理后,WT-H和LIGHT KO-H组小鼠的肺小动脉均有增厚,但LIGHT KO-H组小鼠的肺小动脉增厚程度与WT-H组小鼠相比,明显降低(图 4)。
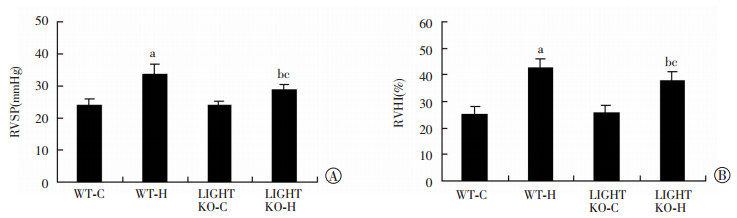
|
|
A:右心室收缩压RVSP(n=8,x±s);B:右心肥厚指数RVHI(n=10,x±s) a:P < 0.05,与WT-C比较;b:P<0.05,与LIGHT KO-C比较;c:P < 0.05,与WT-H比较 图 3 LIGHT敲除对小鼠低氧肺动脉压力和肺血管结构改变的影响 |

|
| A: WT-C; B: WT-H; C: LIGHT KO-C; D: LIGHT KO-H 图 4 HE染色观察LIGHT敲除减轻低氧条件下小鼠肺小动脉结构变化 |
2.3 低氧对肺组织中LIGHT受体HVEM和LTβR表达的影响
与WT-C组相比,WT-H组小鼠肺组织中LIGHT受体HVEM和LTβR的mRNA水平均没有显著差异。但是,Western blot的结果显示,WT-H组小鼠肺组织中HVEM蛋白水平显著增加[(1.57±0.27)vs (1.00±0.28)],而LTβR蛋白水平显著降低[(0.64±0.17)vs (1.00±0.04)],与WT-C组相比,差异均具有显著意义(P < 0.05,图 5)。免疫组织化学检测结果显示,与WT-C组相比,WT-H组小鼠肺组织中HVEM表达增加,而受体LTβR的表达减少(图 6)。这些结果表明,低氧增加肺组织LIGHT受体HVEM表达,下调另一LIGHT受体LTβR表达。

|
| 1~4:常氧;5~8:低氧 图 5 Western blot检测常氧(WT-C)和低氧(WT-H)条件下野生小鼠肺组织HVEM、LTβR蛋白水平 |
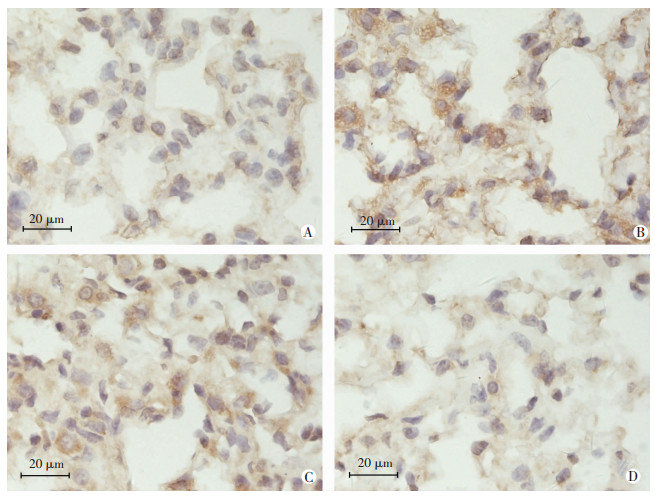
|
| A:常氧HVEM; B:低氧HVEM; C:常氧LTβR; D:低氧LTβR 图 6 免疫组织化学检测常氧和低氧条件下野生小鼠肺组织中HVEM、LTβR表达水平 |
2.4 LIGHT对低氧肺组织中IL-6水平的影响
采用实时荧光定量PCR检测了低氧肺组织中IL-6 mRNA水平,结果显示,与WT-H组相比,LIGHT KO-H组IL-6 mRNA水平显著降低,差异具有统计学意义[(0.39±0.10)vs (1.02±0.24),P < 0.05]。Western blot结果显示,LIGHT KO-H组小鼠肺组织IL-6蛋白水平也显著降低,与WT-H组相比,差异具有统计学意义[(0.72±0.10)vs (1.00±0.06),P < 0.05](图 7)。以上结果表明,敲除LIGHT能够降低低氧肺组织IL-6水平,提示LIGHT可能通过IL-6在低氧性肺动脉高压的形成过程中发挥作用。
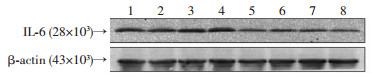
|
| 1~4:野生小鼠; 5~8: LIGHT KO小鼠 图 7 Western blot检测低氧条件下野生小鼠和LIGHT KO小鼠肺组织中IL-6蛋白水平 |
2.5 LIGHT对低氧肺组织中单核-巨噬细胞比例的影响
慢性低氧可引起肺组织单核-巨噬细胞增加,这些细胞直接参与低氧肺血管改建。以图 8A展示的画门策略,用DAPI区分死细胞,分析肺泡巨噬细胞(AM,CD11b+F4/80+CD11c+)、肺间质巨噬细胞(IM,CD11b+F4/80+CD11c-)、单核细胞(Mon,CD11b+F4/80-Gr-1-)、中性粒细胞(PMN,CD11b+F4/80-Gr-1+)和mDC细胞(CD11c+F4/80-MHC-Ⅱ-)比例。结果显示,与WT-C组相比,WT-H组小鼠肺组织中AM、PMN比例无明显变化,Mon的比例降低,IM、mDC比例增加,差异均具有统计学意义(P < 0.05,图 8B),提示慢性低氧诱导肺组织中IM富集。而LIGHT KO-H组与WT-H组相比,肺组织中Mon的比例增加,IM、mDC比例降低,差异具有统计学意义(P < 0.05,图 8C)。这些结果表明,LIGHT可能通过促进IM产生,参与调控低氧诱导肺组织中单核-巨噬细胞浸润。
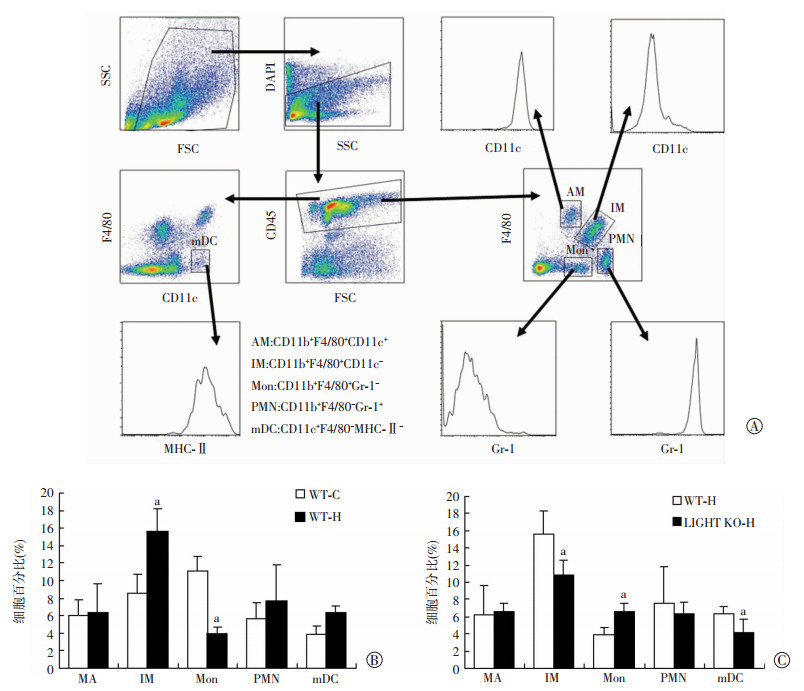
|
| A:流式细胞术分析策略;B:常氧(WT-C)和低氧(WT-H)条件野生小鼠肺组织炎症细胞比例 a:P < 0.05,与WT-C比较;C:低氧条件下野生小鼠(WT-H)和LIGHT KO小鼠(LIGHT KO-H)肺组织炎症细胞比例 a:P < 0.05,与WT-H比较 图 8 流式细胞术分析小鼠肺组织中单核-巨噬细胞比例(n=9,x±s) |
3 讨论
本研究发现,慢性低氧可以上调肺组织LIGHT表达,敲除LIGHT后,低氧引起的肺血管结构改建被抑制,并显著降低低氧肺动脉压力。我们对LIGHT促进低氧肺动脉高压的机制进行了初步研究,一方面,LIGHT可能通过HVEM、LTβR受体相关信号调控细胞增殖与凋亡[7],参与血管结构改建;另一方面,LIGHT可能通过促进IL-6表达,促进肺组织中单核细胞向肺间质巨噬细胞分化,影响肺组织中单核-巨噬细胞浸润,参与低氧肺动脉高压的形成[8]。
在HPH发生发展过程中,肺血管结构改建是重要的发病机制,其中肺小动脉中层增厚主要源于低氧导致的肺血管平滑肌细胞的过度增殖。LIGHT通过与受体HVEM或LTβR结合,在细胞增殖与凋亡过程中发挥不同的作用。在LTβR表达显著高于HVEM的细胞中,LIGHT促进细胞凋亡;而LIGHT作用于HVEM和LTβR均衡表达的细胞时,促进细胞生存[7]。有研究报道,LIGHT可促进血管平滑肌细胞增殖,但是突变型LIGHT(LIGHT-R228E,228位精氨酸突变为谷氨酸),只能与LTβR特异性结合,不能引起细胞增殖,这表明LIGHT诱导的血管平滑肌增殖主要依赖HVEM受体信号途径[9]。我们的研究发现,低氧导致肺组织LIGHT和HVEM表达增加,而LTβR表达下调。并且敲除LIGHT的小鼠与野生鼠相比,低氧诱导的肺血管增厚明显降低。这些结果提示,低氧诱导的LIGHT表达,可能通过HVEM途径促进肺小动脉平滑细胞增殖,通过下调LTβR抑制平滑肌细胞凋亡,从而参与低氧肺血管结构改建。这一推测,将在今后的离体细胞实验中进一步验证。
低氧可以导致肺血管特异性炎症反应,其中循环单核-巨噬细胞在肺血管外膜的募集最为明显[10]。低氧首先会激活肺组织的固有炎症细胞,产生一个炎性微环境。这个炎性环境驱使循环单核细胞(Monocyte,Mon)通过毛细血管、滋养血管募集到肺血管外膜,参与肺血管改建[11-12]。
根据空间分布不同,肺巨噬细胞可以分为肺泡巨噬细胞(alveolar macrophages,AM),起源于卵黄囊和胚胎单核细胞,主要靠自我增殖进行自我更新,以及肺间质巨噬细胞(interstitial macrophages,IM)主要来源于骨髓造血细胞,由Mon转分化而来[13-15]。PUGLIESE[16]等研究发现低氧使IM增加,但并不增加AM数量。我们的结果也显示,低氧引起野生型小鼠肺组织Mon比例减少,IM比例增加,而AM比例没有明显改变。但敲除LIGHT后,低氧肺组织中IM比例减少,而Mon比例增加。基于IM可以由Mon转分化而来,我们推测,LIGHT通过促进IM的富集参与低氧肺血管炎症及血管改建,而Mon-IM转化可能是其作用途径之一。
炎症因子IL-6与低氧性肺动脉高压的形成有密切关系。首先,低氧上调小鼠肺组织IL-6 mRNA水平[17-19]。利用转基因技术使小鼠肺组织特异性过表达IL-6,小鼠右心室收缩压和右心肥厚指数增加;常氧条件下,过表达IL-6可导致肺小血管肌化,而低氧加重这一过程[20];但在慢性低氧条件下,IL-6敲除小鼠肺小血管肌化和内膜增厚程度都显著减轻[19]。用中和抗体封闭IL-6受体后,低氧诱导的肺动脉高压得到明显改善[17]。我们实验发现,慢性低氧的LIGHT敲除小鼠的肺组织中IL-6水平显著降低,提示LIGHT可能通过IL-6途径参与低氧性肺动脉高压的形成。
SAVALE[19]等在小鼠慢性低氧模型发现,敲除IL-6可以减少巨噬细胞向肺组织募集。最近的研究发现,肺间质巨噬细胞高水平分泌IL-6[21]。这就进一步提示我们,LIGHT依赖的IL-6增加和IM的产生之间有着密切的联系。因此,进一步探讨低氧条件下,LIGHT增加、IL-6分泌增加、IM在肺组织聚集三者之间的相互关系,对认识低氧性肺动脉高压的发生发展具有重要意义,值得深入研究。
肺血管改建是低氧性肺动脉高压形成的中心环节。肺血管平滑肌细胞过度增殖、血管外周炎症细胞浸润和炎症因子分泌增加是低氧肺血管改建的直接促进因素。我们的研究发现低氧诱导肺组织LIGHT表达增加,而LIGHT可能通过HVEM途径促进肺血管平滑肌细胞增殖,诱导IM增多和IL-6的分泌参与肺血管改建。进一步深入探讨LIGHT在低氧肺血管改建中的作用机制,可能为防治低氧性肺动脉高压的发生发展提供新的线索。
| [1] | MCLAUGHLIN V V, ARCHER SL, BADESCH D B, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association[J]. J Am Coll Cardiol, 2009, 53(17): 1573–619. DOI:10.1016/j.jacc.2009.01.004 |
| [2] | PUGLIESE SC, POTH JM, FINI MA, et al. The role of inflammation in hypoxic pulmonary hypertension: from cellular mechanisms to clinical phenotypes[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 308(3): L229–52. DOI:10.1152/ajplung.00238.2014 |
| [3] | HALVORSEN B, SANTILLI F, SCHOLZ H, et al. LIGHT/TNFSF14 is increased in patients with type 2 diabetes mellitus and promotes islet cell dysfunction and endothelial cell inflammation in vitro[J]. Diabetologia, 2016, 59(10): 2134–2144. DOI:10.1007/s00125-016-4036-y |
| [4] | KRAUSE P, ZAHNER S P, KIM G, et al. The tumor necrosis factor family member TNFSF14 (LIGHT) is required for resolution of intestinal inflammation in mice[J]. Gastroenterology, 2014, 146(7): 1752–1762. DOI:10.1053/j.gastro.2014.02.010 |
| [5] | DOHERTY T A, SOROOSH P, KHORRAM N, et al. The tumor necrosis factor family member LIGHT is a target for asthmatic airway remodeling[J]. Nat Med, 2011, 17(5): 596–603. DOI:10.1038/nm.2356 |
| [6] | OTTERDAL K, ANDREASSEN AK, YNDESTAD A, et al. Raised LIGHT levels in pulmonary arterial hypertension: potential role in thrombus formation[J]. Am J Respir Crit Care Med, 2008, 177(2): 202–207. DOI:10.1164/rccm.200703-506OC |
| [7] | BECHILL J, MULLER W J. Herpesvirus entry mediator (HVEM) attenuates signals mediated by the lymphotoxin beta receptor (LTbetaR) in human cells stimulated by the shared ligand LIGHT[J]. Mol Immunol, 2014, 62(1): 96–103. DOI:10.1016/j.molimm.2014.06.013 |
| [8] | FLORENTIN J, DUTTA P. Origin and production of inflammatory perivascular macrophages in pulmonary hypertension[J]. Cytokine, 2017, 100: 11–15. DOI:10.1016/j.cyto.2017.08.015 |
| [9] | WEI C Y, CHOU Y H, HO F M, et al. Signaling pathways of LIGHT induced macrophage migration and vascular smooth muscle cell proliferation[J]. J Cell Physiol, 2006, 209(3): 735–743. DOI:10.1002/jcp.20742 |
| [10] | FRID M G, BRUNETTI J A, BURKE D L, et al. Hypoxia-induced pulmonary vascular remodeling requires recruitment of circulating mesenchymal precursors of a monocyte/macrophage lineage[J]. Am J Pathol, 2006, 168(2): 659–669. DOI:10.2353/ajpath.2006.050599 |
| [11] | CHEN T, YANG C, LI M, et al. Alveolar Hypoxia-Induced Pulmonary Inflammation: From Local Initiation to Secondary Promotion by Activated Systemic Inflammation[J]. J Vasc Res, 2016, 53(5-6): 317–329. DOI:10.1159/000452800 |
| [12] | BURKE D L, FRID M G, KUNRATH C L, et al. Sustained hypoxia promotes the development of a pulmonary artery-specific chronic inflammatory microenvironment[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297(2): L238–250. DOI:10.1152/ajplung.90591.2008 |
| [13] | BEDORET D, WALLEMACQ H, MARICHAL T, et al. Lung interstitial macrophages alter dendritic cell functions to prevent airway allergy in mice[J]. J Clin Invest, 2009, 119(12): 3723–3738. DOI:10.1172/JCI39717 |
| [14] | GIBBINGS S L, THOMAS S M, ATIF S M, et al. Three Unique Interstitial Macrophages in the Murine Lung at Steady State[J]. Am J Respir Cell Mol Biol, 2017, 57(1): 66–76. DOI:10.1165/rcmb.2016-0361OC |
| [15] | GUILLIAMS M, DE KLEER I, HENRI S, et al. Alveolar macrophages develop from fetal monocytes that differentiate into long-lived cells in the first week of life via GM-CSF[J]. J Exp Med, 2013, 210(10): 1977–1992. DOI:10.1084/jem.20131199 |
| [16] | PUGLIESE S C, KUMAR S, JANSSEN W J, et al. A Time-and Compartment-Specific Activation of Lung Macrophages in Hypoxic Pulmonary Hypertension[J]. J Immunol, 2017, 198(12): 4802–4812. DOI:10.4049/jimmunol.1601692 |
| [17] | HASHIMOTO-KATAOKA T, HOSEN N, SONOBE T, et al. Interleukin-6/interleukin-21 signaling axis is critical in the pathogenesis of pulmonary arterial hypertension[J]. Proc Natl Acad Sci U S A, 2015, 112(20): E2677–2686. DOI:10.1073/pnas.1424774112 |
| [18] | MASTON L D, JONES D T, GIERMAKOWSKA W, et al. Central role of T helper 17 cells in chronic hypoxia-induced pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 312(5): L609–L624. DOI:10.1152/ajplung.00531.2016 |
| [19] | SAVALE L, TU L, RIDEAU D, et al. Impact of interleukin-6 on hypoxia-induced pulmonary hypertension and lung inflammation in mice[J]. Respir Res, 2009, 10: 6. DOI:10.1186/1465-9921-10-6 |
| [20] | STEINER M K, SYRKINA O L, KOLLIPUTI N, et al. Interleukin-6 overexpression induces pulmonary hypertension[J]. Circ Res, 2009, 104(2): 236–244, 28p following 244. DOI:10.1161/CIRCRESAHA.108.182014 |
| [21] | KAWANO H, KAYAMA H, NAKAMA T, et al. IL-10-producing lung interstitial macrophages prevent neutrophilic asthma[J]. Int Immunol, 2016, 28(10): 489–501. DOI:10.1093/intimm/dxw012 |



