胚胎肝前体细胞具有较强的增殖能力和分化为肝细胞、胆管细胞、胰岛细胞等多种细胞的能力, 同时具有免疫原性弱等特点, 因此是治疗终末期肝病最理想的细胞来源[1-2]。胚胎肝发育是一个复杂的过程, 需要胚胎肝前体细胞、微环境中各种间质细胞及细胞因子的共同参与[3]。胚胎肝微环境中间质细胞和胚胎肝脏前体细胞的交流接触对后者的增殖和分化起重要作用[4-5]。肝脏间质细胞包括星状细胞、巨噬细胞、成纤维细胞等, 其中主要为肝星状细胞。研究表明, 肝星状细胞主要通过TGF-β1激活为肌成纤维细胞而发挥促进肝纤维化、肝硬化、血管形成等生物学作用[6-7]。由于目前国内对胚胎肝前体细胞体外培养方法和分化的研究较少, 因此我们对mHPCs体外培养方法进行了研究, 将TGF-β1激活的mHSCs与原代mHPCs Transwell共培养建立体外共培养体系, 并对TGF-β1激活的mHSCs及mHPCs进行初步鉴定和生物学特性分析。本实验旨在探索体外培养和诱导分化mHPCs的最佳条件, 为进一步研究移植至动物体内的胚胎肝前体细胞长期存活及大量增殖分化打下基础。
1 材料与方法 1.1 实验动物SPF级C57 BL/6小鼠由重庆医科大学实验动物中心提供, 体质量(25±5)g, 普通饲料喂养, 自由进食饮水, 雌雄按2 :1合笼过夜, 次日晨查, 以雌鼠出现阴栓为受孕标志, 以发现阴栓的当天上午计为孕0.5 d。采用14.5 d孕鼠, 取其胎鼠肝脏作为实验材料。
1.2 材料小鼠肝星状细胞株(mHSCs-T25)由北京北纳创联生物技术公司BNCC细胞库提供。
1.3 主要试剂DMEM培养基、DMEM/F12 1 :1培养基、胎牛血清、非必需氨基酸溶液、青霉素、链霉素(购自美国Gibco公司); HEPES、地塞米松、尼克酰胺、L-谷氨酸、明胶、丝裂霉素C、7-AAD液(购自美国Sigma Aldrich公司); Accutase细胞消化液、KnockOutTM Serum Replacement(KSR)、Insulin-Transferrin-Selenium X (购自美国Invitrogen公司); TRIzol、RNA逆转录试剂盒、SYBR(购自大连TaKaRa公司); RNAprep Pure微量RNA提取试剂盒(购自中国TIANGEN BIOTECH公司); 小鼠抗小鼠TGF-β1单克隆抗体、兔抗小鼠α-SMA多克隆抗体、兔抗小鼠CK19单克隆抗体(购自英国Abcam公司); 兔抗小鼠TGF-β-R1多克隆抗体、兔抗小鼠Jagged1多克隆抗体、小鼠抗小鼠单克隆抗体AL(购自美国Santacruz公司); 小鼠抗小鼠单克隆抗体AFP(购自美国RD公司); PE标记大鼠抗小鼠抗体DLK1(购自日本MBL公司); PE连接的大鼠抗小鼠IgG同型对照抗体(购自美国eBioscience公司); Dylight 488标记的山羊抗兔IgG二抗(购自美国Abbkine公司); CY3标记亲和纯化的山羊抗兔IgG(H+L)二抗、Peroxidase-conjugated Affinipure山羊抗小鼠的IgG (H+L)二抗、Peroxidase-conjugated Affinipure山羊抗兔IgG (H+L)、肝细胞生长因子(hepatocyte growth factor, HGF)、表皮生长因子(epidermal growth factor, EGF)(购自美国PeproTech公司); 3 μm孔径Transwell小室(购自美国Corning公司)。
1.4 小鼠肝星状细胞的培养、分组及饲养层细胞制备以10%胎牛血清+1%双抗(青霉素、链霉素) DMEM培养基培养细胞, CO2培养箱(5% CO2), 37 ℃, 1~2 d换液, 2~3 d细胞传代, 0.25%胰酶消化细胞2~3 min, DMEM培养基终止反应。mHSCs无血清饥饿培养24 h后换15%KSR+1%双抗(青霉素、链霉素)的DMEM培养基, 并加入TGF-β1(10 ng/mL)处理48 h, 分为激活组(mHSCs-TGF-β1)和对照组(mHSCs)。加入10 μg/mL的丝裂霉素C处理2~3 h, 阻止细胞分裂增殖, 用作饲养层细胞。
1.5 流式检测小鼠胚胎肝前体细胞标志物DLK1及DLK1+小鼠胚胎肝前体细胞的分选无菌条件下取出胎龄E14.5的C57胎鼠, 缓冲液(DPBS+3%血清)冲洗2次, 取出胎肝(约6~8个), 置于4 ℃的缓冲溶液中, 去除白色筋膜组织, 置入离心管中, 加3~5 mL accutase细胞消化液, 置于37 ℃培养箱中消化5 min。用吸管吹散成细胞悬液, 通过400目滤网过滤获取单细胞悬液后离心(800×g, 5 min), 用缓冲液重悬后将细胞移到1.5 mL规格的EP管中, 低速离心(500×g, 1 min), 共洗涤3次。吸去细胞上清, 加入10 μL山羊血清室温封闭5 min, 封闭后加20 μL anti-Dlk mAb-PE抗体, 同型对照按照说明书说明加入。4 ℃孵育30 min后加缓冲液重悬, 低速离心(500×g, 1 min), 洗涤1次。加5 μL 7-AAD室温孵育5 min去除死细胞, 低速离心(500×g, 1 min), 吸去上清, 加入缓冲液重悬, 送至流式检测或流式细胞仪FACSVantage SE(美国BD公司)分选。
1.6 体外共培养体系采用3 μm Transwell小室置于0.1%明胶包被的24孔板上构建共培养体系, 将分选的原代mHPCs以0.5×104/孔密度种植于下室, 上室接种0.5×105/孔丝裂霉素C处理的mHSCs, 分为mHPCs+mHSCs-TGF-β1组, mHPCs+mHSCs组和mHPCs组, 置于37 ℃, 5% CO2恒温培养箱内培养。采用1 :1无血清培养基(即在DMEM/F12培养基中加入15% KSR、10 mmol/L尼克酰胺、1×Insulin-Transferrin-Selenium X、10-7 mol/L地塞米松、2.5 mmol/L HEPES、L-谷氨酰胺、1×非必需氨基酸溶液和1%双抗)和DMEM(含15% KSR+1%双抗)培养。最后加入表皮生长因子(浓度为20 ng/mL)、肝细胞生长因子(浓度为40 ng/mL), 刺激细胞生长。每3天半定量更换新鲜培养液, 在37 ℃, 5%CO2细胞培养箱中培养, 并定期观察细胞生长情况。
1.7 Western blot法检测mHSCs的激活情况按照蛋白提取试剂盒说明书步骤提取mHSCs总蛋白, 采用BCA法测定蛋白浓度并调整蛋白浓度为40 mg/mL。蛋白样品与5×蛋白上样冲缓冲液4 :1混合后100 ℃加热5 min使蛋白变性, 在10%SDS-聚丙烯酰胺凝胶中电泳分离, 完毕后采用湿转法将凝胶上的蛋白转移到PVDF膜上, 5%高钙脱脂奶粉摇床上封闭2 h, 加入一抗4 ℃过夜(TGF-β1 1 :100, α-SMA 1 :1 000, TGF-β-R1 1 :500, Jagged1 1 :500), 用TBST洗3次, 每次15 min, 加入特异性二抗37 ℃赋予1 h, 最后经ECL发光显影。定影后所得免疫印迹图谱用Fusion软件分析, 用每个目的蛋白条带灰度扫描值对比相应的内参GAPDH条带的灰度值, 得到目的蛋白灰度的标准化值。实验重复3次, 取3次实验的平均值。
1.8 免疫荧光检测DLK1+mHPCs中ALB、AFP和CK19表达情况新分选细胞悬液滴1滴于共聚焦培养皿上, 涂片后室温晾干, 用2%多聚甲醛固定20 min, PBS洗2次, 10% BSA室温封闭1 h, 加入一抗4 ℃过夜(ALB 1 :100, AFP 1 :100, CK19 1 :200), PBS洗3次, 加入适量相应二抗, 室温孵育1 h, 避光操作; DAPI染核5 min, 然后在荧光显微镜观察并收集图像。mHSCs和mHPCs共培养6 d后, 用PBS洗2次, 4%多聚甲醛固定15 min, 0.4% Trition透膜10 min, PBS洗2次, 滴加山羊血清封闭1 h; 加入AFP、ALB、CK19后4 ℃孵育过夜, 滴加相应二抗室温孵育1 h, 滴加DAPI室温孵育5 min, PBS洗3次, 在荧光显微镜下观察并收集图像。使用image-Pro Plus计数每个视野中染上DAPI和目的蛋白的细胞数, 染上目的蛋白细胞数/DAPI的细胞数表示表达强度。
1.9 qRT-PCR法检测mHSCs的激活情况及mHPCs的分化情况用TRIzol试剂提取mHSCs总mRNA; 用RNAprep Pure微量RNA提取试剂盒提取共培养6 d后的mHPCs总mRNA。按照WesternBiotechnology反转录试剂盒说明书操作反转录为cDNA, 引物设计见表 1。反转录条件:25 ℃ 10 min, 42 ℃ 50 min, 85 ℃ 5 min。按照Western Biotechnology荧光定量PCR扩增试剂盒说明书操作, 扩增条件设置:94 ℃预变性4 min, 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 循环40次, 72 ℃检测信号。使用2-△△CT法来计算相对mRNA含量, △CT=CT(目的基因)-CT(管家基因GAPDH), △△CT=△CT(激活组)-△CT(对照组), 2-△△CT表示激活组目的基因mRNA的含量相对对照组所改变的倍数。
| 引物名称 | 引物(5′→3′) | 片段长度(bp) |
| α-SMA | 上游GGCATCCACGAAACCACCTA 下游CGTCGTATTCCTGTTTGCTGAT |
274 |
| TGF-β1 | 上游GAGGCGGTGCTCGCTTTGTA 下游CGTTGTTGCGGTCCACCATTA |
351 |
| TGF-β-R1 | 上游TTATGAGAGAATGCTGGTATGCC 下游CCTTCCTGTTGGCTGAGTTGT |
96 |
| Jagge1 | 上游AGTGGCTTGGGTCTGTTGCTT 下游ACCGTGTTGGCTCCGTGTT |
168 |
| HGF | 上游GAGGCGAGGAGAAACGCAAAC 下游TATCCAGGATTGCAGGGCGA |
108 |
| VEGF | 上游TGTTCAGAGCGGAGAAAGCAT 下游ACGTTCGTTTAACTCAAGCTGC |
111 |
| AFP | 上游TTCGTATTCCAACAGGAGGCTAT 下游GTTCAGGCTTTTGCTTCACCA |
179 |
| ALB | 上游CTGCGATAAACCACTGTTGAAGAA 下游ATATTCATACAAGAACGTGCCCAG |
169 |
| CK19 | 上游GACGTGCGTGCCGACATAGA 下游GGTGGGCAGATTGTTGTAGTGG |
147 |
| Hes1 | 上游AAGAGGCGAAGGGCAAGAATAA 下游GGTGCTTCACAGTCATTTCCAGA |
133 |
| SOX9 | 上游AAGAAAGACCACCCCGATTACA 下游CAGCGCCTTGAAGATAGCATTA |
126 |
| GAPDH | 上游GTGCTGAGTATGTCGTGGAGTCT 下游AGTCTTCTGGGTGGCAGTGAT |
290 |
1.10 统计学分析
采用SPSS 20.0软件进行统计分析, 数据资料用x±s表示, 样本均数比较采用配对样本Student’s-t检验及单因素方差分析, 各组间的比较采用t检验。检验水准α=0.05。
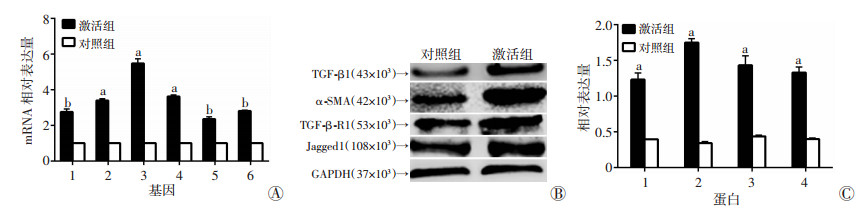
2 结果 2.1 TGF-β1激活mHSCs的结果qRT-PCR检测TGF-β1、α-SMA、TGF-β-R1、Jagged1、VEGF、HGF等mRNA在mHSCs中的表达情况, 结果显示:加入TGF-β1(10 ng/mL)处理48 h的激活组mHSCs中TGF-β1、α-SMA、TGF-β-R1、Jagged1、VEGF、HGF等mRNA表达量均较对照组明显增加, 差异均有统计学意义(P < 0.01), 见图 1A。Western blot结果显示:激活组mHSCs中效应蛋白TGF-β1、α-SMA、TGF-β-R1、Jagged1的表达量均较对照组明显增加(P < 0.01), 见图 1B、C。上述结果提示, mHSCs已被激活, 其机制可能与TGF-β1调节Jagged1在mHSCs中的表达有关。
|
| A:qRT-PCR检测两组mHSCs中各个基因mRNA的相对表达量; 1:TGF-β1, 2:α-SMA, 3:TGF-β-R1, 4:Jagged1, 5:VEGF, 6:HGF; B:Western blot检测结果; C:效应蛋白的相对表达量; 1:TGF-β1, 2:α-SMA, 3:TGF-β-R1, 4:Jagged1;a:P < 0.01, b:P < 0.05, 与对照组比较 图 1 qRT-PCR和Western blot检测TGF-β1激活mHSCs的情况 |
2.2 mHPCs特异性标志物DLK1检测和分选结果
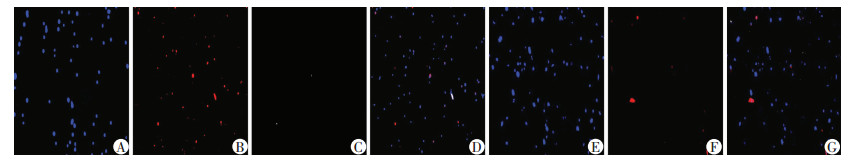
用FACS法检测mHPCs特异性标志物DLK1阳性率, 对照组0.52%(图 2A), 实验组23.26%(图 2B)。FACS分选结果提示:7-AAD排除死亡细胞后DLK1阳性细胞占胚胎肝细胞比率为对照组1.02%(图 2C), 同型对照组47.16%(图 2D), 实验组41.72%(图 2E)。

|
| A:对照组; B:激活组; C:对照组; D:同型对照组; E:激活组 图 2 mHPCs特异性标志物检测(A、B)和流式分选(C~E)结果 |
2.3 mHPCs鉴定结果
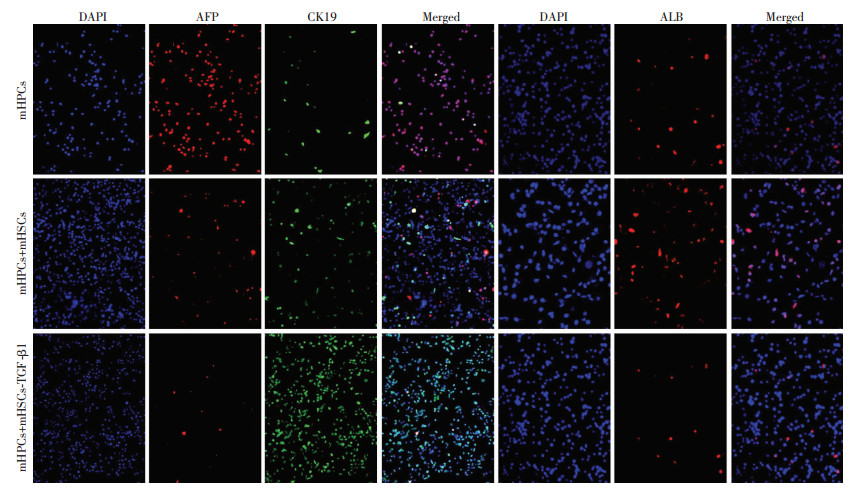
采用细胞免疫荧光染色法鉴定DLK1+ 细胞, 可见新分选的DLK1+ 细胞质中表达AFP, 同时微弱表达ALB, 而不表达CK19(图 3), 提示分选出的DLK1+ 细胞为mHPCs。
|
| A:DAPI; B:AFP; C:CK19;D:Merged; E:DAPI; F:ALB; G:Merged 图 3 mHPCs细胞免疫荧光鉴定结果(×200) |
2.4 免疫荧光染色检测结果
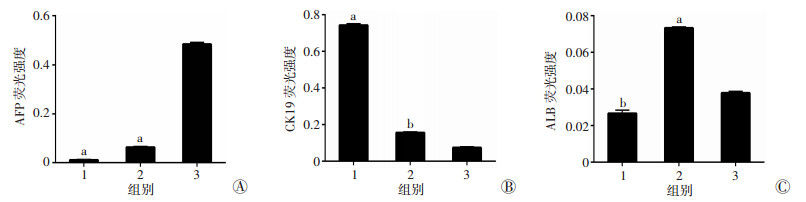
mHPCs与mHSCs共培养6 d后, mHPCs+mHSCs-TGF-β1组mHPCs胞质中大量表达胆管细胞标志物CK19, 而且AFP、ALB表达较其他两组明显少; 但mHPCs+mHSCs组和mHPCs组mHPCs中CK19表达较少, 而肝细胞标志物ALB和胚胎肝干细胞标志物AFP表达较多, 差异均有统计学意义(P < 0.05), 见图 4、5; 提示与TGF-β1激活的mHSCs共培养后, mHPCs有向胆管细胞方向分化的趋势。
|
| 图 4 免疫荧光法检测与mHSCs共培养6 d后AFP、ALB、CK19蛋白在mHPCs中的表达(×200) |
|
| A:AFP, B:CK19, C:ALB; 1:mHPCs+mHSCs-TGF-β1组, 2:mHPCs+mHSCs组, 3:mHPCs组; a:P < 0.01, b:P < 0.05, 与mHPCs组比较 图 5 与mHSCs共培养6 d后AFP、ALB、CK19蛋白在mHPCs中的相对表达量 |
2.5 mHPCs分化情况
RT-PCR检测与mHSCs共培养6 d后的mHPCs在体外分化情况:在mHPCs+mHSCs-TGF-β1组mHPCs中CK19、SOX9、Hes1等胆管细胞标志物mRNA表达量明显高于其他两组, 而AFP、ALB mRNA表达量明显低于其他两组; 在mHPCs+mHSCs组mHPCs中胆管细胞标志物和肝细胞标志物等量表达, 而在mHPCs组mHPCs中胚胎肝干细胞标志物AFP mRNA表达量最高, 差异均有统计学意义(P < 0.01), 见图 6。由结果可见, 与激活的mHSCs共培养后, mHPCs有向胆管细胞方向分化的趋势, 其机制可能通过TGF-β1激活mHSCs后分泌的Jagged1调节其下游信号分子SOX9、Hes1在mHPCs中的表达。
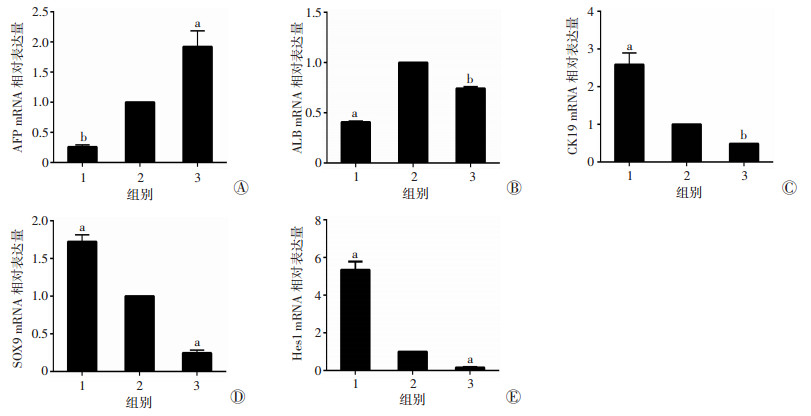
|
| A:AFP, B:ALB, C:CK19, D:SOX9, E:Hes1;1:mHPCs+mHSCs-TGF-β1组, 2:mHPCs+mHSCs组, 3:mHPCs组; a:P < 0.01, b:P < 0.05, 与mHPCs+mHSCs组比较 图 6 qRT-PCR检测各组mHPCs分化情况 |
3 讨论
胚胎肝前体细胞是一种具有双向分化潜能的细胞, 在一定条件下活化增殖并分化为肝细胞和胆管细胞参与肝脏再生[8]。研究证实胚胎肝前体细胞移植在动物实验中还没有出现过致癌的报道, 而且能够在体外扩增并维持其特异性形态和表型的稳定[9]。因此, 对于无法行肝移植治疗的终末期肝病患者而言, 体外诱导胚胎肝前体细胞产生大量的肝细胞及胆管细胞用于肝细胞移植是一个理想手段。但由于胚胎肝前体细胞在分离过程中, 其周围的间质细胞和细胞因子丧失导致长期存活及大量增殖困难[10]。
胚胎肝前体细胞的产生、增殖、分化等生物过程受其所处微环境的调控, 而肝星状细胞作为胚胎肝脏微环境中重要的组成部分在胚胎肝前体细胞的增殖、分化过程中起重要的作用。肝星状细胞与肝细胞和肝窦内皮细胞直接接触, 通过TGF-β1信号激活并转化为肌成纤维细胞产生大量的细胞外基质, 并分泌更多的细胞因子和生长因子, 参与肝纤维化、肝组织再生等病理生理过程[11-12]。
本实验中, 我们采用无血清饥饿培养mHSCs 24 h后加入TGF-β1处理48 h, 排除血清中少量TGF-β1对实验结果的影响。Notch信号通路参与细胞的存活、增殖和凋亡, 组织修复中枢神经系统的再生等病理生理过程, 其配体为Jagged1[13]。已有实验证明, TGF-β1信号通过Jagged1/Notch促进癌细胞溶骨性骨转移[14], 并且Jagged1/Notch对乙醛激活的HSCs中α-SMA的表达具有调节作用[15]。本课题组采用qRT-PCR、Western blot法验证mHSCs的激活情况。结果均显示, 激活组mHSCs中TGF-β1、TGF-β-R1、α-SMA及Jagged1表达均明显增加, 提示mHSCs已被成功激活, 其机制可能与TGF-β1信号调控Jagged1/Notch在mHSCs中表达有关。qRT-PCR结果显示, 激活组mHSCs中TGF-β1、HGF、VEGF等mRNA表达量均较对照组明显增加, 这可能是TGF-β1刺激HSC后通过正反馈旁分泌途径分泌更多TGF-β1及其他细胞因子, 共同参与生理病理状态下HSC的生物学效应。因此, 上述结果说明HSC被激活而且Jagged1/Notch可能作为TGF-β1信号下游的转录因子参与此过程。
我们在本实验中采用FACS分选的mHPCs与mHSCs Transwell共培养方式培养, 细胞荧光染色法证实了新分选的DLK1+ 细胞为未分化状态的mHPCs。在共培养的第6天, mHPCs+mHSCs-TGF-β1组mHPCs胞质中大量表达胆管细胞标志物, 而其他两组mHPCs胞质中AFP、ALB表达较多, 说明TGF-β1信号介导的mHSCs诱导mHPCs向胆管细胞分化。SOX9和Hes1是Jagged1/Notch信号通路下游重要的信号分子, 并且在胚胎胆管的形成发展中起重要作用[16-17]。qRT-PCR结果显示, mHPCs+mHSCs-TGF-β1组中不仅胆管细胞标志物CK19表达量明显增加, 而且Jagged1/Notch下游直接靶基因SOX9、Hes1的表达也明显增加; 而mHPCs+mHSCs组和mHPCs组中主要表达肝细胞或胚胎肝干细胞标志物。因此, 可见TGF-β1激活mHSCs后分泌更多细胞因子并通过旁分泌途径与mHPCs相互作用, 促进mHPCs向着胆管细胞方向分化, 其机制可能与TGF-β1激活mHSCs后分泌的Jagged1调节下游靶基因SOX9、Hes1在mHPCs中表达有关。
目前胚胎肝前体细胞分化的具体机制尚不清楚, 阐明其增殖和分化机制将有助于对肝干细胞的定向分化、增殖进行调控, 最终为胚胎肝干细胞在临床医学等方面的应用提供理论依据[18]。在本实验中mHPCs在与TGF-β1激活mHScs共培养条件下可向胆管细胞增殖分化, 为后续进一步研究胆管疾病、细胞治疗和药物筛选提供理想的细胞来源或模型。
| [1] | KAMIYA A, INAGAKI Y. Stem and progenitor cell systems in liver development and regeneration[J]. Hepatol Res, 2015, 45(1): 29–37. DOI:10.1111/hepr.12349 |
| [2] | SANCHO-BRU P, NAJIMI M, CARUSO M, et al. Stem and progenitor cells for liver repopulation:can we standardise the process from bench to bedside[J]. Gut, 2009, 58(4): 594–603. DOI:10.1136/gut.2008.171116 |
| [3] | PINTILIE D G, SHUPE T D, OH S H, et al. Hepatic stellate cells' involvement in progenitor-mediated liver regeneration[J]. Lab Invest, 2010, 90(8): 1199–1208. DOI:10.1038/labinvest.2010.88 |
| [4] | GORDILLO M, EVANS T, GOUON-EVANS V. Orchestrating liver development[J]. Development, 2015, 142(12): 2094–2108. DOI:10.1242/dev.114215 |
| [5] | SUZUKI K, TANAKA M, WATANABE N, et al. p75 neurotrophin receptor is a marker for precursors of stellate cells and portal fibroblasts in mouse fetal liver[J]. Gastroenterol, 2008, 135(1): 270–281.e3. DOI:10.1053/j.gastro.2008.03.075 |
| [6] | TANIMIZU N, SAITO H, MOSTOV K, et al. Long-term culture of hepatic progenitors derived from mouse Dlk+ hepatoblasts[J]. J Cell Sci, 2004, 117(Pt 26): 6425–6434. DOI:10.1242/jcs.01572 |
| [7] | WEIS S M, CHERESH D A. Tumor angiogenesis:molecular pathways and therapeutic targets[J]. Nature Med, 2011, 17(11): 1359–1370. DOI:10.1038/nm.2537 |
| [8] | FURUYAMA K, KAWAGUCHI Y, AKIYAMA H, et al. Continuous cell supply from a Sox9-expressing progenitor zone in adult liver, exocrine pancreas and intestine[J]. Nat Genet, 2010, 43(1): 34–41. DOI:10.1038/ng.722 |
| [9] | HABIBULLAH C M, SYED I H, QAMAR A, et al. Human fetal hepatocyte transplantation in patients with fulminant hepatic failure[J]. Transplantation, 1994, 58(8): 951–952. DOI:10.1097/00007890-199410270-00016 |
| [10] | ISHII T, YASUCHIKA K, MACHIMOTO T, et al. Transplantation of embryonic stem cell-derived endodermal cells into mice with induced lethal liver damage[J]. Stem Cells, 2007, 25(12): 3252–3260. DOI:10.1634/stemcells.2007-0199 |
| [11] | KALINICHENKO V V, BHATTACHARYYA D, ZHOU Y, et al. Foxf1 +/-mice exhibit defective stellate cell activation and abnormal liver regeneration following CCl4 injury[J]. Hepatology, 2003, 37(1): 107–117. DOI:10.1053/jhep.2003.50005 |
| [12] | LORENZINI S, BIRD T G, BOULTER L, et al. Characterisation of a stereotypical cellular and extracellular adult liver progenitor cell niche in rodents and diseased human liver[J]. Gut, 2010, 59(5): 645–654. DOI:10.1136/gut.2009.182345 |
| [13] | BAI S, KOPAN R, ZOU W, et al. NOTCH1 regulates osteoclastogenesis directly in osteoclast precursors and indirectly via osteoblast lineage cells[J]. J Biol Chem, 2008, 283(10): 6509–6518. DOI:10.1074/jbc.M707000200 |
| [14] | HU K F, KONG X Y, ZHONG M C, et al. Brucine inhibits bone metastasis of breast cancer cells by suppressing Jagged1/Notch1 signaling pathways[J]. Chin J Integr Med, 2017, 23(2): 110–116. DOI:10.1007/s11655-016-2647-2 |
| [15] |
肖斌, 陈川宁, 陶忠桦, 等. Notch通路对乙醛激活大鼠肝星状细胞株的增殖及转分化的影响[J].
中国老年学杂志, 2014, 34(3): 710–713.
XIAO B, CHEN C N, TAO Z H, et al. The role of notch pathway in hepatic stellate cell strain[J]. Chin J Gerontol, 2014, 34(3): 710–713. |
| [16] | ANTONIOU A, RAYNAUD P, CORDI S, et al. Intrahepatic bile ducts develop according to a new mode of tubulogenesis regulated by the transcription factor SOX9[J]. Gastroenterology, 2009, 136(7): 2325–2333. DOI:10.1053/j.gastro.2009.02.051 |
| [17] | KOBAYASHI T, MIZUNO H, IMAYOSHI I, et al. The cyclic gene Hes1 contributes to diverse differentiation responses of embryonic stem cells[J]. Gene Develop, 2009, 23(16): 1870–1875. DOI:10.1101/gad.1823109 |
| [18] | KAKINUMA S, NAKAUCHI H, WATANABE M. Hepatic stem/progenitor cells and stem-cell transplantation for the treatment of liver disease[J]. J Gastroenterol, 2009, 44(3): 167–172. DOI:10.1007/s00535-008-2297-z |



