2. 400016 重庆,重庆医科大学基础医学院:生物信息学教研室;
3. 400016 重庆,重庆医科大学基础医学院:实验教学中心
2. Department of Bioinformatics, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China;
3. Experimental Teaching Center, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
糖尿病肾病(diabetic nephropathy,DN)是糖尿病严重的并发症之一,约占糖尿病发病人数的1/3,给人类健康带来极大的威胁[1]。研究表明,高糖、高脂、高血压、血流动力学、氧化应激、炎症等多方面复杂的致病因素导致糖尿病患者肾脏细胞外基质累积、肾小球肥大、肾小球基底增厚和肾小球硬化,并参与DN的发生、发展,但其确切机制尚不清楚[2-3]。近年来学者们提出的“微炎症”学说认为DN是一种低度炎症和自然免疫性疾病[4],其具体机制值得进一步研究。长链非编码RNA(long non-coding RNA, lncRNA)是一类长度大于200 nt的非编码RNA,参与复杂而精确基因调控网络,与多种疾病的炎症发生相关。本课题组前期实验发现,lncRNA Gm4419在高糖培养的小鼠肾小球系膜细胞(mesangial cells, MCs)中异常高表达,且对MCs的增殖及纤维化具有明显的促进作用[5],提示其在DN MCs病理生理过程中发挥作用,但其在MCs炎症过程中的作用有待进一步研究。
为探索Gm4419在DN炎症发生过程中的作用及机制,本研究应用Gm4419小干扰RNA(siRNA)及构建的Gm4419过表达质粒转染于高、低糖培养的MCs中,观察炎症相关因子单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)及肿瘤坏死因子-α (tumor necrosis factor α,TNF-α)的表达情况,采用生物信息技术分析Gm4419与核转录因子-kappa B (nuclear factor-kappa B,NF-κB)亚基p50及p65的关系,检测过表达或沉默Gm4419后对p50及p65表达及入核活化的影响,探索Gm4419对DN炎症的影响及机制,旨在为疾病的发生机制阐明提供新的思路。
1 材料与方法 1.1 主要材料与试剂肾小球MCs SV40-MES13细胞株(中国科学院细胞库);高、低糖DMEM液体培养基(美国HyClone公司);LipofectamineTM2000、pcDNA3.1(+)表达载体、无血清培养基Opti-MEM®、TRIzol、PCR引物(美国Invitrogen公司);Gm4419 siRNA、siRNA NC、澳洲特级胎牛血清(上海生工生物工程股份有限公司);SYBR® Premix Ex TaqTM Ⅱ(大连宝生物工程有限公司);Western blot及IP细胞裂解液、BCA蛋白定量试剂盒、兔抗鼠组蛋白H3、DAPI(上海碧云天生物技术有限公司);PVDF膜、ECL化学发光检测试剂盒(美国Millipore公司);辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);兔抗鼠p65、兔抗鼠p50、兔抗鼠MCP-1(美国Abcam公司);PARISTM试剂盒(美国Life Technologies公司);SN50(NF-κB p50特异性抑制剂,瑞士Enzo公司)。
1.2 方法 1.2.1 细胞培养和转染小鼠肾小球MCs培养于DMEM培养基中,内含10%灭活胎牛血清,置于37 ℃、5%CO2浓度的培养箱中培养,待细胞融合度达到80%时,0.25%胰蛋白酶消化细胞,800 r/min离心5 min,收集细胞进行传代或冻存。将细胞分别以含5.5 mmol/L+19.5 mmol/L甘露醇的DMEM培养基模拟正常生理状态(低糖组,即L-MC组);以25 mmol/L葡萄糖的DMEM培养基模拟糖尿病高糖状态(高糖组,即H-MC组)。取对数生长期的MCs,以每孔5.5× 105个细胞接种于6孔板,每组设3个平行孔,按脂质体Lipofectamine 2000转染试剂操作手册进行转染,将Gm4419 siRNA及其对照组分别转染到高糖培养的MCs(即H-MC siGm4419组、H-MC siNC组),将pcDNA-3.1(+)-Gm4419及空质粒分别转染到低糖培养的MCs中[即L-MC Gm4419(+)组、L-MC pcDNA-3.1组],转染后4~6 h更换新鲜培养基,24~48 h后收获细胞,RT-qPCR检测转染效率或进行后续实验。
1.2.2 RT-qPCR检测Gm4419、MCP-1、TNF-α、p50和p65 mRNA表达水平按TRIzol试剂说明书步骤提取MCs总RNA。按PARISTM试剂盒说明书提取细胞核及细胞质RNA。用酶标仪检测RNA的浓度和纯度。RNA反转录反应体系按反转录试剂盒说明书进行,经37 ℃ 15 min,85 ℃ 5 s,反转录合成cDNA。利用Primer Premier 5.0软件设计小鼠Gm4419、MCP-1、TNF-α、p50和p65引物, 进一步使用在线软件BLAST分析引物特异性,并由美国Invitrogen公司合成。Gm4419(885 bp)上游引物:5′-GGAACCAAGCAGACCGAAGAC-3′,下游引物:5′-CCCCAACCCACAGGAACATAA-3′;MCP-1(117 bp)上游引物: 5′-GACCCGTAAATCTGAAGCTAATGC-3′,下游引物: 5′-AATTAAGGCATCACAGTCCGAGTC-3′;TNF-α(109 bp)上游引物: 5′-CCCTCCTGGCCAACGGCATG-3′,下游引物: 5′-TCGGGGCAGCCTTGTCCCTT-3′;p65(123 bp)上游引物: 5′-GACCTGGAGCAAGCCATTAG-3′,下游引物: 5′-CACTGTCACCTGGAAGCAGA-3′;p50(103 bp)上游引物:5′-CAGGTCCACTGTCTGCCTCT-3′,下游引物: 5′-GGAAGGATGTCTCCACACCA-3′;β-actin(154 bp)上游引物: 5′-GGCTGTATTCCCCTCCATCG-3′,下游引物: 5′-CCAGTTGGTAACAATGCCATGT-3′。
以反转录产物cDNA为模板对上述基因的编码区扩增,反应体系为:10 μL SYBR Premix Ex Taq,0.5 μL PCR上游引物,0.5 μL PCR下游引物,2 μL cDNA,7 μL灭菌蒸馏水。将混合均匀的反应液于CFX96TM Real-time PCR仪完成反应,每个检测指标设3个平行复孔。反应条件为95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,进行40个循环;最后以β-actin为内参利用公式2-△△Ct计算获得最终结果。
1.2.3 Western blot检测p50和p65表达情况收集转染48 h后的MCs,离心沉淀后按100:1的比例加入RIPA裂解液和PMSF冰上裂解30 min,期间每间隔5 min漩涡振荡15 s,15 000 r/min离心30 min,收集上清液。BCA法测定蛋白质浓度。按1:5的比例混合SDS-PAGE蛋白上样缓冲液和上清液,100 ℃,10 min蛋白变性。SDS-PAGE后,转膜,分别加入兔抗鼠p50抗体(1:500稀释)、兔抗鼠p65抗体(1:500稀释)、兔抗鼠MCP-1抗体(1:500稀释)、兔抗鼠组蛋白抗体(1:500稀释)和兔抗鼠GAPDH抗体(1:1 000稀释),4 ℃过夜,TBST洗PVDF膜3次后,加入辣根酶标记山羊抗兔lgG(1:8 000稀释),室温摇床孵育2 h,ECL显色,以GAPDH、组蛋白H3作为内参。CM-2000B型生物医学成像系统(北航)进行灰度分析。
1.2.4 免疫荧光法检测MCP-1、TNF-α蛋白表达水平细胞爬片转染48 h后收集细胞,甲醛固定30 min,山羊血清封闭1 h, 一抗MCP-1(1:50稀释)、TNF-α抗体(1:50稀释)4 ℃过夜,二抗孵育1 h后进行DAPI染色,封片后于激光共聚焦显微镜下进行荧光检测,LAS AF Lite软件分析摄取图片。
1.2.5 生物信息学技术预测NF-κB亚基p50、p65与Gm4419启动子的结合情况应用Ensembl (http://asia.ensembl.org/index.html)数据库查找Gm4419启动子区域序列;对JASPAR (http://jaspar.genereg.net/)、TRAP (http://trap.molgen.mpg.de/cgi-bin/trap_two_seq_form.cgi)、rVista (http://www.rcista.dcode.org)和TFSEARCH (http://www.cbrc.jp/research/db/TFSEARCH.html)进行NF-κB亚基p65和p50与Gm4419启动子序列的结合位点预测。
1.3 统计学分析采用SPSS 20.0统计软件,数据以x±s表示,多组比较采用单因素方差分析,两组比较采用t检验。检验水准:α=0.05。
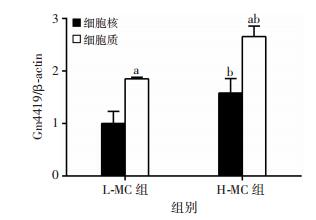
2 结果 2.1 Gm4419在高糖培养的MCs中的表达及分布采用RT-qPCR检测高、低糖培养细胞Gm4419的表达水平。结果显示,H-MC组Gm4419的表达水平显著高于L-MC组(P < 0.05,图 1)。同时,Gm4419在MCs的亚细胞分布呈现核、质中均有分布,但主要位于细胞质(P < 0.05,图 1)。
|
| a: P < 0.05,与同组细胞核比较;b:P < 0.05,与L-MC组比较 图 1 高、低糖肾小球MCs中Gm4419亚细胞分布 |
2.2 高糖条件下Gm4419促进MCs炎症因子的表达
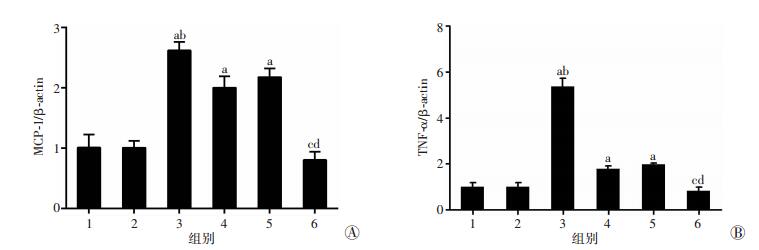
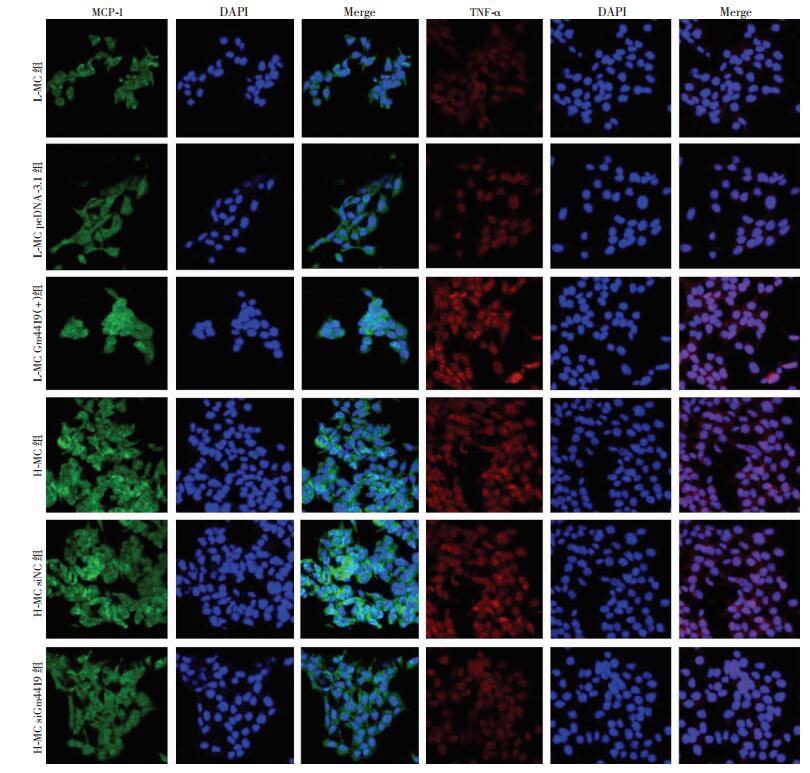
RT-qPCR检测上、下调Gm4419后对炎症相关因子MCP-1和TNF-α表达的影响。结果显示,MCs中过表达Gm4419后MCP-1和TNF-1表达水平显著升高(P < 0.01);而沉默Gm4419后MCP-1和TNF-α表达水平均显著降低(P < 0.01,图 2),提示Gm4419可影响MCs炎症因子表达水平。同时,采用免疫荧光法检测上、下调Gm4419后MCP-1、TNF-α表达情况,结果与RT-qPCR检测结果相一致(图 3)。以上结果均提示Gm4419对MCs炎症因子表达具有调控作用,参与DN炎症。
|
|
1:L-MC组;2:L-MC pcDNA-3.1组;3:L-MC Gm4419(+)组;4:H-MC组;5:H-MC siNC组;6:H-MC siGm4419组 a:P < 0.01,与L-MC组比较;b:P < 0.01,与L-MC pcDNA-3.1组比较;c:P < 0.01,与H-MC组比较;d:P < 0.01,与H-MC siNC组比较 图 2 RT-qPCR检测高、低糖肾小球系膜中Gm4419对MCP-1(A)、TNF-α(B)mRNA表达的影响 |
|
| 图 3 高、低糖肾小球MCs中Gm4419对MCP-1、TNF-α蛋白表达的影响(荧光显微镜×400) |
2.3 Gm4419在高糖条件下调控MCsNF-κB信号通路的活化
采用生物信息学方法寻找与Gm4419相关的转录因子,结果显示Gm4419与NF-κB 2个亚单位p50和p65均存在预测结合位点(p50:-488~-478 bp;p65:-487~-478 bp)。这提示Gm4419与NF-κB可能存在着某种联系,NF-κB通路可能是Gm4419参与DN炎症的重要途径。
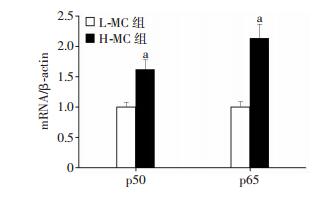
进一步采用RT-qPCR检测p50和p65在高、低糖培养的MCs中的表达情况,结果显示H-MC组中p50和p65表达水平明显高于L-MC组(P < 0.01,图 4),说明NF-κB信号通路在DN中扮演重要角色。同时,由于NF-κB通路的激活过程伴随着p50和p65的入核现象,采用Western blot检测在高、低糖MCs中上、下调Gm4419后细胞核p50和p65蛋白表达水平。结果显示H-MC siGm4419组中p50和p65核蛋白表达水平较H-MC组及H-MC siNC组显著增加(P < 0.01)。同时,L-MC Gm4419(+)组p50和p65核蛋白表达水平较L-MC组和L-MC pcDNA3.1组显著降低(P < 0.01,图 5),表明Gm4419可增加NF-κB p50和p65核内表达。以上结果提示Gm4419可促进MCs p50和p65入核,从而活化NF-κB通路。
|
| a: P < 0.01,与L-MC组比较 图 4 RT-qPCR检测高、低糖肾小球MCs中NF-κB亚基p50和p65的表达水平 |
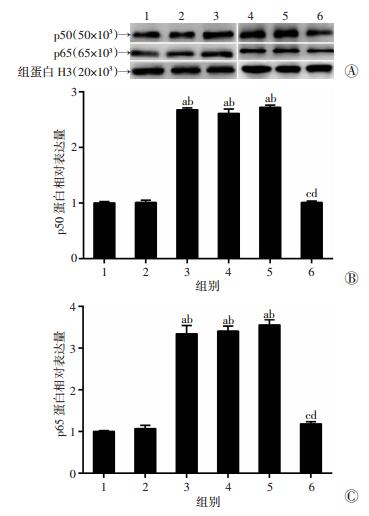
|
|
1:L-MC组;2:L-MC pcDNA-3.1组;3:L-MC Gm4419(+)组;4:H-MC组;5:H-MC siNC组;6:H-MC siGm4419组 A:Western blot检测结果;B、C:分别为p50、p65蛋白半定量分析结果a:P < 0.01,与L-MC组比较;b:P < 0.01,与L-MC pcDNA-3.1组比较;c:P < 0.01,与H-MC组比较;d:P < 0.01,与H-MC siNC组比较 图 5 肾小球MCs中上、下调Gm4419对p50和p65细胞核内表达的影响 |
2.4 抑制p50活性可阻断Gm4419促进MCs炎症因子的表达
为探索NF-κB与Gm4419对DN炎症相关因子表达的影响,我们采用NF-κB p50特异性抑制剂SN50,通过Western blot检测MCs中抑制p50前后过表达Gm4419对炎症相关因子MCP-1表达水平的影响。结果显示,过表达Gm4419促进MCs MCP-1的表达,但特异性抑制p50后过表达Gm4419则不能影响MCP-1的表达(图 6)。
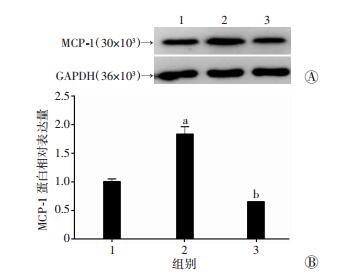
|
|
1:L-MC组;2:L-MC Gm4419(+)组;3:L-MC Gm4419(+)+SN50组 A:Western blot检测结果;B:半定量分析结果a:P < 0.01,与L-MC组比较;b:P < 0.01,与L-MC Gm4419(+)组比较 图 6 特异性抑制p50对MCs Gm4419促进炎症相关因子表达的影响 |
3 讨论
近年来,炎症在DN的发病机制中越来越得到学者的关注。DN患者存在炎细胞浸润和多种炎症介质表达水平增高,此慢性炎症状态在糖尿病早期肾病发展中发挥重要作用,且DN的进展与长期的微炎症状态和免疫系统的活化亦密切相关[6]。在DN肾脏固有细胞的炎细胞浸润中巨噬细胞、中性粒细胞、肥大细胞等均参与其中。近年越来越多的证据还表明炎症相关因子在DN中具有重要的作用,包括白介素类(interleukin, IL)、黏附因子、趋化因子、TNF-α等[7]。研究发现,MCP-1作为经典的趋化因子之一,通过募集众多炎性细胞至肾脏局部,加剧肾脏的炎性反应损伤过程[8];TNF-α诱导细胞凋亡,同时通过细胞毒作用对肾脏产生直接损伤作用,它们是导致DN炎症的重要指标[9]。同时本课题组前期研究也发现在高糖培养的MCs以及糖尿病肾病模型小鼠db/db肾脏组织中炎症相关因子TNF-α、IL-18、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)以及髓样分化因子88(myeloid differentiation factor 88,MYD88)呈异常增高,其机制涉及微小RNA调控的NF-κB信号通路[10]。因此,炎症因子的异常表达在DN的发生、发展中扮演了重要角色。然而,在DN中炎症涉及机制十分复杂,其具体机制有待进一步研究。
lncRNA作为复杂调控网络的新成员,近年来逐步成为研究热点,在胃癌[11]、肺癌[12]、急性巨核白血病[13]等多种疾病的发生、发展中均扮演着重要的角色。lncRNA的异常表达与DN的发生、发展密切相关,HU等[14]研究发现lncRNA MALAT1可通过与β链蛋白相互作用参与肾足细胞的损伤;LONG等[15]研究发现lncRNA Tug1与DN线粒体的调节过程密切相关;本课题组前期发现高糖环境下lncRNA-Gm4419对MCs的增殖及纤维化具有明显的促进作用[5]。不仅如此,lncRNA还作为重要的炎症调节因子参与急性心肌梗死[16]、多发性硬化症[17]等疾病的发生、发展。由此,lncRNA可能在DN炎症过程中扮演重要角色。
本研究采用RT-qPCR检测高、低糖培养的MCs中Gm4419的表达,结果显示Gm4419在高糖组细胞中显著高于低糖组。进一步采用过表达质粒和siRNA在MCs上、下调Gm4419的表达,探索Gm4419在DN炎症中的作用。结果显示,在高糖组炎症相关因子MCP-1和TNF-α表达水平较低糖组显著增高。有趣的是,在高糖组沉默Gm4419后,其表达水平显著降低;反之,在低糖组中过表达Gm4419后,MCP-1、TNF-α表达水平则显著增高(P < 0.01)。由此提示,Gm4419可能是一个DN炎症过程的重要因子,可调节炎症相关因子的表达水平。
由于lncRNA的亚细胞定位不同,其发挥的作用也不同。分布于胞质的lncRNA主要参与竞争性内源RNA(competing endogenous RNAs, ceRNA)过程以及与蛋白形成复合物参与基因调控等;若位于胞核,则主要参与染色体重塑、转录等过程[18-19]。本研究结果显示,Gm4419在MCs的核质均有表达,但主要分布于细胞质中,提示Gm4419可能主要发挥基因调控作用,为Gm4419的后续研究提供了依据。
为探索Gm4419参与DN炎症发生的具体机制,我们采用生物信息学方法分析Gm4419与已知转录因子的相互关系,其中NF-κB引起我们的关注。结果发现,NF-κB两个亚基p50和p65均与Gm4419有结合关系。同时NF-κB作为DN炎症发生的关键环节[20],课题组前期已经证明NF-κB参与MCs炎症的发生[10]。由此提示,Gm4419可能通过与NF-κB通路的相互作用参与DN炎症过程。NF-κB作为Rel蛋白家族的转录因子,在哺乳动物中包括p50(NF-κB1)、p65(RelA)、p52(NF-κB2)、RelB及c-Rel 5个亚基,这些亚基均有Rel同源区,能够形成异源或同源二聚体,参与炎症反应、机体免疫、细胞分化等过程,其中p50及p65所构成的二聚体是NF-κB最早被发现且存在最广的结构类型。本研究发现在高糖环境下,肾小球MCs中NF-κB亚基p50、p65显著升高,提示NF-κB与DN相关。研究表明,细胞质中的NF-κB受其抑制蛋白IκB抑制,当IκB被蛋白酶体降解后,活化的NF-κB进入细胞核发挥转录因子的作用,NF-κB入核是其活化的重要标志[21]。本研究Western blot检测结果显示,过表达Gm4419后,p50和p65在细胞核中表达水平显著增高;反之,沉默Gm4419后,p50及p65在细胞核中的表达水平显著下降,提示Gm4419可促进p50和p65的入核,导致NF-κB信号通路的活化。同时,应用NF-κB特异性抑制剂SN50可阻断Gm4419促进炎症相关因子MCP-1表达增加的作用,说明Gm4419通过NF-κB通路影响DN炎症因子表达。
综上所述,高、低糖培养的MCs中Gm4419可调节DN炎症过程,其机制可能是Gm4419促进NF-κB亚基p50和p65入核,活化NF-κB通路,激活炎症相关因子表达。因此,通过针对Gm4419及其靶点药物的研究,可能成为治疗DN的新思路。然而,lncRNA对DN的影响及其机制十分复杂,涉及RNA之间、RNA与蛋白之间众多复杂网络调控等,lnRNA Gm4419与NF-κB通路的具体内在关系如何,孰因孰果,尚需进一步研究。
| [1] | ATKINS R C, ZIMMET P. Diabetic kidney disease: act now or pay later[J]. Kidney Blood Press Res, 2010, 33(1): 48–51. DOI:10.1159/000285849 |
| [2] | KOLSET S O, REINHOLT F P, JENSSSEN T. Diabetic nephropathy and extracellular matrix[J]. J Histochem Cytochem, 2012, 60(12): 976–986. DOI:10.1369/0022155412465073 |
| [3] | MASON R M, WAHAB N A. Extracellular matrix metabolism in diabetic nephropathy[J]. J Am Soc Nephrol, 2003, 14(5): 1358–1373. DOI:10.1097/01.asn.0000065640.77499.d7 |
| [4] | NAVARRO-GONZÁLEZ J F, MORA-FERNÁNDEZ C, MUROS DE FUENTES M, et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J]. Nat Rev Nephrol, 2011, 7(6): 327–340. DOI:10.1038/nrneph.2011.51 |
| [5] |
易红, 彭睿, 孙艳, 等. lncRNA-Gm4419对高糖培养的肾小球系膜细胞增殖和纤维化的影响[J].
第三军医大学学报, 2017, 39(3): 216–222.
YI H, PENG R, SUN Y, et al. Effect of lncRNA-Gm4419 on proliferation and fibrosis in high glucose-inducedglomerulus mesangial cells[J]. J Third Mil Med Univ, 2017, 39(3): 216–222. DOI:10.16016/j.1000-5404.201608102 |
| [6] | SUN Y M, SU Y, LI J, et al. Recent advances in understanding the biochemical and molecular mechanism of diabetic nephropathy[J]. Biochem Biophys Res Commun, 2013, 433(4): 359–361. DOI:10.1016/j.bbrc.2013.02.120 |
| [7] | PICHLER R, AFKARIAN M, DIETER B P, et al. Immunity and inflammation in diabetic kidney disease: translating mechanisms to biomarkers and treatment targets[J]. Am J Physiol Renal Physiol, 2017, 312(4): F716–F731. DOI:10.1152/ajprenal.00314.2016 |
| [8] | HALLER H, BERTRAM A, NADROWITZ F, et al. Monocyte chemoattractant protein-1 and the kidney[J]. Curr Opin Nephrol Hypertens, 2016, 25(1): 42–49. DOI:10.1097/MNH.0000000000000186 |
| [9] | DURAN-SALGADO M B, RUBIO-GUERRA A F. Diabetic nephropathy and inflammation[J]. World J Diabetes, 2014, 5(3): 393–398. DOI:10.4239/wjd.v5.i3.393 |
| [10] | SUN Y, PENG R, PENG H, et al. miR-451 suppresses the NF-kappaB-mediated proinflammatory molecules expression through inhibiting LMP7 in diabetic nephropathy[J]. Mol Cell Endocrinol, 2016, 433: 75–86. DOI:10.1016/j.mce.2016.06.004 |
| [11] | ZHANG E B, KONG R, YIN D D, et al. Long noncoding RNA ANRIL indicates a poor prognosis of gastric cancer and promotes tumor growth by epigenetically silencing of miR-99a/miR-449a[J]. Oncotarget, 2014, 5(8): 2276–2292. DOI:10.18632/oncotarget.1902 |
| [12] | YOU J, ZHANG Y, LIU B, et al. MicroRNA-449a inhibits cell growth in lung cancer and regulates long noncoding RNA nuclear enriched abundant transcript 1[J]. Indian J Cancer, 2014, 51(Suppl 3): e77–e81. DOI:10.4103/0019-509X.154055 |
| [13] | EMMRICH S, STRELTSOV A, SCHMIDT F, et al. LincRNAs MONC and MIR100HG act as oncogenes in acute megakaryoblastic leukemia[J]. Mol Cancer, 2014, 13: 171. DOI:10.1186/1476-4598-13-171 |
| [14] | HU M, WANG R, LI X, et al. LncRNA MALAT1 is dysregulated in diabetic nephropathy and involved in high glucose-induced podocyte injury via its interplay with β-catenin[J]. J Cell Mol Med, 2017, 21(11): 2732–2747. DOI:10.1111/jcmm.13189 |
| [15] | LONG J, BADAL S S, YE Z, et al. Long noncoding RNA Tug1 regulates mitochondrial bioenergetics in diabetic nephropathy[J]. J Clin Invest, 2016, 126(11): 4205–4218. DOI:10.1172/JCI87927 |
| [16] | LI X, ZHOU J, HUANG K. Inhibition of the lncRNA mirt1 attenuates acute myocardial infarction by suppressing NF-κB activation[J]. Cell Physiol Biochem, 2017, 42(3): 1153–1164. DOI:10.1159/000478870 |
| [17] | SUN D, YU Z, FANG X, et al. LncRNA GAS5 inhibits microglial M2 polarization and exacerbates demyelination[J]. EMBO Rep, 2017, 18(10): 1801–1816. DOI:10.15252/embr.201643668 |
| [18] | TSAI M C, MANOR O, WAN Y, et al. Long noncoding RNA as modular scaffold of histone modification complexes[J]. Science, 2010, 329(5992): 689–693. DOI:10.1126/science.1192002 |
| [19] | MARTIANOV I, RAMADASS A, SERRA BARROS A, et al. Repression of the human dihydrofolate reductase gene by a non-coding interfering transcript[J]. Nature, 2007, 445(7128): 666–670. DOI:10.1038/nature05519 |
| [20] | BAKER R G, HAYDEN M S, GHOSH S. NF-κB, inflammation, and metabolic disease[J]. Cell Metab, 2011, 13(1): 11–22. DOI:10.1016/j.cmet.2010.12.008 |
| [21] | WANG S, YANG Z, XIONG F, et al. Betulinic acid ameliorates experimental diabetic-induced renal inflammation and fibrosis via inhibiting the activation of NF-κB signaling pathway[J]. Mol Cell Endocrinol, 2016, 434: 135–143. DOI:10.1016/j.mce.2016.06.019 |



