目前国际输血协会命名的血型系统有36个,而继Landsteiner发现ABO血型以来,ABO血型系统一直是所有血型系统中对移植医学最为重要的血型系统。ABO血型相同或相容对于血液制品输注疗效及器官移植存活率起着至关重要的作用。然而,由于目前临床血液制品及器官供体严重缺乏,部分相容性,甚至不相容性血液制品输注及器官移植的情况不可避免。对于部分相容性或不相容性血液制品的输注,由于人体循环血流的稀释作用,加之血浆中存在的血型物质的中和作用,一般发生严重溶血反应的病例较少[1-3],但几乎所有的病例都存在高浓度的ABO血型抗体[1-2]。因此,建立快速而准确的ABO抗体定量检测方法尤为重要。
对于ABO血型抗体的检测,各临床实验室普遍采用的方式为试管法或者凝胶微柱法检测效价,该法简便易行。然而,由于该法受操作者主观因素影响较大,且行业尚无统一的标准化要求,各实验室间的结果可比性差。KOBAYASHI等[4]通过大样本实验观察到同一样本以试管法/凝胶微柱法在不同实验室间检测抗体效价,结果差别极大,IgM抗体检测结果最高可相差32倍,IgG抗体检测结果最高可相差256倍。因此,ABO血型抗体效价检测的准确性及临床应用效果备受质疑。本研究采用A型红细胞膜蛋白作为捕获抗原,构建间接酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)检测方法,定量检测人血IgM型抗-A抗体浓度。
1 材料与方法 1.1 主要试剂抗-A单克隆抗体及抗-B单克隆抗体由江阴力博生物技术有限公司赠予;BCA法蛋白浓度检测试剂盒购于南京建成生物工程研究所;新生牛血清购于浙江天杭生物科技股份有限公司;HRP羊抗人IgM二抗购于美国Jackson ImmunoResearch公司;TMB显色液购于上海阿拉丁生化科技股份有限公司;人免疫球蛋白M(IgM)抗原购于上海羽朵生物科技有限公司;96孔酶标板购于美国Costar公司;低渗液:10 mmol/L Tris-HCl(pH 7.4);复性缓冲液:0.05 mol/L Tris-HCl(pH 8.5), 0.001 mol/L EDTA, 0.001 mol/L GSH, 0.000 1 mol/L GSSH,0.5 mol/L Arg, 0.15 mol/L NaCl。
1.2 临床标本EDTA-K2抗凝全血标本来自重庆某血站健康献血员。收集抗-A抗体阳性的B型血浆标本57例,抗-A抗体阴性的AB型血浆标本12例,于-20 ℃保存备用。
1.3 方法 1.3.1 A型红细胞抗原的制备采用A型红细胞制备膜蛋白用作包被抗原。取10 mL EDTA-K2抗凝的A型全血,3 000 r/min离心20 min,吸尽血浆及白膜层,将红细胞层采用4 ℃ PBS溶液洗涤3次。向压积红细胞中加入40倍体积预冷的低渗液,轻微搅拌后,4 ℃放置2 h,至完全溶血。以9 000 r/min,4 ℃离心20 min,弃去上清液,沉淀采用预冷PBS溶液洗涤数次,直至获得乳白色血影[5]。称取血影沉淀的质量,在1 g血影沉淀中逐滴加入10 mL 2 mol/L尿素PBS溶液,磁力搅拌3 h,待血影完全溶解后,按1:1体积比加入复性缓冲液,装入透析袋,进行PBS缓冲液透析平衡。然后,小份分装,-80 ℃保存备用。
1.3.2 制备抗原免疫反应活性的鉴定采用改良红细胞凝集抑制实验对自提膜蛋白的A抗原免疫反应活性进行验证。将25 μL血型A抗原系列倍比稀释为4组,分别加入等体积最佳稀释度的抗-A单克隆抗体(1:4稀释)、抗-B单克隆抗体(1:4稀释)、A型血浆、B型血浆,4 ℃中和反应1 h,对照孔采用等体积PBS代替血型A抗原。各组分别加入25 μL 0.75%抗体相应血型红细胞,板式专用离心机离心,1 250 r/min强震荡60 s,650 r/min弱震荡30 s后,观察凝集抑制情况。
1.3.3 间接ELISA反应条件的优化按照棋盘滴定实验[6]确定抗原及血浆的最佳工作浓度。采用包板稀释液将血型A抗原从2 mg/mL浓度起进行倍比稀释,分别加入到96孔酶标板第1~11列,第12列为空白对照。每孔100 μL,4 ℃包被过夜。0.1%PBST洗涤3次,轻柔拍干,每孔加入300 μL新生牛血清,37 ℃封闭3 h。同前洗涤3次,轻柔拍干。采用抗体稀释液将阴、阳性血浆从1:10起倍比稀释,分别加入到96孔板的第A~G行,第H行为空白对照,每孔100 μL,37 ℃孵育1 h。同前洗涤6次,将HRP标记羊抗人IgM二抗1:8 000稀释后,每孔加入100 μL,37 ℃反应1 h。同前洗涤8次,加入TMB底物溶液,每孔100 μL,室温避光显色5 min,2 mol/L硫酸每孔50 μL终止反应后,酶标仪检测450 nm波长处光密度值[D(450)]。
1.3.4 间接ELISA标准曲线及检测下限的测定采用人IgM作为标准品[7]构建标准曲线,浓度范围为0.01~25.00 μg/mL。采用ELISA Calc 2.0软件Logistic四参数拟合模型构建标准曲线。检测一组阴性标本(n=10),以(x±2s)值作为最低检测限[8-9]。
1.3.5 间接ELISA灵敏度、特异性及重复性的检测将抗-A抗体阳性的B型及抗-A抗体阴性的AB型血浆标本按1.3.3反应条件优化后最适比稀释,采用该ELISA体系检测D(450),绘制受试者工作特征曲线(receiver operating characteristic curve, ROC)确定检测临界值,分析检测灵敏度及特异性。将阳性血浆标本在同一批次实验中检测10次,计算批内变异系数;连续检测3个批次计算批间变异系数,批内及批间变异系数应小于10%。
1.3.6 人血IgM型抗-A抗体效价测定对于B型血浆标本严格按照《全国临床检验操作规程》(第4版)[10]要求进行IgM型抗-A抗体效价测定。
1.3.7 人血IgM型抗-A抗体检测方法的临床验证将B型血浆标本采用自建间接ELISA测定IgM抗-A抗体浓度,将所得结果与IgM型抗-A抗体效价评分进行相关性分析。
1.4 统计学分析采用SPSS 22.0统计软件绘制ROC曲线,对自检ELISA方法检测临界值、曲线下面积(area under curve,AUC)、灵敏度、特异性进行评估;并对自建间接ELISA方法及金标试管法的人血IgM型抗-A抗体检测结果进行相关性分析。
2 结果 2.1 A型红细胞抗原的鉴定经改良HI实验,本课题所制备的A型膜蛋白能特异性中和单克隆抗-A抗体及多克隆抗-A抗体,血凝抑制价分别为2和6;而对于阴性对照组的抗-B抗体无中和作用(表 1)。即该蛋白具有与抗-A抗体特异的免疫反应性。BCA法测定A型膜蛋白浓度为2 mg/mL。
| 血型A抗原 | 1:1 | 1:2 | 1:4 | 1:8 | 1:16 | 1:32 | 1:64 | 1:128 | 1:256 | 对照孔 |
| 单克隆抗-A抗体+AC | 0 | 0 | ± | 1+ | 1+ | 1+ | 2+ | 2+ | 3+ | 3+ |
| 多克隆抗-A抗体+AC | 0 | 0 | 0 | 0 | 0 | 0 | ± | 1+ | 2+ | 2+ |
| 单克隆抗-B抗体+BC | 3+ | 3+ | 3+ | 3+ | 3+ | 3+ | 3+ | 3+ | 3+ | 3+ |
| 多克隆抗-B抗体+BC | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ |
2.2 间接ELISA最佳反应条件及方法学评价 2.2.1 条件优化
棋盘滴定实验结果显示,当包板抗原浓度为2 mg/mL,待检血浆标本1:10倍稀释时,阳性血浆D(450)为0.8,P/N值最大为4.5,因此确定包被抗原最佳反应浓度为2 mg/mL,待检血浆最佳稀释比例为1:10(表 2)。
| 血浆稀释度 | 2.00 mg/mL | 1.00 mg/mL | 0.50 mg/mL | 0.25 mg/mL | 0.13 mg/mL | 0.06 mg/mL | 0.03 mg/mL | 0.02 mg/mL |
| 1:5 | 3.97 | 3.82 | 2.92 | 2.66 | 2.37 | 2.56 | 2.11 | 2.47 |
| 1:10 | 4.46 | 3.39 | 2.51 | 2.67 | 2.36 | 2.30 | 1.86 | 2.11 |
| 1:20 | 4.07 | 2.84 | 2.45 | 2.30 | 2.27 | 2.16 | 1.78 | 1.93 |
| 1:40 | 2.52 | 1.29 | 1.33 | 1.39 | 1.28 | 1.28 | 1.25 | 1.40 |
| 1:80 | 2.12 | 1.62 | 1.56 | 1.50 | 1.49 | 1.43 | 1.26 | 1.31 |
| P:阳性血浆D(450);N:阴性血浆D(450) | ||||||||
2.2.2 标准曲线及检测下限
以人IgM标准品浓度为X值,D(450)为Y值,采ELISA Calc2.0软件进行Logistic四参数曲线拟合,构建标准曲线并计算抗体浓度(图 1)。以该体系检测10个阴性标本(AB型血浆),测得最低检测限为0.02 μg/mL。经过曲线参数计算,人血IgM抗-A抗体在0.04~3.00 μg/mL浓度范围时呈良好的线性关系(r2=0.968 7)。
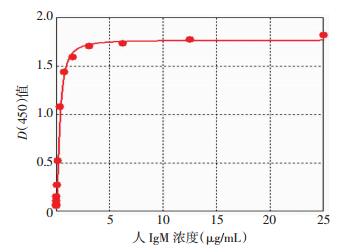
|
| (Logistic四参数曲线拟合,r2=0.999 4) 图 1 IgM型抗-A抗体间接ELISA标准曲线 |
2.2.3 灵敏度、特异性及重复性
采用自建间接ELISA检测57例抗-A抗体阳性及12例抗-A抗体阴性血浆标本,绘制ROC曲线,当临界D(450)为0.259时,AUC最大为0.947(95%CI:0.897~0.998),检测灵敏度为87.7%,检测特异性为100%(图 2)。该检测体系批内变异系数为5.6%~9.3%,批间变异系数为3.8%(表 3)。

|
| 图 2 ELISA检测人血IgM型抗-A抗体ROC曲线 |
| 批次 | 批内(n=10) | 批间(n=3) | |||
| 浓度(μg/mL) | 变异系数(%) | 浓度(μg/mL) | 变异系数(%) | ||
| 1 | 1.29±0.11 | 8.3 | |||
| 2 | 1.32±0.12 | 9.3 | 1.33±0.02 | 3.8 | |
| 3 | 1.39±0.08 | 5.6 | |||
2.3 临床标本的检测
用本自建ELISA体系检测57例B型血浆标本,测得IgM抗-A抗体浓度为(1.71±1.95) μg/mL。同时,采用金标准试管法检测这些标本IgM抗-A抗体效价,对浓度与效价评分进行比较,二者呈正相关(r=0.71,P < 0.01)。
3 讨论目前,ABO不相容性血液制品输注及器官移植所导致的医学不良后果,已成为各个国家医学界关注的重要问题。美国血库协会明确规定:对于输注具有明显ABO不相容性抗体的血液制品,应有严格的筛选制度[11]。对于ABO异型器官移植,ABO抗体引起的急性排斥反应会迅速破坏移植物内的血管网,引起广泛血栓形成,导致移植物失去功能[12]。目前研究表明,急性排斥反应与术前受者体内高浓度ABO血型抗体密切相关,甚至是器官移植成功与否的关键[13-14]。因此,建立快速而准确的ABO抗体定量检测方法尤为重要。对于ABO血型抗体浓度检测,国内外少有文献报道。SATOH等[15]构建了间接ELISA,对血浆抗-A/B抗体进行检测,但其结果仅是对ELISA相对D(450)与传统效价检测进行了相关性分析,未得出具体浓度范围。张敏等[16]构建ELISA对IgG抗-A/B抗体进行检测,亦仅得出了半定量的D(450)结果。卢新奇等[17]通过吸收放散实验获得红细胞吸附抗体,再以抗人球蛋白ELISA检测试剂盒来估算抗-A/B抗体浓度,该研究所得结果特异性较差,且吸收放散实验操作复杂,不便临床推广。SPALTER等[18]采用免疫亲和纯化后测定蛋白浓度的方式进行抗-A/B抗体定量,仅用于不同实验组间抗体浓度比较。
本研究采用A型红细胞膜蛋白作为捕获抗原,构建间接ELISA检测方法,直接对血浆中IgM型抗-A抗体进行定量检测。经过方法学评价,所构建间接ELISA检测试剂盒具有较高检测特异性及检测灵敏度,最低检测下限为0.02 μg/mL,批内变异系数及批间变异系数均小于10%,具有较好的重复性。采用自建间接ELISA对57例B型血浆标本进行检测,IgM抗-A抗体浓度范围为(1.71±1.95)μg/mL,同时对这些标本采用经典试管法测定抗-A抗体效价,将浓度与效价评分进行相关性分析,二者呈正相关(r=0.71,P < 0.01),进一步验证了自建间接ELISA检测结果的可靠性。
本研究所构建的人血IgM抗-A抗体定量检测试剂盒,能快速、批量、精准检测IgM抗-A抗体浓度,对血型抗体相关研究具有重要意义。在后续的研究中我们还需提高捕获抗抗原的纯度,对ELISA检测体系进一步优化,以期大批量用于临床。
| [1] | COOLING L. ABO and platelet transfusion therapy[J]. Immunohematology, 2007, 23(1): 20–33. |
| [2] | FUNG M K, DOWNES K A, SHULMAN I A. Transfusion of platelets containing ABO-incompatible plasma: a survey of 3 156 North American laboratories[J]. Arch Pathol Lab Med, 2007, 131(6): 909–916. DOI:10.1043/1543-2165(2007)131[909:TOPCAP]2.0.CO;2 |
| [3] | HARRIS S B, JOSEPHSON C D, KOST C B, et al. Nonfatal intravascular hemolysis in a pediatric patient after transfusion of a platelet unit with high-titer anti-A[J]. Transfusion, 2007, 47(8): 1412–1417. DOI:10.1111/j.1537-2995.2007.01283.x |
| [4] | KOBAYASHI T, SAITO K. A series of surveys on assay for anti-A/B antibody by Japanese ABO-incompatible Transplantation Committee[J]. Xenotransplantation, 2006, 13(2): 136–140. DOI:10.1111/j.1399-3089.2006.00296.x |
| [5] | PESCIOTTA E N, LAM H S, KOSSENKOV A, et al. In-depth, label-free analysis of the erythrocyte cytoplasmic proteome in Diamond Blackfan anemia identifies a unique inflammatory signature[J]. PLoS ONE, 2015, 10(10): e140036. DOI:10.1371/journal.pone.0140036 |
| [6] | CROWTHER J R. The ELISA guidebook[M]. 2nd ed. New York: Humana Press, 2009: 566. |
| [7] | LEE M F, LIN T M, LIU S W, et al. A rapid method of detecting autoantibody against FcepsilonRIalpha for chronic spontaneous urticaria[J]. PLoS ONE, 2014, 9(10): e109565. DOI:10.1371/journal.pone.0109565 |
| [8] | DENG Q, QIU M, WANG Y, et al. A sensitive and validated immunomagnetic-bead based enzyme-linked immunosorbent assay for analyzing total T-2 (free and modified) toxins in shrimp tissues[J]. Ecotoxicol Environ Saf, 2017, 142: 441–447. DOI:10.1016/j.ecoenv.2017.04.037 |
| [9] |
兰炯采, 吴涛, 张国鹏, 等. 用ELISA双抗夹心法检测sHLA-Ⅰ在不同贮存成分血中的浓度[J].
中国输血杂志, 2003, 16(6): 402–404.
LAN J C, WU T, ZHANG G P, et al. Detection of soluble HLA-Ⅰconcentration in blood components at different storage by ELISA double antigen sandwich assay[J]. Chin J Blood Transfus, 2003, 16(6): 402–404. DOI:10.3969/j.issn.1004-549X.2003.06.007 |
| [10] |
中华人民共和国卫生部医政司. 全国临床检验操作规程[M]. 3版. 南京: 东南大学出版社, 2006: 791-798.
Department of Medical Administration of Ministry of Health of People's Republic of China. National guide to clinical laboratory prodedures[M]. 3 ed. Nanjing: Southeast University Press, 2006: 791-798. |
| [11] | NORRIS J M, DIKEMAN J, GREENE D, et al. Managing change[J]. Transfusion, 2009, 49(11 Pt 2): 2524–2535. DOI:10.1111/j.1537-2995.2009.02470.x |
| [12] | MORIOKA D, TOGO S, KUMAMOTO T, et al. Six consecutive cases of successful adult ABO-incompatible living donor liver transplantation: a proposal for grading the severity of antibody-mediated rejection[J]. Transplantation, 2008, 85(2): 171–178. DOI:10.1097/TP.0b013e31815e9672 |
| [13] | BELLAMY C O, HERRIOT M M, HARRISON D J, et al. C4d immunopositivity is uncommon in ABO-compatible liver allografts, but correlates partially with lymphocytotoxic antibody status[J]. Histopathology, 2007, 50(6): 739–749. DOI:10.1111/j.1365-2559.2007.02677.x. |
| [14] | YURUGI K, KIMURA S, ASHIHARA E, et al. Rapid and accurate measurement of anti-A/B IgG antibody in ABO-unmatched living donor liver transplantation by surface plasmon resonance[J]. Transfus Med, 2007, 17(2): 97–106. DOI:10.1111/j.1365-3148.2007.00737.x |
| [15] | SATOH A, KAWAGISHI N, MINEGISHI M, et al. Development of a novel ELISA for detection of anti-A and anti-B antibodies in recipients of ABO-incompatible living donor liver grafts[J]. Tohoku J Exp Med, 2007, 211(4): 359–367. DOI:10.1620/tjem.211.359 |
| [16] |
张敏, 芦慧霞, 辛琪. IgG抗-A/BELISA检测方法的初探[J].
中国输血杂志, 2011, 24(5): 414–415.
ZHANG M, LU H X, XIN Q. Primary investigation of ELISA for determination of IgG anti-A/B[J]. Chin J Blood Transfus, 2011, 24(5): 414–415. DOI:10.13303/j.cjbt.issn.1004-549x.2011.05.018 |
| [17] |
卢新奇, 张志峰. 定量测定ABO血型IgG抗体新方法的研究[J].
医学检验与临床, 2012, 23(1): 72–73.
LU X Q, ZHANG Z F. A new method for quantitative determination of the ABO blood group IgG antibody[J]. Med Lab Sci Clin, 2012, 23(1): 72–73. DOI:10.3969/j.issn.1673-5013.2012.01.031 |
| [18] | SPALTER S H, KAVERI S V, BONNIN E, et al. Normal human serum contains natural antibodies reactive with autologous ABO blood group antigens[J]. Blood, 1999, 93(12): 4418–4424. |



