组织器官的缺血再灌注损伤是一个复杂的病理生理过程, 有多种细胞和因子参与其中, 血管内皮细胞作为血液与组织之间的最直接屏障, 在缺血再灌注时会发生坏死和凋亡现象, 进而失去应有的屏障功能[1]。有研究表明右美托咪定预处理有减轻心脏、肾脏、脑等脏器缺血再灌注损伤的作用[2]。本研究通过建立氧糖剥夺再灌注损伤细胞模型, 探究右美托咪定预处理对氧糖剥夺再灌注条件下人脐静脉内皮细胞的影响。
1 材料与方法 1.1 细胞培养人脐静脉内皮细胞株HUVECs(由陆军军医大学高原军事医学系馈赠)复苏后培养于含10%胎牛血清的高糖培养基内, 置于37 ℃、5%CO2培养箱中贴壁培养。当细胞约80%融合时, 用0.05%胰蛋白酶消化传代培养。
1.2 试剂药物右美托咪定(Dex):江苏恒瑞制药有限公司; DMEM(高糖培养基)、胎牛血清:美国Gibico公司; Yohimbine(育亨宾, YOH):阿拉丁公司; CCK-8细胞计数盒:东仁化学科技有限公司; LDH试剂盒:南京建成生物科技公司; DCFH-DA检测试剂盒:碧云天公司; Fluo-3 AM钙离子荧光探针:碧云天公司; Rhodamine-123:碧云天公司。Hank’s液:博士德生物公司。
1.3 仪器设备二氧化碳细胞培养箱(赛默飞), 倒置显微镜MoticAE31(Olmpus), 全自动酶标仪Buio.Rad680, BD流式细胞仪。
1.4 实验步骤取对数生长期的细胞消化后接种于直径3.5 cm培养皿或96孔板中培养。待细胞处于增殖期后分组实验。在氧糖剥夺前加入药物预处理2 h, 处理后换成无糖无血清的Hank’s液, 置于1% O2/5%CO2/94%N2的恒温培养箱中培养12 h, 随后换正常的含糖含血清培养基培养4 h, 之后进行相应的指标检测。
1.5 指标观察与检测 1.5.1 CCK-8检测细胞活力每组设置6个复孔, 按每孔10 000个/100 μL细胞接种于96孔板内, 处理后每孔加入10 μL CCK-8检测液, 室温孵育1 h, 用全自动酶标仪于450 nm处检测光密度值, 以此反映细胞活力, 实验重复3次。
1.5.2 LDH检测细胞损伤水平留取细胞培养基于室温下500×g离心5 min, 取上清液, 按LDH检测试剂盒的说明操作, 于450 nm处检测光密度, 以此反映各组细胞损伤水平。
1.5.3 胞内活性氧水平和钙离子水平检测按每个样50×104个细胞接种于直径3.5 cm培养皿中, 每组设置3个样, 处理完后按试剂盒说明书进行探针孵育, 孵育后收集细胞, 用流式细胞仪采用488 nm激发光激发收样, 每个样品收集1×104个细胞, 求出荧光平均值, 以此反映细胞内活性氧水平和钙离子水平。
1.5.4 Rhodamine-123检测线粒体膜电位按每个样50×104个细胞接种于直径3.5 cm培养皿中, 每组设置3个样, 细胞贴壁处于对数生长期后进行实验处理, 实验结束后收集细胞, 用2 μmol/L浓度的Rhodamine-123液孵育10 min, BD流式细胞仪收样, 每个样收集1×104个细胞, 求平均值, 以荧光强度来反映细胞线粒体膜电位高低。
1.6 统计学分析计量资料以x±s表示, 采用SPSS 24.0统计软件, 多组间比较采用单因素方差分析, 方差齐时两两比较行LSD检验, 方差不齐时行Mann-Whitney U检验。检验水准α=0.05。
2 结果 2.1 右美托咪定对氧糖剥夺再灌注条件下血管内皮细胞形态的影响在倒置显微镜下观察(图 1):NC组细胞生长状态良好, 贴壁牢固, 细胞间连接紧密; 边界清楚, 大小均匀, 呈多角型或短梭形。而ogd/r组细胞胞体变修长, 细胞间隙明显增宽, 部分胞膜脱落, 呈现圆形漂浮状态。Dex+ ogd/r组形态与ogd/r组相比较好, 漂浮细胞数量减少, Dex+YOH+ogd/r组与ogd/r组细胞状态接近。

|
| A:NC组; B:ogd/r组; C:Dex+ogd/r组; D:Dex+YOH+ogd/r组 图 1 倒置显微镜观察右美托咪定对氧糖剥夺再灌注条件下的血管内皮细胞形态 |
2.2 Dex药物浓度筛选
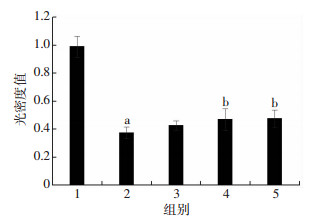
选取1、10、50 μmol/L Dex预处理HUVECs 2 h, 实验结束后用CCK-8检测各组细胞活力, 随着预处理浓度的增加, 细胞活力呈现逐渐上升趋势(P < 0.05, 表 1), 选取50 μmol/L Dex浓度做后续实验。
| 组别 | CCK-8[D(488)] | LDH(U/L) |
| NC组 | 1.087 5±0.110 2 | 183.858 9±25.507 4 |
| ogd/r组 | 0.457 0±0.038 1a | 348.822 4±11.029 5a |
| Dex+ogd/r组 | 0.587 9±0.061 9b | 221.942 8±37.321 4b |
| Dex+YOH+ogd/r组 | 0.425 6±0.044 6b | 322.288 8±25.028 9b |
| a:P < 0.05, 与NC组比较; b:P < 0.05, 与ogd/r组比较 | ||
2.3 Dex预处理对细胞的保护作用被Yohimbine(育亨宾)抵消
选取100 μmol/L Yohimbine(育亨宾)与50 μmol/L Dex共同预处理HUVECs 2 h, ogd/r组细胞活力与NC组相比降低(P < 0.05), LDH活力升高(P < 0.05);Dex+YOH+ogd/r组细胞活力与Dex+ogd/r组相比降低(P < 0.05), LDH活力升高(P < 0.05, 图 2)。
|
| 1:NC组; 2:ogd/r组; 3:1 μmol/L Dex组; 4:10 μmol/L Dex组; 5:50 μmol/L Dex组; a:P < 0.05, 与NC组比较; b:P < 0.05, 与ogd/r组比较 图 2 不同浓度Dex预处理对ogd/r条件下HUVECs细胞活力的影响(n=6, x±s) |
2.4 DCFH-DA结果
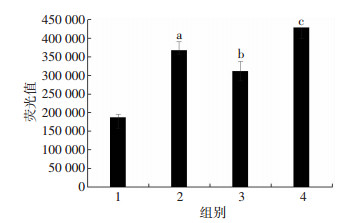
采用DCFH-DA荧光探针检测细胞内活性氧水平, ogd/r组与NC组相比, ROS水平明显升高(NC组:94 766.667±12 343.554, ogd/r组:631 000.000±29 816.103, P < 0.05), Dex+ogd/r组与ogd/r组相比ROS水平下降(ogd/r组:631 000.000±29 816.103, Dex+ogd/r组:391 000.000±7 937.253, P < 0.05), Dex+YOH+ogd/r组与Dex+ogd/r组相比ROS水平回升(Dex+ogd/r组:391 000.000±7 937.254, Dex+YOH+ogd/r组:502 000.000±11 532.563, P < 0.05)。
2.5 Fluo-4 AM结果用Fluo-4 AM荧光探针检测细胞内钙离子水平, ogd/r组与NC组相比, 胞内钙离子水平明显升高(P < 0.05), Dex+ogd/r组与ogd/r组相比钙离子水平下降(P < 0.05), Dex+YOH+ogd/r组与Dex+ogd/r组相比钙离子水平回升(P < 0.05, 图 3)。
|
| 1:NC组; 2:ogd/r组; 3:Dex+ogd/r组; 4:Dex+YOH+ogd/r组; a:P < 0.05, 与NC组比较; b:P < 0.05, 与ogd/r组比较; c:P < 0.05, 与Dex+ogd/r组比较 图 3 Dex减轻ogd/r条件下HUVECs钙超载的作用被Yohimbine(育亨宾)削弱(n=3, x±s) |
2.6 Rhodamine-123结果
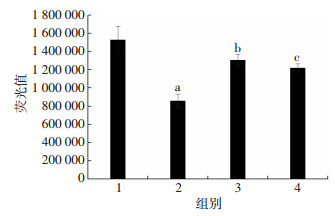
用Rhodamine-123检测细胞线粒体膜电位高低, ogd/r组与NC组相比, 线粒体膜电位降低(P < 0.05), Dex+ogd/r组与ogd/r组相比线粒体膜电位升高(P < 0.05), Dex+YOH+ogd/r组与Dex+ogd/r组相比线粒体膜电位下降(P < 0.05, 图 4)。
|
| 1:NC组; 2:ogd/r组; 3:Dex+ogd/r组; 4:Dex+YOH+ogd/r组; a:P < 0.05, 与NC组比较; b:P < 0.05, 与ogd/r组比较; c:P < 0.05, 与Dex+ogd/r组比较 图 4 Yohimbine削弱了Dex保护ogd/r条件下HUVECs线粒体膜电位的作用(n=3, x±s) |
3 讨论
组织的缺血再灌注损伤涉及到多种细胞, 包括内皮细胞、淋巴细胞等[3-4]。在该病理生理过程中, 内皮细胞屏障功能的丧失会进一步加重组织器官的损伤, 采用适当措施保护内皮细胞结构的完整性和功能可以减轻脏器组织的缺血再灌注损伤[1]。目前的研究证实右美托咪定预处理对脏器缺血再灌注损伤具有保护作用[5-6], 对大鼠C6胶质瘤细胞和PC12细胞有保护作用[7-8], 而其对内皮细胞的保护作用仍需要进一步证实。我们在本实验中建立细胞层面的缺血再灌注模型, 发现在氧糖剥夺再灌注前给予右美托咪定预处理, 相对于模型组来说, 加药组HUVECs的细胞活力上升, 培养基内乳酸脱氢酶活力下降, 这说明右美托咪定预处理可以维持内皮细胞的正常结构与功能。当加入了α2受体特异性拮抗剂Yohimbine(育亨宾)后, 这一保护效应被逆转, 说明这种保护功能可能与激活α2受体有关, 我们的结果与现有动物层面的报道相一致。氧化应激与钙超载是缺血再灌注损伤的重要机制[9], 本实验发现在氧糖剥夺再灌注前给予右美托咪定预处理可以使HUVECs活性氧水平和钙离子水平降低, 而Yohimbine使右美托咪定的效应有所逆转, 这说明右美托咪定通过作用于α2受体减轻了氧糖剥夺再灌注造成的氧化应激和钙超载。缺血再灌注时线粒体膜电位的降低是内皮细胞丧失功能的主要因素之一[10], 线粒体膜电位的丧失会进一步导致细胞的坏死和功能的丧失。我们在本次实验中发现氧糖剥夺再灌注后HUVECs线粒体膜电位下降, 而右美托咪定预处理可以起到保护线粒体膜电位的作用。
综上所述, 右美托咪定预处理可以通过激活α2受体来发挥保护内皮细胞的作用, 而发生于细胞内的分子机制和途径需要进一步寻找和证实。
| [1] | SINGHAL A K, SYMONS J D, BOUDINA S, et al. Role of endothelial cells in myocardial ischemia-reperfusion injury[J]. Vasc Dis Prev, 2010, 7: 1–14. DOI:10.2174/1874120701007010001 |
| [2] | CAI Y, XU H, YAN J, et al. Molecular targets and mechanism of action of dexmedetomidine in treatment of ischemia/reperfusion injury[J]. Mol Med Reports, 2014, 9(5): 1542–1550. DOI:10.3892/mmr.2014.2034 |
| [3] | HOFMANN U, FRANTZ S. Role of lymphocytes in myocardial injury, healing, and remodeling after myocardial infarction[J]. Circulation Res, 2015, 116(2): 354–367. DOI:10.1161/CIRCRESAHA.116.304072 |
| [4] | LIU J, WANG H, LI J. Inflammation and inflammatory cells in myocardial infarction and reperfusion injury:a double-edged sword[J]. Clin Med Insights Cardiol, 2016, 10: 79–84. DOI:10.4137/CMC.S33164 |
| [5] | LEMPIAINEN J, FINCKENBERG P, MERVAALA E E, et al. Dexmedetomidine preconditioning ameliorates kidney ischemia-reperfusion injury[J]. Pharmacol Res Perspect, 2014, 2(3): e45. DOI:10.1002/prp2.45 |
| [6] | IBACACHE M, SANCHEZ G, PEDROZO Z, et al. Dexmedetomidine preconditioning activates pro-survival kinases and attenuates regional ischemia/reperfusion injury in rat heart[J]. Biochim Biophys Acta, 2012, 1822(4): 537–545. DOI:10.1016/j.bbadis.2011.12.013 |
| [7] | WANG Q, SHE Y, BI X, et al. Dexmedetomidine protects PC12 cells from lidocaine-induced cytotoxicity through downregulation of COL3A1 mediated by miR-let-7b[J]. DNA Cell Biol, 2017, 36(7): 518–528. DOI:10.1089/dna.2016.3623 |
| [8] | ZHANG F, DING T, YU L, et al. Dexmedetomidine protects against oxygen-glucose deprivation-induced injury through the I2 imidazoline receptor-PI3K/AKT pathway in rat C6 glioma cells[J]. J Pharm Pharmacol, 2012, 64(1): 120–127. DOI:10.1111/j.2042-7158.2011.01382.x |
| [9] | ZWEIER J, TALUKDER M. The role of oxidants and free radicals in reperfusion injury[J]. Cardiovasc Res, 2006, 70(2): 181–190. DOI:10.1016/j.cardiores.2006.02.025 |
| [10] | DAVIDSON S M, DUCHEN M R. Endothelial mitochondria:contributing to vascular function and disease[J]. Circ Res, 2007, 100(8): 1128–1141. DOI:10.1161/01.RES.0000261970.18328.1d |



