肺癌的放射免疫显像和治疗已成为肿瘤学领域一个重要的研究方向。选择好的肿瘤靶点,制备出其特异性的分子探针是放射免疫显像和治疗的关键。表面碳水化合物相关抗原(carbohydrate antigen 215,CA215)是一种结构类似于人免疫球蛋白(IgG)重链的肿瘤相关糖蛋白抗原,也被称为“癌源性IgG”,主要表达于癌细胞膜上,少量分泌到血液中[1-6]。目前研究证实CA215在多种肿瘤中高表达,包括非小细胞肺癌,而在正常组织及细胞中几乎不表达,且CA215在肿瘤的生长、侵袭和转移过程中发挥着重要作用,极有可能是新的肺癌早期诊断和治疗的有效靶点[7-8]。单克隆抗体(monoclonal antibody, McAb)作为实现生物靶向运输的载体在肿瘤放射免疫治疗中显示出巨大的潜力。RP215是靶向CA215的小鼠抗人McAb,其仅特异性结合于癌源性IgG,而对正常B细胞分泌的IgG不反应[9-11],能较好地靶向肿瘤细胞而不损伤正常组织。本研究用131I标记RP215制备靶向CA215的分子探针并鉴定其理化特性,对其在荷肺腺癌裸鼠模型体内的生物分布和放射免疫显像进行研究,旨在为肺腺癌的早期放射免疫诊断和放射免疫治疗奠定基础。
1 材料与方法 1.1 实验材料与试剂RP215小鼠抗人McAb (相对分子质量约150 000)购于Santa Cruz公司(上海);A549细胞株(人非小细胞肺癌细胞)由本校肿瘤放射医学实验室提供;氯胺T、偏重亚硫酸钠购于成都西亚试剂有限公司;碘化钾、甲醇均购于上海试剂三厂;131I核素购于成都中核高通同位素股份有限公司;Sephadex G25M纯化柱购于Pharmacial公司;新鲜人血清来自重庆医科大学附属第一医院血库;GC-911型γ-免疫计数器购于中加光电仪器公司;BALB/c裸鼠购于重庆医科大学实验动物中心;Siemens Symbia T2 SPECT/CT显像仪购于德国Siemens公司。
1.2 方法 1.2.1 131I-RP215 McAb制备、纯化及物理性质鉴定氯胺T法标记制备131I-RP215 McAb:50 μL(0.2 mg/mL) RP215 McAb混于10 μL131I原液(放射性浓度为3.7×109Bq/mL)中,涡旋震荡3 min后加氯胺T 50 μL(2 mg/mL),室温下震荡反应50 s后加入100 μL偏重亚硫酸钠溶液(2 mg/mL)及100 μL 10% KI溶液(10 mg/mL)终止反应。将反应后混合液上Sephadex G25M柱纯化,收集前30管洗脱液。采用纸层析法检测131I-RP215 McAb标记率及纯化后的放化纯度,并计算其放射性比活度。纯化的131I-RP215 McAb置于室温下1、6、12、24 h,纸层析法分别检测各时间点的放化纯度,分析其室温稳定性。将50 μL 131I-RP215 McAb纯化液与1 mL新鲜人血清混合,于37 ℃孵育箱中孵育1、6、12、24 h后取样检测放化纯度,纸层析法分析其血清稳定性。
1.2.2 131I-RP215 McAb体外生物活性鉴定 1.2.2.1 体外竞争结合实验取对数期生长的A549细胞接种于24孔板(5×104个/孔),继续培养12 h。分别以终浓度0、1、5、10、50、100、200 nmol/L加入未标记的RP215 McAb,每个浓度设置3个复孔。每孔100 μL加入131I-RP215 McAb (3.7×106Bq/μg),混匀后,4 ℃孵育4 h。4 ℃预冷的PBS洗涤3次,以洗掉细胞表面非特异性结合的放射性。胰酶消化细胞,收集细胞悬液,γ-免疫计数器测量细胞每分钟放射性计数(cpm)。根据公式计算细胞表面特异性结合放射性百分比,绘制竞争结合曲线。
细胞结合放射性百分比=结合在细胞上的放射性计数/总放射性计数×100%
1.2.2.2 饱和实验对数生长期A549细胞接种于48孔板(2×104个/孔),培养12 h。分别在每孔加入浓度梯度为0.5、1、5、10、50、100、150、200 nmol/L的131I-RP215 McAb,每个浓度3个复孔;另设置竞争抑制组,每孔同时加入1 000倍未标记的RP215 McAb,混匀后置于4 ℃孵育4 h。4 ℃预冷的PBS洗涤3次,去除非特异性结合的放射性。胰酶消化细胞,收集细胞悬液,γ-免疫计数器测量细胞悬液的cpm,并绘制饱和结合曲线。
1.2.3 荷人肺腺癌裸鼠模型构建A549细胞培养至对数生长期,调整细胞数至5×107/mL,接种200 μL细胞悬液至4周龄的雌性裸鼠的右侧大腿皮下,待肿块体积>1 cm3时,用于131I-RP215 McAb体内生物分布及放免显像研究。
1.2.4 131I-RP215 McAb荷瘤裸鼠体内生物分布选取荷瘤裸鼠24只,按随机数字表法分为4组,每组6只。尾静脉注射50 μL新鲜131I-RP215 McAb(370 kBq),分别于注射后4、24、48、72 h将4组裸鼠眼球取血后颈椎脱臼法处死,取肿瘤、血液、心脏、肝脏、脾、肺、肾、胃、肠、股骨、左侧大腿肌肉、脑等组织器官准确称量,用γ-计数器测量每分钟cpm。根据公式计算各组织每克组织的百分注射剂量率。
每克组织的百分注射剂量率=组织放射性计数/(注射药物放射性计数×组织质量)×100%
1.2.5 131I-RP215 McAb在荷瘤裸鼠体内的SPECT放射免疫显像显像前3 d将荷瘤裸鼠饮用水换为1%KI溶液以封闭甲状腺,取符合条件的荷瘤裸鼠5只,经戊巴比妥腹腔麻醉后,尾静脉注射0.1 mL新鲜131I-RP215 McAb(9.25 MBq),俯卧位固定于木板上,注射后4、12、24、48 h进行SPECT静态显像观察裸鼠体内放射性浓聚情况,采用感兴趣区(region of interest, ROI)技术计算肿瘤部位与对侧相应部位放射性比值(T/NT),并选择肿瘤显像最清晰时行SPECT/CT图像融合。SPECT采集条件:采用高能准直器,固定采集Zoom为1.45,能峰为364 keV,矩阵256×256,采集计数均为100 K,显像仪器均为双探头SPECT/CT仪。
1.3 统计学分析采用SPSS 22.0统计软件,数据以x±s表示,多组计量数据间比较采取单因素方差分析和t检验。检验水准:α=0.05。
2 结果 2.1 131I-RP215 McAb的制备、纯化及物理性质鉴定采用氯胺T法成功对RP215 McAb进行131I标记,标记反应液经Sephadex G25M柱纯化,洗脱曲线出现2个放射峰,收集第1峰得到纯化的131I-RP215 McAb标记液(图 1)。纸层析法测得标记率为(91.03± 2.36)%,纯化后放化纯度为(93.15±1.40)%,放射化学比活度为(3.37±0.42)MBq/μg。131I-RP215 McAb置于室温下1、6、12、24 h的放化纯度分别为(91.39± 1.28)%、(90.34±1.06)%、(86.54±2.07)%、(85.73± 1.54)%, 差异无统计学意义(P>0.05)。131I-RP215 McAb与新鲜人血清37 ℃孵育1、6、12、24 h的放化纯度分别为(92.90±1.94)%、(91.08±1.48)%、(88.34±1.52)%、(86.84±2.16)%, 差异无统计学意义(P>0.05)。
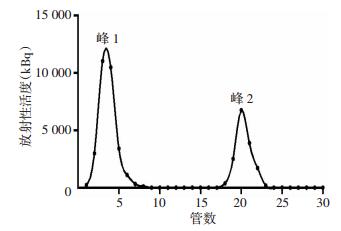
|
| 峰1:131I-RP215峰;峰2:游离131I峰 图 1 131I-RP215淋洗液放射性分布 |
2.2 131I-RP215 McAb体外生物活性鉴定
体外竞争结合曲线(图 2A)结果显示,131I-RP215 McAb与A549细胞的结合率随着相应的非标记RP215 McAb浓度的增加而逐渐降低,表明131I-RP215 McAb与A549细胞上抗原的结合能够被相应的非标记RP215 McAb抑制,并且随着非标记RP215 McAb浓度的增加,该抑制作用逐渐增强。
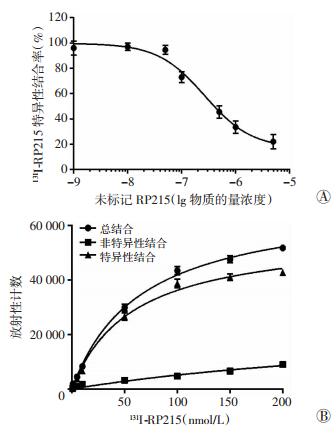
|
| A:竞争结合曲线;B:饱和结合曲线 图 2 131I-RP215 McAb体外生物活性鉴定实验 |
饱和结合曲线(图 2B)结果显示,实验组A549细胞表面的放射性随着131I-RP215 McAb浓度的增加而升高,并逐渐趋于饱和,表明131I-RP215 McAb与A549细胞为特异性结合。竞争抑制组随着131I-RP215 McAb浓度的增加,放射性计数升高,但无饱和趋势,且其放射性计数远低于实验组,说明为非特异性结合。
2.3 荷人肺腺癌裸鼠模型复制成功复制荷人A549裸鼠模型,且于接种后6周,肿瘤体积为1.5~2.0 cm3。
2.4 131I-RP215 McAb荷瘤裸鼠体内生物分布131I-RP215 McAb在荷瘤裸鼠体内主要分布于肿瘤、肝、肾、脾、肺、血液组织,随着注射后时间的增加肝、肾、脾、肺、血液组织每克组织的百分注射剂量率显著降低,而肿瘤每克组织的百分注射剂量率降低速度较慢,说明131I-RP215 McAb在肿瘤组织中滞留时间较长,肿瘤/肌肉比在24 h达到最高值,见表 1。
| 部位 | 4 h | 24 h | 48 h | 72 h |
| 血 | 17.34±1.35 | 10.68±0.73 | 7.73±0.92 | 4.08±1.13 |
| 心脏 | 3.76±0.78 | 1.46±0.39 | 1.09±0.33 | 0.85±0.30 |
| 肝脏 | 10.78±0.39 | 7.45±0.58 | 5.23±1.08 | 4.02±0.66 |
| 脾 | 6.03±0.72 | 4.37±1.01 | 2.84±0.57 | 2.55±0.09 |
| 肺 | 6.24±0.73 | 5.57±0.65 | 3.75±1.14 | 3.03±0.37 |
| 肾 | 5.92±0.50 | 6.74±1.46 | 5.38±0.34 | 3.62±0.63 |
| 胃 | 2.53±0.18 | 2.14±0.27 | 1.83±0.23 | 1.25±0.17 |
| 肠 | 1.87±0.32 | 2.36±0.19 | 1.62±0.09 | 1.43±0.12 |
| 骨 | 1.06±0.46 | 0.61±0.08 | 0.44±0.12 | 0.40±0.07 |
| 肌肉 | 1.76±0.03 | 0.96±0.16 | 0.90±0.05 | 0.83±0.10 |
| 脑 | 0.44±0.11 | 0.36±0.06 | 0.31±0.02 | 0.27±0.03 |
| 肿瘤 | 4.37±0.83 | 4.18±0.65 | 3.64±0.48 | 2.82±0.52 |
| 肿瘤/肌肉比 | 2.48±0.26 | 4.35±0.33 | 4.04±0.18 | 3.40±0.21 |
2.5 131I-RP215 McAb在荷瘤裸鼠体内的SPECT放射免疫显像
SPECT显像结果显示,在尾静脉注射131I-RP215 McAb后24 h,荷瘤裸鼠肝、肾、脾、肺、血液等部位放射性浓聚明显降低,此时肿瘤组织显影最清晰,ROI技术测得肿瘤组织T/NT值在24 h达到最高,为4.74(图 3),此时行SPECT/CT图像融合效果最佳(图 4)。
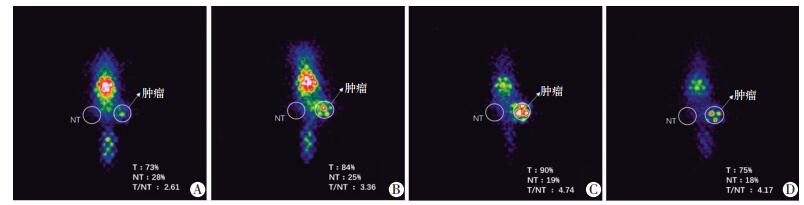
|
| A:4 h;B:12 h;C:24 h;D:48 h 图 3 注射131I-RP215 McAb荷瘤裸鼠体内不同时间点SPECT静态显像 |
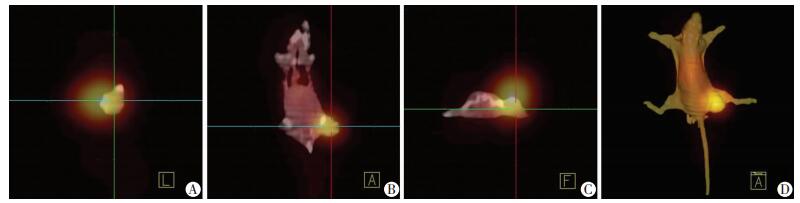
|
| A:矢状位;B:冠状位;C:轴位;D:3D仿真图像 图 4 注射131I-RP215 McAb 24 h后荷瘤裸鼠SPECT/CT融合图像 |
3 讨论
放射免疫显像是放射免疫治疗的前提,放射免疫显像在肿瘤的早期诊断、正确分期、有效治疗等方面发挥着非常重要的作用。本研究选择临床常用放射性核素131I与RP215 McAb偶联,一方面其发射的γ射线可用于荷瘤裸鼠的显像,对肿瘤进行定位;另一方面其发射的β射线则可以直接杀伤肿瘤细胞从而达到治疗的目的。131I半衰期为8.04 d,且氯胺T法抗体131I标记技术成熟、操作简单,标记率较高,经鉴定本研究标记抗体在体内、体外均有较好的稳定性,利于储存使用。本研究抗体标记率为(91.03±2.36)%,纯化后放化纯度为(93.15±1.40)%,无明显提高,可能与纯化前未标记上的游离131I较少或纯化液中存在碘标记的其他化合物有关。核素标记抗体过程中有可能使抗体免疫活性发生改变,本研究通过体外竞争结合实验和饱和实验证实了标记后抗体仍具有良好的生物学活性,其特异性结合抗原的能力与非标记抗体相比无明显变化。荷瘤裸鼠体内分布结果显示肿瘤组织在24h时T/NT值最高,与SPECT静态显像结果相一致,说明24h为最佳显像时间,此时行SPECT/CT融合成像,可见肿瘤组织放射性较高,而其他组织放射性降低,对比明显,肿瘤显影清晰。显像早期肝、脾、肺等组织放射性浓聚,可能与丰富的血供有关;肾脏放射性也高,可能与标记抗体的排泄有关。随着时间的延长及体内抗体标记物的代谢,肝、脾、肺、肾等组织的放射性本底逐渐降低,而肿瘤组织放射性增强,说明131I-RP215 McAb能选择性浓聚到肿瘤组织,有较好的靶向性。
目前靶向治疗中研究较多的肺癌靶点有EGFR、HER-2、VEGF、ALK、MET等,但由于靶点突变等原因,一直存在分子靶向药物的耐药问题;且以上靶点虽在肿瘤细胞中高表达,但也表达于某些重要的正常组织中,靶向药物在杀伤肿瘤组织的同时也会干扰这些正常组织信号传导通路。本研究选择的肿瘤靶点CA215在肺腺癌中主要表达于癌巢的基底细胞样肿瘤细胞,能促进肿瘤细胞向肿瘤间质转移[12],并且只在肿瘤组织中表达,其McAb RP215也仅特异性识别癌源性IgG重链上的糖基化表位[13],从而有效地避免了抗体对正常组织的损伤。加之抗体偶联的核素对肿瘤细胞有直接杀伤作用,范围可达数十个肿瘤细胞直径,而不需要药物的内化过程,在一定程度上克服了肿瘤抗原表达异质性所造成的盲区及肿瘤细胞的耐药问题。因此,制备以CA215为靶点的131I-RP215 McAb核素分子探针可望为肺腺癌的放射免疫诊断和放射免疫治疗提供一条新的有效途径。
本研究也存在一定的局限性:鼠源单抗的异源性及其相对分子质量较大等缺点,极大地限制了鼠源单抗的临床应用。近年来,利用基因工程技术制备的人源小型化抗体以其独特的优势在免疫显像及免疫治疗中得到越来越多的应用[14-16]。庞华[17]、王洁等[18]通过噬菌体展示技术制备了肺腺癌的人源单链抗体,并在荷瘤裸鼠进行放射免疫显像获得了较好的效果。本课题组后期也将进一步对RP215的单链抗体及单域抗体进行放射免疫显像研究,以期获得比RP215 McAb更好的显像效果,为肺癌的临床放射性核素靶向显像及治疗提供理论和实践依据。
| [1] | LEE G, ZHU M, GE B, et al. Widespread expressions of immunoglobulin superfamily proteins in cancer cells[J]. Cancer Immunol Immunother, 2012, 61(1): 89–99. DOI:10.1007/s00262-011-1088-1 |
| [2] | LEE G. Cancer cell-expressed immunoglobulins: CA215 as a pan cancer marker and its diagnostic applications[J]. Cancer Biomark, 2009, 5(3): 137–142. DOI:10.3233/CBM-2009-0610 |
| [3] | LEE G, LAFLAMME E, CHIEN C H, et al. Molecular identity of a pan cancer marker, CA215[J]. Cancer Biol Ther, 2008, 7(12): 2007–2014. DOI:10.4161/cbt.7.12.6984 |
| [4] | LEE G, WU Q, LI C H, et al. Recent studies of a new carbohydrate-associated pan cancer marker, CA215[J]. J Clin Ligand Assay, 2006, 29(1): 47–51. |
| [5] | LEE G, GE B, HUANG T K, et al. Positive identification of CA215 pan cancer biomarker from serum specimens of cancer patients[J]. Cancer Biomark, 2010, 6(2): 111–117. DOI:10.3233/CBM-2009-0134 |
| [6] | LEE G, AZADI P. Peptide mapping and glycoanalysis of cancer cell-expressed glycoproteins CA215 recognized by RP215 monoclonal antibody[J]. J Carbohyd Chem, 2012, 31(1): 10–30. DOI:10.1080/07328303.2011.626544 |
| [7] | LIAO Q, LIU W, LIU Y, et al. Aberrant high expression of immunoglobulin G in epithelial stem/progenitor-like cells contributes to tumor initiation and metastasis[J]. Oncotarget, 2015, 6(37): 40081–40094. DOI:10.18632/oncotarget.5542 |
| [8] | LEE G, CHEUNG A P, LI B, et al. Molecular and immuno-characteristics of immunoglobulin-like glycoproteins in cancer cell-expressed biomarker, CA215[J]. Immunol Invest, 2012, 41(4): 429–446. DOI:10.3109/08820139.2012.661007 |
| [9] | LEE G, ZHU M, GE B. Potential monoclonal antibody therapy for the treatment of ovarian cancer[M]//FARGHALY S A. Ovarian cancer—basic science perspective. Rijeka: Tech-Open Access Publisher, 2012: 385-406. |
| [10] | LEE G, GE B. Inhibition of in vitro tumor cell growth by RP215 monoclonal antibody and antibodies raised against its anti-idiotype antibodies[J]. Cancer Immunol Immunother, 2010, 59(9): 1347–1356. DOI:10.1007/s00262-010-0864-7 |
| [11] | LEE G, CHU R A, TING H H. Preclinical assessment of anti-cancer drugs by using RP215 monoclonal antibody[J]. Cancer Biol Ther, 2009, 8(2): 161–166. DOI:10.4161/cbt.8.2.7117 |
| [12] | LIU Y, LIU D, WANG C, et al. Binding of the monoclonal antibody RP215 to immunoglobulin G in metastatic lung adenocarcinomas is correlated with poor prognosis[J]. Histopathology, 2015, 67(5): 645–653. DOI:10.1111/his.12686 |
| [13] | LEE G, GE B. Cancer cell expressions of immunoglobulin heavy chains with unique carbohydrate-associated biomarker[J]. Cancer Biomark, 2009, 5(4): 177–188. DOI:10.3233/CBM-2009-0102 |
| [14] | HUDSON P J, SOURIAU C. Engineered antibodies[J]. Nat Med, 2003, 9(1): 129–134. DOI:10.1038/nm0103-129 |
| [15] | REITER Y, SCHUCK P, BOYD L F, et al. An antibody single-domain phage display library of a native heavy chain variable region: isolation of functional single-domain VH molecules with a unique interface[J]. J Mol Biol, 1999, 290(3): 685–698. DOI:10.1006/jmbi.1999.2923 |
| [16] | YU F, WANG Y, XIAO Y, et al. RP215 single chain fragment variable and single domain recombinant antibodies induce cell cycle arrest at G0/G1 phase in breast cancer[J]. Mol immunol, 2014, 59(1): 100–109. DOI:10.1016/j.molimm.2014.01.007 |
| [17] |
庞华. 肺腺癌人源噬菌体单链抗体制备及其在荷人肺腺癌裸鼠模型中的放免显像[D]. 重庆: 重庆医科大学, 2008.
PANG H. The construction of human single-chain variable fragment antibodies of lung adenocarcinoma and its radioimmunoimaging in bearing cancer nude mice[D]. Chongqing: Chongqing Medical University, 2008. |
| [18] |
王洁, 李建国, 庞华, 等. 抗HIF-1α肺腺癌人源单链抗体的制备和放射免疫显像[J].
第三军医大学学报, 2010, 32(17): 1851–1853.
WANG J, LI J G, PANG H, et al. Preparation of human anti-HIF-1α scFv of lung adenocarcinoma and its radioimmunoimaging[J]. J Third Mil Med Univ, 2010, 32(17): 1851–1853. DOI:10.16016/j.1000-5404.2010.17.033 |



