2. 402360 重庆, 重庆市大足区人民医院超声科;
3. 400010 重庆, 重庆医科大学附属第二医院超声科
2. Department of Ultrasonography, Dazu People's Hospital, Chongqing, 402360;
3. Department of Ultrasonography, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
超声分子显像与靶向治疗是利用纳米载体结合治疗药物和高准确度、高特异性的诊断探针, 整合药物靶向递送、治疗和监控等功能于一体的诊疗体系[1-4]。如何设计与构建超声分子探针是疾病诊疗研究中的关键。新生血管的形成是多数实体肿瘤和易损斑块的重要标志, 与肿瘤的生长、侵袭、转移以及预后密切相关, 同时它也是评价动脉粥样硬化斑块稳定性和易损性的重要指标[5-6]。抑制肿瘤中新生血管的形成, 使肿瘤细胞缺乏营养物质和氧气供应, 能达到抑制肿瘤生长的目的[7]; 同样地, 减少易损斑块中新生血管, 可以使斑块变得稳定, 防止心脑血管事件的发生[8], 所以抗血管新生成成为重要的靶点和治疗的重要途径之一[9]。目前针对新生血管以化疗为主, 但是单纯减少新生血管以后会加重肿瘤细胞缺氧, 导致肿瘤的扩散以及耐药的产生等[10]。所以, 为同时针对新生血管及其周围病灶组织, 本文以新生血管为靶点, 利用FDA认证的具有良好生物相容性的PLGA高分子有机聚合物为载体材料[11], 携载液气相变型液态氟碳[12-13]和光敏剂酞菁锌, 基于光致相变及光热转化效应原理[14-15], 实现增强超声显像与靶向光热治疗于一体的诊疗分子探针, 并通过一系列体外实验评价其诊疗效果。
1 材料与方法 1.1 材料羧基端乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid)carboxyl, PLGA-COOH聚合物, 济南岱罡生物工程有限公司]; 酞菁锌(Zinc phthalocyanine, ZnPc, Sigma); 全氟己烷(perfluorohexane, PFH, 百灵威科技有限公司); 聚乙烯醇(polyving akohol, PVA, Sigma); EDC/NHS(Sigma); MES monohydrate(Sigma); DiI荧光染料(碧云天生物技术研究所); FITC-IgG(武汉博士德生物工程有限公司); CCK-8试剂盒(东仁化学科技有限公司); VEGFR-2抗体(Abcam), 人脐静脉内皮细胞(HUVECEs, 重庆医科大学超声影像学研究所); RPMI1640培养基(Gibco); 琼脂糖(Life Technologies)。
1.2 仪器Sonic声振仪, 透射电镜, 纳米粒度及Zeta电位分析仪, 紫外分光光度计, 近红外激光仪(660 nm), 流式细胞仪(FCM), 激光共聚焦显微镜(LSCM), 多功能酶标仪, 热成像仪, MYLAB90超声诊断仪。
1.3 实验方法 1.3.1 载酞菁锌相变型靶向纳米粒的制备及其一般特性具体步骤参照文献[16]。首先采用双乳化法制备纳米粒, 后采用碳二亚胺法将纳米粒与VEFGR-2抗体偶联, 得到靶向VEGFR-2纳米粒。透射电镜观察纳米粒形态, 纳米粒度及Zeta电位分析仪检测其粒径、电位, 紫外分光光度计检测其吸收光谱。
1.3.2 纳米粒与VEGFR-2抗体偶联检测分别对纳米粒和VEGFR-2抗体行DiI和FITC标记。激光共聚焦显微镜观察纳米粒与抗体的连接情况。流式细胞仪检测纳米粒与抗体的连接率。
1.3.3 细胞培养及细胞毒性实验人脐静脉内皮细胞(HUVECs)采用含1%双抗、10%胎牛血清的RPMI1640培养液放置于37 ℃、5%CO2培养箱中培养。采用CCK-8法检测细胞毒性, 具体步骤参照文献[16]。
1.3.4 体外寻靶实验将细胞分别接种于激光共聚焦培养皿和6孔板内。分为4组:①阴性对照组; ②非靶向组; ③靶向组; ④抗体封闭组。具体实验步骤参照文献[15]。激光共聚焦显微镜和流式细胞仪观察和检测纳米粒与细胞结合情况。
1.3.5 体外光热效应及光致相变激光分别辐照不同浓度(0.1、0.2、0.5、1.0 g/L)PLGA@PFH@ZnPc和浓度为1.0 g/L PLGA@PFH纳米粒, 用热成像仪监测纳米粒悬液的温度, 辐照后光镜下观察纳米粒的相变情况。
1.3.6 体外超声显像激光分别辐照不同浓度(0.1、0.2、0.5、1.0 g/L)的PLGA@PFH@ZnPc和PLGA@PFH纳米粒, 将辐照后的纳米粒悬液置于3%凝胶模型中, 超声诊断仪观察其增强显像效果, 并用DFY组织灰度定征软件(重庆医科大学超声影像学研究所发明的一种定量分析超声图像灰度值的软件)测量信号灰度值。
1.3.7 体外光热治疗将细胞接种于6孔板, 分为4组(n=3):①阴性对照组; ②单纯激光辐照组, 仅单纯激光辐照细胞; ③非靶向治疗组; ④靶向治疗组。非靶向和靶向治疗组为分别加入非靶向和靶向纳米粒与细胞共孵育2 h, 然后PBS冲洗未和细胞结合的纳米粒, 加入正常培养液后激光辐照, 继续孵育24 h后流式细胞仪检测细胞凋亡情况。
1.4 统计学分析采用GraphPad 6.01软件进行统计学分析, 计量资料以x±s表示, 多样本均数的比较采用单因素方差分析, 两变量之间关系采用线性相关分析。
2 结果 2.1 载酞菁锌相变型靶向纳米粒基本性质成功制备载酞菁锌相变型靶向纳米粒, 纳米粒度及Zeta电位分析仪测得其粒径为(256.40±57.14)nm(图 1A), 分散指数小(PdI:0.040), 说明纳米粒的粒径均一; 电位为(-25.4±5.0)mV。透射电镜下对比观察PLGA@PFH@ZnPc和PLGA@PFH纳米粒, 两者形貌相同, 均呈球形, 分散性好, 未见粘连、聚集现象, 粒径均一并与粒径分析结果一致。单个纳米粒透射电镜图中可以看出黑色的液态氟碳为纳米粒的核, 其周围一圈白色为PLGA壳, 结果说明ZnPc溶解载于PLGA壳上, 在透射电镜下无法观察到(图 1B); 吸收光谱图显示PLGA@PFH@ZnPc与ZnPc有相似的吸收光谱, 且最大吸收波段在600~680 nm; 而PLGA@PFH的光吸收值完全可以忽略不计(图 1C); 以上结果表明PFH和ZnPc成功搭载于PLGA上。

|
| A:纳米粒的粒径分布图; B:纳米粒的透射电镜观察; C:酞菁锌及纳米粒的光吸收图谱 图 1 载酞菁锌相变型靶向纳米粒基本性质 |
CCK-8法检测结果显示HUVECs细胞在加入含有不同浓度纳米粒(0.2、0.4、0.6、0.8、1.0 g/L)孵育24 h后, 细胞的活力分别为(0.975±0.031)%、(0.950±0.078)%、(0.948±0.073)%、(0.946±0.073)%、(0.942±0.084)%, 各组间差异无统计学意义(F=0.402, P>0.05), 说明纳米粒没有明显的细胞毒性。
2.2 VEGFR-2抗体与纳米粒偶联的检测激光共聚焦显微镜显示DiI标记PLGA纳米粒呈橘红色, FITC标记VEGFR-2抗体呈绿色, 二者在融合通道内呈黄色, 表明VEGFR-2抗体和纳米粒成功偶联(图 2)。流式细胞仪检测纳米粒与抗体的连接率为(82.73±2.02)%。

|
| A:DiI标记的纳米粒; B:FITC标记的VEGFR-2抗体; C:前两者的融合通道 图 2 激光共聚焦显微镜观察VEGFR-2抗体与纳米粒偶联 |
2.3 体外寻靶实验
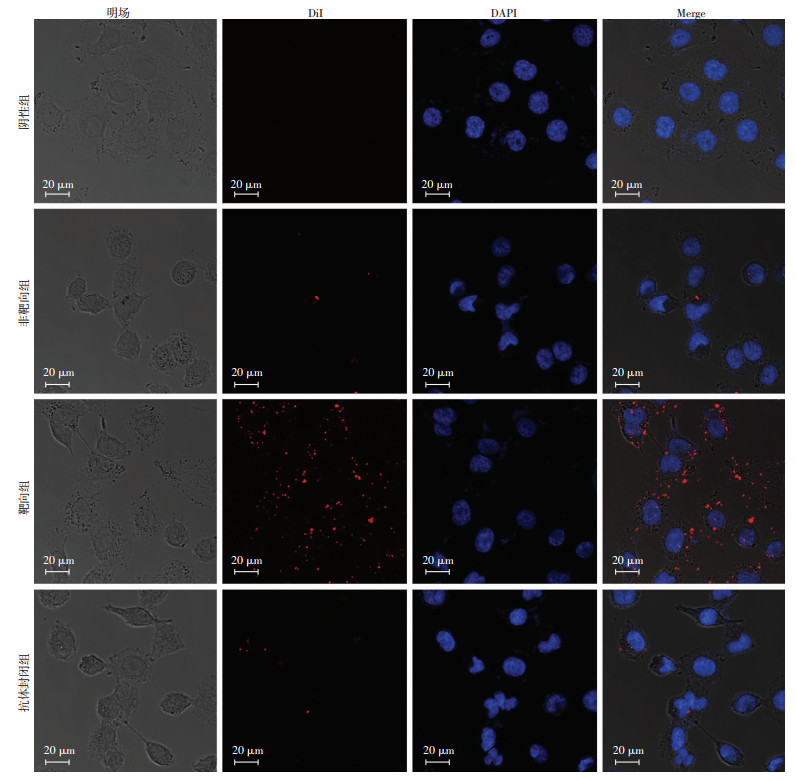
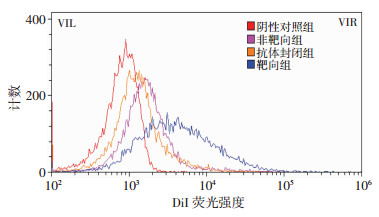
激光共聚焦显微镜显示靶向组细胞膜周围出现大量的红色荧光, 而非靶向组和抗体封闭组细胞膜周围仅有少许红色荧光(图 3)。流式细胞仪检测显示非靶向组、抗体封闭组和靶向组中, 纳米粒与HUVECs连接率分别为(9.52±2.14)%、(9.92±1.62)%、(61.89± 3.62)%, 各组间差异有统计学意义(F=463.7, P < 0.05);非靶向组(q=40.21, P < 0.05)、抗体封闭组(q=30.91, P < 0.05)与靶向组比较差异有统计学意义; 非靶向组与抗体封闭组比较差异无统计学意义(q=0.309 7, P>0.05, 图 4)。二者实验结果均表明靶向纳米粒和HUVECs细胞的特异性结合, 证明靶向纳米粒具有良好的靶向能力。而抗体封闭组荧光强度较靶向组明显减少, 则说明靶向纳米粒是通过VEGFR-2介导的通路与HUVECs特异性结合。
|
| 明场显示细胞的轮廓, 红色为DiI标记的纳米粒, 蓝色为DAPI标记的细胞核, Merge为融合通道 图 3 激光共聚焦显微镜观察纳米粒与HUVECs结合情况 |
|
| 图 4 流式细胞仪检测纳米粒与HUVECs细胞连接情况 |
2.4 体外光热效应及光致相变
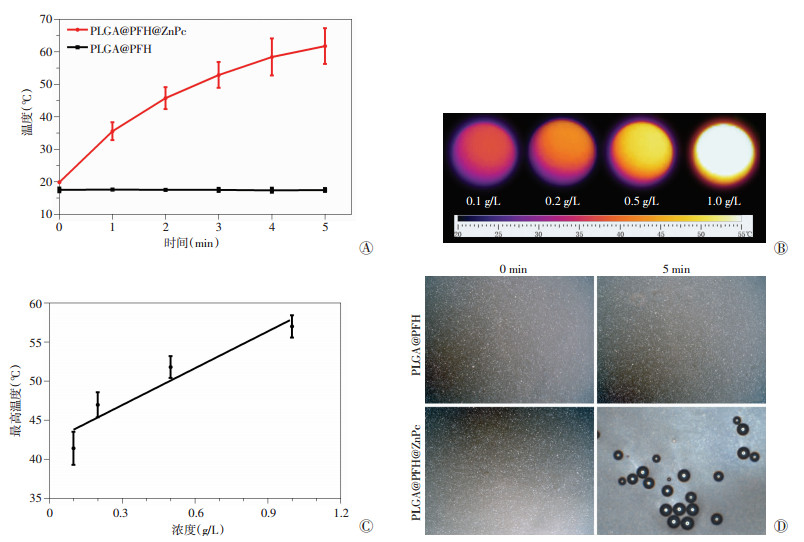
在激光辐照过程中, PLGA@PFH@ZnPc纳米粒悬液温度随着辐照时间的延长而逐渐升高, 最终趋于稳定, 而对照组PLGA@PFH纳米粒悬液的温度没有明显的变化(图 5A); 另外从热成像图中看出, 随着纳米粒浓度的增加, 纳米粒悬液所能达到的最高温度也随之增高(图 5B); 图 5C定量分析显示两者关系呈正相关(r=0.953 4, P < 0.05)。激光辐照后, 光镜下观察到PLGA@PFH@ZnPc纳米粒发生了相变, 而PLGA@PFH纳米粒没有相变发生(图 5D)。结果说明酞菁锌能够吸收激光能量, 并将其转化为热能使纳米粒悬液升温, 同时能够激发PFH的液气相变。
|
| A:不同纳米粒在激光辐照后的温度变化曲线(n=3, x±s); B:不同浓度PLGA@PFH@ZnPc纳米粒在激光辐照后达到最高温度时的热成像图; C:最高温度与浓度关系定量分析(n=3, x±s); D:两种纳米粒辐照前后光镜观察(×40) 图 5 纳米粒的光热效应与光致相变 |
2.5 体外超声显像
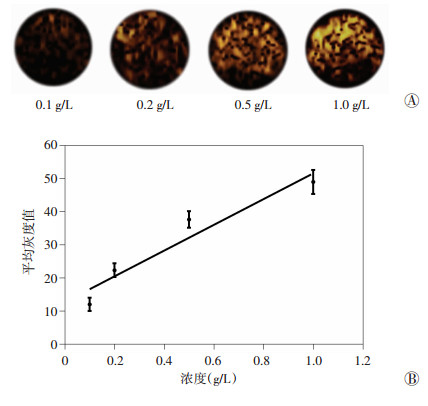
前面实验已经验证在激光辐照后PLGA@PFH@ZnPc纳米粒具备光热效应, 能够激发液态氟碳发生液气相变, PLGA@PFH纳米粒则没有发生相变。同样地, 超声诊断仪没有观察到PLGA@PFH纳米粒有增强超声信号, 而不同浓度的PLGA@PFH@ZnPc纳米粒则观察到有增强超声信号(图 6A), 结果说明PFH的液气相变能够增强超声显像; 用DFY组织灰度定征软件测得信号平均灰度值如图 6B; 从超声图像和超声信号平均灰度值均可以看出, 随着纳米粒浓度的增高, 增强超声信号越强, 两者关系呈正相关(r=0.960 8, P < 0.05)。
|
| A:不同浓度纳米粒的增强超声显像观察; B:不同浓度与对应信号强度定量分析(n=3, x±s) 图 6 PLGA@PFH@ZnPc纳米粒体外超声显像及信号灰度值 |
2.6 体外光热治疗
流式细胞仪检测细胞凋亡, 结果如图 7, 单纯激光辐照组与对照组的细胞凋亡比例分别为(6.99±1.44)%、(7.72±1.45)%, 且均在10%以下, 而且两者差异无统计学意义(q=0.704 1, P>0.05), 说明单纯激光辐照对细胞没有明显作用。靶向组和非靶向组引起细胞凋亡的比例分别为(79.49±2.22)%、(24.23± 1.95)%, 靶向组明显高于非靶向组, 两者差异有统计学意义(q=53.30, P < 0.05)。结果与体外寻靶实验一致, 靶向组纳米粒与细胞结合明显多于非靶向组, 所以导致细胞凋亡的比例越高, 即光热治疗效率越高。
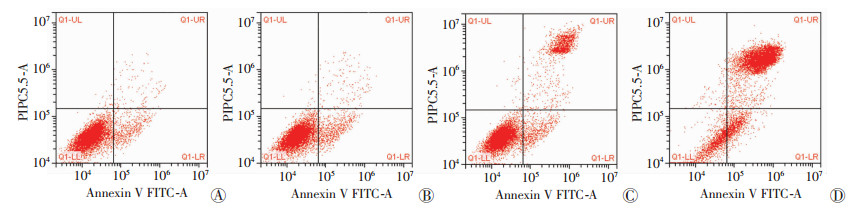
|
| A:对照组; B:单纯激光辐照组; C:非靶向组; D:靶向组 图 7 体外光热治疗流式细胞仪检测结果 |
3 讨论
超声分子显像与靶向治疗是基于纳米探针的多功能诊疗体系。液态氟碳纳米粒作为一种新型的超声显影剂, 与传统的微泡造影剂相比, 它的粒径更小, 能够穿过新生血管的内皮细胞间隙, 从而可以实现血池外的组织显像, 在超声分子显像中起到至关重要的作用。但是液态氟碳在超声成像中不显影, 需要激发其转变为气态, 才能实现增强超声显像的目的。目前常用作激发相变的有超声和激光两种方法, 即声致相变和光致相变[16-17]。本实验利用光致相变的原理, 即体外通过激光辐照纳米粒, 纳米体系中的光敏剂吸收光能转变为热能, 激发纳米粒中液态氟碳发生液气相转变, 实现增强超声显像的同时又能起到光热治疗的作用。所以没有搭载酞菁锌的纳米体系中, 液态氟碳在激光辐照后温度没有明显的变化, 也没有发生相变, 这说明酞菁锌在光致相变中也起到关键作用。
本研究以VEGFR-2为靶点, 采用碳二亚胺法将VRGFR-2抗体与纳米粒偶联。体外寻靶实验表明靶向纳米粒是通过VEFGR-2介导的通路与HUVECs特异性结合, 具有良好的靶向能力。所以, 靶向纳米粒与新生血管内皮细胞的结合能抑制VEFGR-2介导的信号通路, 拮抗血管内皮生长因子促进血管新生的作用, 诱导内皮细胞的凋亡, 限制肿瘤的生长, 在分子水平发挥治疗作用。实验结果表明不管是增强超声显像还是光热治疗都与纳米粒浓度呈正相关, 靶向纳米粒与HUVECs的结合明显多于非靶向组。所以, 靶向纳米粒能够选择性聚集于新生血管丰富的区域, 在激光辐照下, 纳米粒相变后发生爆破, 对周围细胞产生破坏, 其产生的光热作用能诱导靶点及其周围的细胞的凋亡, 乃至热消融的作用。在整个过程中, 根据靶区的超声增强显像信号强度的变化即可对靶区实时、动态监测以及评价治疗效果, 实现诊疗一体化的目的。
综上所述, 本研究成功制备了靶向新生血管超声增强显像剂及光热治疗为一体的多功能纳米粒, 为进一步体内实验奠定了基础。
| [1] | CAVALLI R, SOSTER M, ARGENZIANO M. Nanobubbles:a promising efficienft tool for therapeutic delivery[J]. Therap Deliv, 2016, 7(2): 117–138. DOI:10.4155/tde.15.92 |
| [2] | GVVENER N, APPOLD L, DE LORENZI F, et al. Recent advances in ultrasound-based diagnosis and therapy with micro-and nanometer-sized formulations[J]. Methods, 2017, 130(2017): 4–13. DOI:10.1016/j.ymeth.2017.05.018 |
| [3] |
王志刚. 超声分子成像研究进展[J].
中国医学影像技术, 2014, 30(8): 1125–1126.
WANG Z G. Progresses of ultrasound molecular imaging[J]. Chin J Med Imaging Technol, 2014, 30(8): 1125–1126. DOI:10.13929/j.1003-3289.2014.08.001 |
| [4] |
王运来. 超声造影的临床应用与前景[J].
中医药管理杂志, 2015, 23(17): 149–150.
WANG Y L. Clinical application and prospect of contrast-enhanced ultrasound[J]. J Tradi Chin Med Manag, 2015, 23(17): 149–150. DOI:10.16690/j.cnki.1007-9203.2015.17.154 |
| [5] | CAMARÉ C, PUCELLE M, NÈGRE-SALVAYRE A, et al. Angiogenesis in the atherosclerotic plaque[J]. Redox Biol, 2017, 12: 18–34. DOI:10.1016/j.redox.2017.01.007 |
| [6] | RUDDY J M, IKONOMIDIS J S, JONES J A. Multidimensional contribution of matrix metalloproteinases to atherosclerotic plaque vulnerability:multiple mechanisms of inhibition to promote stability[J]. J Vasc Res, 2016, 53(1/2): 1–16. DOI:10.1159/000446703 |
| [7] | RAMJIAWAN R R, GRIFFIOEN A W, DUDA D G. Anti-angiogenesis for cancer revisited:is there a role for combinations with immunotherapy?[J]. Angiogenesis, 2017, 20(2): 185–204. DOI:10.1007/s10456-017-9552-y |
| [8] | GREENBERG D A, JIN K. Vascular endothelial growth factors (VEGFs) and stroke[J]. Cell Mol Life Sci, 2013, 70(10): 1753–1761. DOI:10.1007/s00018-013-1282-8 |
| [9] | HSU J Y, WAKELEE H A. Monoclonal antibodies targeting vascular endothelial growth factor[J]. Biodrugs, 2009, 23(5): 289–304. DOI:10.2165/11317600-000000000-00000 |
| [10] | SHANNON A M, BOUCHIERHAYES D J, CONDRON C M, et al. Tumour hypoxia, chemotherapeutic resistance and hypoxia-related therapies[J]. Cancer Treat Rev, 2003, 29(4): 297–307. DOI:10.1016/S0305-7372(03)00003-3 |
| [11] | KHAN I, GOTHWAL A, SHARMA A K, et al. PLGA nanoparticles and their versatile role in anticancer drug delivery[J]. Crit Rev Ther Drug Carrier Syst, 2016, 33(2): 159–193. DOI:10.1615/CritRevTherDrugCarrierSyst.2016015273 |
| [12] | RAPOPORT N. Drug-loaded perfluorocarbon nanodroplets for ultrasound-mediated drug delivery[J]. Adv Exp Med Biol, 2016, 880: 221–241. DOI:10.1007/978-3-319-22536-4_13 |
| [13] | WINTER P M. Perfluorocarbon nanoparticles:evolution of a multimodality and multifunctional imaging agent[J]. Scientifica (Cairo), 2014, 2014: 746574. DOI:10.1155/2014/746574 |
| [14] | BAN Q, BAI T, DUAN X, et al. Noninvasive photothermal cancer therapy nanoplatforms via integrating nanomaterials and functional polymers[J]. Biomater Sci, 2017, 5(2): 190–210. DOI:10.1039/c6bm00600k |
| [15] | CHEN Q, WEN J, LI H, et al. Recent advances in different modal imaging-guided photothermal therapy[J]. Biomaterials, 2016, 106: 144–166. DOI:10.1016/j.biomaterials.2016.08.022 |
| [16] |
肖洋, 冉海涛, 夏琼, 等. 靶向VEGFR-2光声/超声双模态造影剂的制备及体外寻靶实验研究[J].
中国介入影像与治疗学, 2015, 12(9): 554–558.
XIAO Y, RAN H T, XIA Q, et al. Preparation of VEGFR-2 targeted photoacoustic/ultrasound dual mode contrast agent and its targeting study in vitro[J]. Chin J Interv Imaging Ther, 2015, 12(9): 554–558. DOI:10.13929/J.1672-8475.2015.09.009 |
| [17] |
宣吉晴, 陈瑜莉, 敖梦, 等. 携带cRGD肽的靶向纳米粒超声造影剂的制备以及体外寻靶实验研究[J].
中国医学影像技术, 2017, 33(6): 811–815.
XUAN J Q, CHEN Y L, AO M, et al. Experimental study on preparation and targeting research in vitro of targeted nanoparticle ultrasound contrast agent carrying cRGD[J]. Chin J Med Imaging Technol, 2017, 33(6): 811–815. DOI:10.13929/j.1003-3289.201702043 |



