2. 550002 贵阳,贵州省人民医院眼科
2. Department of Ophthalmology, Guizhou Provincial People's Hospital, Guiyang, Guizhou Province, 550002, China
角膜是透明且无血管的组织。在致病因素如感染、严重外伤等的作用下,新生的毛细血管从角膜缘血管网生长并侵入角膜,形成角膜新生血管(corneal neovascularization, CorNV)。研究表明角膜透明性的维持依靠低水平的促血管因子和高水平的抗血管因子,打破了抗血管因子和促血管因子的平衡,促血管因子增多,导致CorNV产生[1]。MicroRNA(miRNA)是一类非编码小分子RNA,他们与靶基因相结合后使其mRNA发生降解或抑制其翻译来调控基因的表达。多项研究提示microRNA可调控血管新生的关键基因[2]。如miRNA-221/222、miRNA-126、miRNA-143等是在血管内皮细胞中表达较高的miRNA,它们可通过血管内皮生长因子(vascular endothelial growth factor, VEGF)等多种信号通路调节血管新生[3]。许多研究结果显示microRNAs在调节眼部新生血管方面起到重要作用[4-5]。VEGF的异常增高是促进眼表新生血管的主要因素,阻断VEGF可有效抑制CorNV的形成[6]。本课题组在前期的研究中利用缝线法诱导SD大鼠CorNV,采取LAN MicroRNA基因芯片技术,对CorNV与正常角膜表达谱进行微阵列分析,筛选出差异表达的MicroRNA。其中与VEGF信号通路密切相关的就有miRNA-142-5p[7]。ISHIDA等[8]应用微阵列和RT-PCR检测自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)大鼠,提示miRNA-142-5p在EAU的进展期明显增高。在对真菌性角膜炎患者的角膜行基因芯片筛选及RT-PCR检测中亦发现miRNA-142-5p表达升高[9]。然而,miRNA-142-5p是否参与CorNV的发生发展,至今鲜有报道。本研究通过缝线法诱导CorNV形成,观察miRNA-142-5p及VEGF在CorNV的变化。选用HUVECs作为研究CorNV及VEGF的细胞模型,以期进一步探索miRNA-142-5p在CorNV形成中的作用及可能机制。
1 材料与方法 1.1 实验动物及细胞健康SPF级SD大鼠6只,体质量为180~220 g,雌性,由重庆医科大学动物中心提供[实验动物使用合格号:SCXK(渝2007-0001)]。所有实验操作遵守重庆医科大学伦理委员会发布的伦理及管理指南。实验前使用裂隙灯检查大鼠双眼,排除角膜瘢痕、新生血管等疾病,动物饲养于SPF级动物房。HUVECs细胞系购自上海美轩生物有限公司。HUVECs在含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI1640培养基中进行培养。取5~15代细胞用作实验。
1.2 主要试剂RPMI1640培养基、胎牛血清及胰蛋白酶消化液均购自HyClone,CCK-8试剂盒购自Bryotime,细胞转染试剂(Lipo-2000)购自Invitrogen。miRNA qPCR试剂盒购自Genecopoeia,PrimeScriptTM RT reagent Kit及SYBR? Premix Ex TaqTMⅡ购自TaKaRa。兔抗人单克隆抗体PI3K、AKT、p-AKT购自cell signaling。兔抗人VEGF多克隆抗体购自proteintech。Matrigel胶购自BD,Transwell培养板购自Corning。miRNA-142-5p mimic及无关序列(NC)由Gene Pharma合成。
1.3 建立CorNV模型及RT-PCR检测miRNA-142-5p和VEGF mRNA的表达6只SD大鼠经腹腔注射10%水合氯醛(3.5 mL/kg)麻醉,右眼滴0.04%盐酸奥布卡因眼液后,在显微镜下用10-0尼龙线穿过角膜基质层间断缝合四针(12、3、6、9点方向),距角膜缘2mm(圆规尺定位)向瞳孔方向进针,左眼不作处理。右眼每日滴盐酸林可霉素眼液3次,在电筒光源下观察缝线有无脱落,若出现缝线脱落,及时原位或相邻处补针。由于各种原因造成术后感染、前房积血、缝线脱落>2次者视为CorNV造模失败,剔除出实验组并及时添补动物。角膜缝线后第7天,将模型组和正常组角膜提取总RNA行RT-PCR。RNA逆转录为cDNA后SYBR GREEN法行RT-PCR检测miRNA-142-5p、VEGF mRNA的表达(引物由Genecopoeia公司合成,序列保密)。分别用U6、β-actin作为miRNA-142-5p和VEGF内参。记录每个孔的CT值,使用2-ΔΔCT计算两组结果。
1.4 细胞转染及转染效率的检测HUVECs培养至细胞融合率50%~60%进行转染。实验分为3组:miRNA-142-5p mimic+Lipo-2000组(MU组);miRNA142-5p NC+Lipo-2000(NC组);正常空白对照组(CON组)。测试几种转染浓度:30、50、100 nm及200 nm,发现转染浓度在100 nm时转染效果最佳且对细胞无明显抑制作用。故所有实验转染浓度均为100 nm。用Opti-MEM培养基分别稀释适当量的miRNA-142-5p mimic/NC和Lipo2000,混匀后各自在室温下静置5 min后再将两者共同孵育20 min,使之形成转染复合体,然后将该转染复合体加入培养板中,轻轻混匀。转染miRNA-142-5p mimic序列:正义链5′-UAGCUUAUCAGACUGAUGUUGA-3′, 反义链3′-AA-CAUCAGUCUGAUAAGCUAUU-5′。转染NC序列:正义链5′-UUCUCCGAACGUGUCACGUTT-3′, 反义链3′-ACGUGACACGUUCGGAGAATT-5′。转染24 h后提取3组细胞的总RNA。逆转录为cDNA后SYBR GREEN法行RT-PCR检测miRNA-142-5p的表达量(引物由Genecopoeia公司合成,序列保密)。
1.5 CCK-8法检测细胞增殖能力取96孔板按5 000个/孔接种HUVECs。细胞完全贴壁后按上述方法进行转染(n=6),转染24 h后每孔加入10 μL CCK-8试剂,继续培养1~2 h后测量在波长450 nm处的光密度值,观察各组细胞增殖能力的变化。
1.6 Transwell实验检测HUVECs的迁移能力HUVECs接种于6孔板中,待细胞融合至50%~60%进行转染(n=6)。24 h后胰酶消化并用无血清培养基重悬细胞。以1×105/孔接种于Transwell上室,下室加入含l5%FBS的RPMI1640培养基。培养24 h后取出小室,棉签擦去上室内没有进入下室的细胞。4%多聚甲醛固定30min后结晶紫染色20 min。然后用磷酸盐缓冲液(PBS)冲洗、晾干,随机观察5个显微镜视野范围内的细胞(×50)并记数。
1.7 Matrigel胶成管实验检测HUVECs的成管能力96孔板中加入80 μL Matrigel胶使其均匀铺在底部,37 ℃孵育1 h使胶凝固。将转染24 h后的各组细胞消化后重悬细胞,铺好Matrigel胶的96孔板中按6×104/孔接种细胞(n=6),培养6~8 h后在显微镜下(×100)观察管腔形成情况。
1.8 RT-PCR检测各目的基因mRNA的表达按照前述方法于转染后24 h提取各组HUVECs总RNA,逆转录成cDNA,SYBR Green法行RT-PCR检测VEGF及PI3K/AKT mRNA的表达水平。反应以β-actin为内参。记录每孔CT值,并采用2-ΔΔCT法对获得的结果进行分析,实验重复3次。
1.9 蛋白免疫印迹法(Western blot)检测VEGF/PI3K/AKT在蛋白水平的表达转染48 h后收集细胞提取总蛋白,定量,变性后,利用免疫印迹法检测VEGF/PI3K/AKT及磷酸化p-akt的表达。以β-actin作为内参。应用Gel-Pro Analyzer软件测量每一条带的面积和灰度值,计算各组与内参β-actin灰度的比值从而获得每组各蛋白的相对表达水平,实验重复3次。
1.10 统计学方法采用SPSS 19.0统计软件进行分析,计量资料以x±s表示。各组实验数据的均值经Kolmogorov-Smimov检验皆呈正态分布,各组间均数经Levene检验方差齐。正常角膜组及角膜缝线后7 d组的RT-PCR数据采用独立样本t检验。MU、NC、CON多组间的比较采用单因素方差分析(ANVOA),组间两两比较采用LSD-t检验,检验水准α=0.05。
2 结果 2.1 缝线法诱导CorNV及miRNA-142-5p表达正常SD大鼠的角膜缘可见血管围绕,但不侵入角膜。缝线后2 d角膜缘血管网扩张,缝线处轻度水肿,4 d时可见从角膜缘伸入角膜的毛刷状小血管、角膜水肿程度加重;7 d时新生血管顶端出现分叉,部分CorNV生长达缝线处、角膜水肿明显加重。14 d时CorNV超过缝线,分支密集形成袢状血管网,血管粗大。21 d时仍有少数CorNV向角膜中央生长,但血管明显变细及稀疏。缝线法能成功诱导形成CorNV(图 1)。采用缝线后7 d和正常角膜提取总RNA行RT-PCR检测miRNA-142-5p的表达,结果显示:缝线后7 d组miRNA-142-5p表达量2-ΔΔCT为6.799±1.683,高于正常角膜组(1.012±0.085),差异具有统计学意义(P < 0.01)。而VEGF表达量7 d组2-ΔΔCT为3.297±0.334,较正常角膜组(1.013±0.823)增高,差异具有统计学意义(P < 0.01)。
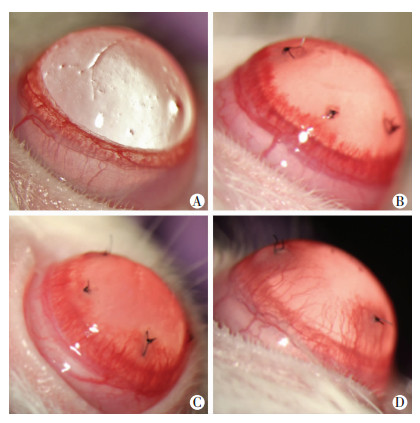
|
| A:正常SD大鼠的角膜缘可见血管呈环状围绕,但不侵入角膜;B:4 d时可见从角膜缘伸入角膜的毛刷状小血管、角膜水肿;C:7 d时新生血管顶端分叉,部分新生血管生长至达缝线处、角膜水肿明显加重;D:14 d时新生血管超过缝线位置,分支密集形成袢状血管网,血管粗大,角膜水肿较前有所减轻 图 1 裂隙灯下观察缝线法诱导CorNV模型 (×16) |
2.2 miRNA-142-5p在HUVECs的表达
HUVECs转染24 h后MU组miRNA-142-5p的表达量(61.092±11.245)相对NC组(1.079±0.065)及CON组(1.125±0.162)明显上调,差异有统计学意义(P < 0.01),NC组和CON组之间则差异不明显(P>0.05)。
2.3 Transwell实验检测细胞迁徙能力Transwell结果显示MU组穿透基底膜从上室移动 到下室的细胞数(141.833±12.139)与NC组(65.167± 7.083)和CON组(66.500±4.764)比较明显增加,差异有统计学意义(P < 0.01),而NC组和CON组之间差异无统计学意义(P>0.05)。
2.4 miRNA-142-5p对HUVECs增殖能力的影响HUVECs经转染24 h后分别加入CCK-8试剂进行检测,并在450 nm波长下检测各孔的光密度值。统计结果显示MU组(1.567±0.010)与NC组(1.094±0.002)和CON组(1.102±0.073)相比,差异有统计学意义(P < 0.01),而NC组和CON组相比则无明显差异(P>0.05)。
2.5 Matrigel胶成管实验检测细胞的成管能力成管实验结果显示:MU组管腔形成的数量(8.200±0.837)较CON组(6.000±1.000)和NC组(5.800±0.700)明显增加,差异有统计学意义(P < 0.01)。而NC与CON组比较,差异无统计学意义(P>0.05,图 2)。

|
| A~C:分别为MU组、NC组、正常空白对照组 图 2 管腔成形实验检测miRNA-142-5p对HUVECs成管能力的影响 |
2.6 MiRNA-142-5p对VEGF、PI3K及AKT mRNA表达的影响
RT-PCR结果显示MU组VEGF、PI3K及AKT mRNA的表达量与CON及NC组比较明显提高,差异具有统计学意义(P < 0.01),而NC组和CON组之间无明显差异(P>0.05,图 3)。
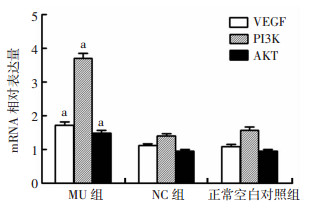
|
| a: P < 0.01, 与NC和CON组比较 图 3 miR-142-5p mimic转染后VEGF/PI3K/AKT mRNA的表达 |
2.7 miR-142-5p对VEGF/PI3K/AKT通路各蛋白表达的影响
Western blot结果显示MU组VEGF/PI3K/AKT/p-AKT蛋白表达明显增多。与NC及CON组比较,差异有统计学意义(P < 0.05),而NC及CON组之间无明显差异(P>0.05,图 4)。
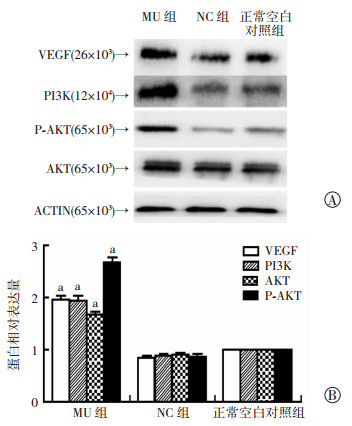
|
| A:Western blot检测结果;B:半定量分析结果a:P < 0.01,与NC和CON组比较 图 4 Western blot检测miR-142-5p对VEGF/PI3K/AKT/P-AKT蛋白表达的影响 |
3 讨论
CorNV使角膜失去透明性并损害视力,在发达国家,眼部新生血管性疾病是致盲的主要原因[10]。CorNV的发生、发展包括了血管内皮基底膜降解、内皮细胞的增殖、迁移、管腔形成等一系列过程[11],VEGF在CorNV的形成中起到关键的作用。研究发现,miRNA与眼部疾病的发生、发展密切相关[12]。本研究利用缝线法诱导CorNV形成,CorNV生长良好,能较好地模拟CorNV的病理过程,目前已被广泛应用[13-14]。在ZHANG等[15]的研究中,运用llumina miRNA基因芯片对碱烧伤CorNV模型进行筛选,结果亦提示miR-142-5p显著上调,与本课题组前期的研究结果一致。RT-PCR结果表明在正常大鼠角膜组织,miRNA-142-5p及VEGF有少量表达,而在CorNV中miR-142-5p及VEGF的表达量明显上升,提示miRNA-142-5p可能参与CorNV的发生、发展。miRNA-142位于染色体17q22,在脾脏、胸腺以及B+细胞T+细胞中表达丰富[16]。多项研究发现在肝癌、肺癌中miRNA-142-5p表达下降以及对肿瘤细胞有抑制作用[17-18]。然而,对于miRNA-142-5p在内皮细胞中的作用所知甚少。目前有研究发现在人外周血液内皮祖细胞中miRNA-142-5p促进VEGF的表达[16]。KEE等[19]研究发现在大鼠颈动脉受损模型中miRNA-142-5p升高以及miRNA-142-5p促进血管平滑肌细胞的增殖。在本研究中,我们发现上调miRNA-142-5p使HUVECs的增殖、迁移和成管能力明显提高,这些结果为miRNA-142-5p在调控血管新生方面提供了新的见解。
VEGF下游多条信号通路中的PI3K/AKT作为新生血管发生、发展的经典通路受到高度的关注。VEGF通过激活PI3K/AKT信号通路,促进血管内皮细胞的增殖、迁徙以及加速管腔形成等[20]。现已发现多种miRNAs参与调节PI3K/AKT通路来影响新生血管的发生、发展。那么在CorNV中是否可以通过这一信号通路来调控新生血管的发生发展呢?HUVECs是目前对CorNV及VEGF研究最常用的细胞模型[12, 21]。为此,本研究选取HUVECs作为研究CorNV的细胞模型,RT-PCR结果提示转染后miRNA-142-5p上调了几十倍,表明转染效率高,这为短时间内miRNA-142-5p在细胞内发挥其生物学作用提供了支持。此外,本研究分别检测了VEGF和PI3K/AKT通路各主要成员的mRNA和蛋白表达情况。结果显示,MU组的VEGF和PI3K/AKT通路各主要成员的mRNA及蛋白表达量明显上升,尤其是AKT的磷酸化水平显著上升。在预实验中我们发现HUVECs中miRNA-142-5p的基础量较低,转染inhibitor对miRNA-142-5p的下调不显著,故本研究没有进行下调miRNA-142-5p的实验。
综上所述,CorNV中miRNA-142-5p及VEGF上调,提示miRNA-142-5p参与CorNV的发生、发展。过表达miRNA-142-5p提高HUVECs的增殖、侵袭和管腔成形能力,其机制可能与VEGF表达升高并介导PI3K/AKT通路各成员间的级联作用有关,这可能也是miRNA-142-5p调节CorNV发生、发展的主要机制。
| [1] | DAYA S M, ILARI F A. Living related conjunctival limbal allograft for the treatment of stem cell deficiency[J]. Ophthalmology, 2001, 108(1): 126–133. DOI:10.1016/S0161-6420(00)00475-9 |
| [2] | VAN SOLINGEN C, SEGHERS L, BIJKERK R, et al. Antagomir-mediated silencing of endothelial cell specific microRNA-126 impairs ischemia-induced angiogenesis[J]. J Cell Mol Med, 2009, 13(8A): 1577–1585. DOI:10.1111/j.1582-4934.2008.00613.x |
| [3] | YUE J. miRNA and Vascular Cell Movement[J]. Adv Drug Deliv Rev, 2011, 63(8): 616–622. DOI:10.1016/j.addr.2011.01.001 |
| [4] | ZHOU Q, GALLAGHER R, UFRET-VINCENTY R, et al. Regulation of angiogenesis and choroidal neovascularization by members of microRNA-23~27~24 clusters[J]. PNAS, 2011, 108(20): 8287–8292. DOI:10.1073/pnas.1105254108 |
| [5] | SUNDERMEIER T R, PALCZEWSKI K. The physiological impact of microRNA gene regulation in the retina[J]. Cell Mol Life Sci, 2012, 69(16): 2739–2750. DOI:10.1007/s00018-012-0976-7 |
| [6] | KRIZOVA D, VOKROJOVA M, LIEHNEOVA K, et al. Treatment of corneal neovascularization using anti-VEGF bevacizumab[J]. J Ophthalmol, 2014, 2014: 178132. DOI:10.1155/2014/178132 |
| [7] |
毛旖旎, 胡雁, 侯胜平, 等. 大鼠角膜缘新生血管微小RNA与血管内皮生长因子相关性分析[J].
重庆医科大学学报, 2014, 39(8): 1090–1094.
MAO Y N, HU Y, HOU S P, et al. Correlation between microRNA expression profiles and VEGF of corneal neovascularization in rats[J]. J Chongqing Med Uni, 2014, 39(8): 1090–1094. DOI:10.13406/j.cnki.cyxb.000324 |
| [8] | ISHIDA W, FUKUDA K, HIGUCHI T, et al. Dynamic changes of microRNAs in the eye during the development of experimental autoimmune uveoretinitis[J]. Invest Ophthalmol Vis Sci, 2011, 52(1): 611–617. DOI:10.1167/iovs.10-6115 |
| [9] | BOOMIRAJ H, MOHANKUMAR V, LALITHA P, et al. Human Corneal MicroRNA Expression Profile in Fungal Keratitis[J]. Invest Ophthalmol Vis Sci, 2015, 56(13): 7939–7946. DOI:10.1167/iovs.15-17619 |
| [10] | CHANG J H, GABISON E E, KATO T, et al. Corneal neovascularization[J]. Curr Opin Ophthalmol, 2001, 12(4): 242–249. DOI:10.1097/00055735-200108000-00002 |
| [11] | BACHMANN B O, LUETJEN-DRECOLL E, BOCK F, et al. Transient postoperative vascular endothelial growth factor (VEGF)-neutralisation improves graft survival in corneas with partly regressed inflammatory neovascularisation[J]. Br J Ophthalmol, 2009, 93(8): 1075–1080. DOI:10.1136/bjo.2008.145128 |
| [12] | PARK J K, PENG H, YANG W, et al. miR-184 exhibits angiostatic properties via regulation of Akt and VEGF signaling pathways[J]. FASEB J, 2017, 31(1): 256–265. DOI:10.1096/fj.201600746R |
| [13] | ZONG R, ZHOU T, LIN Z, et al. Down-Regulation of MicroRNA-184 Is Associated With Corneal Neovascularization[J]. Invest Ophthalmol Vis Sci, 2016, 57(3): 1398–1407. DOI:10.1167/iovs.15-17417 |
| [14] | ZHOU T, CHEN L, HUANG C H, et al. Serine Proteinase Inhibitor SERPINA3K Suppresses Corneal Neovascularization via Inhibiting Wnt Signaling and VEGF[J]. Invest Ophthalmol Vis Sci, 2014. DOI:10.1167/iovs.14-14023 |
| [15] | ZHANG Y, ZHANG T, MA X, et al. Subconjunctival injection of antagomir-21 alleviates corneal neovascularization in a mouse model of alkali-burned cornea[J]. Oncotarget, 2017, 8(7): 11797–11808. DOI:10.18632/oncotarget.14370 |
| [16] | ZHANG H W, LI H, YAN H, et al. MicroRNA-142 promotes the expression of eNOS in human peripheral blood-derived endothelial progenitor cells in vitro[J]. Eur Rev Med Pharmacol Sci, 2016, 20(19): 4167–4175. |
| [17] | LOU K, CHEN N, LI Z, et al. MicroRNA-142-5p Overexpression Inhibits Cell Growth and Induces Apoptosis by Regulating FOXO in Hepatocellular Carcinoma Cells[J]. Oncol Res, 2017, 25(1): 65–73. DOI:10.3727/096504016X14719078133366 |
| [18] | SU Y H, ZHOU Z, YANG K P, et al. MiR-142-5p and miR-9 may be involved in squamous lung cancer by regulating cell cycle related genes[J]. Eur Rev Med Pharmacol Sci, 2013, 17(23): 3213–3220. |
| [19] | KEE H J, PARK S, KWON J S, et al. B cell translocation gene, a direct target of miR-142-5p, inhibits vascular smooth muscle cell proliferation by down-regulating cell cycle progression[J]. FEBS Lett, 2013, 587(15): 2385–2392. DOI:10.1016/j.febslet.2013.06.005 |
| [20] | MATTHAEI M, HU J, KALLAY L, et al. Endothelial cell microRNA expression in human late-onset Fuchs' dystrophy[J]. Invest Ophthalmol Vis Sci, 2014, 55(1): 216–225. DOI:10.1167/iovs.13-12689 |
| [21] | FERLA R, Bonomi M, OTVOS L, et al. Glioblastoma-derived Leptin Induces Tube Formation and Growth of Endothelial Cells: Comparison with VEGF Effects[J]. BMC Cancer, 2011, 11: 303. DOI:10.1186/1471-2407-11-303 |



