2. 400016 重庆,重庆医科大学附属第一医院:骨科
2. Department of Orthopaedics, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
椎间盘退变产生的诸多脊柱退行性疾病是导致腰背部疼痛的主要原因。虽然椎间盘退变的具体机制目前尚不完全清楚,但越来越多的研究结果表明髓核细胞过度凋亡在椎间盘退变进程中扮演着重要的角色[1-6]。由此可见,如何更好地抑制髓核细胞过度凋亡将为延缓椎间盘退变提供新的治疗手段。血红素氧合酶(heme oxygenase,HO)是血红素降解的限速酶,已知HO有3种同工酶,其中HO-1广泛分布于哺乳动物多种组织细胞中,可由多种刺激因子诱导表达,如氧化应激、热休克及内毒素等。目前研究显示HO-1具有抗氧化、抗炎、抗凋亡、信号传导和免疫调节以及抑制黏附分子表达活性等作用,并证实其在诸多疾病中具有保护或延缓病程进展的功能[6-7]。近期研究显示,HO-1能够逆转白介素1β(interleukin-1 beta,IL-1β)引起的人关节软骨细胞外基质降解[8],并能减弱IL-1β对人椎间盘细胞合成分解代谢的抑制作用[9]。这些结果都显示HO-1也许在人椎间盘退变进程中扮演着重要的角色。有学者研究发现HO-1可以通过抑制小鼠肝脏细胞的凋亡,从而阻止非酒精性脂肪性肝炎的进展[10];亦有报道称HO-1可以明显抑制心肌干细胞的凋亡[11],而目前有关HO-1对人椎间盘髓核细胞凋亡的作用尚不清楚。核转录因子kappa B(nuclear factor-kappa B,NF-κB)在细胞损伤、应力及炎症反应的应答中都起着重要的作用。已有证据表明NF-κB信号通路在椎间盘髓核细胞凋亡过程中扮演着重要的作用[12-13]。目前,对于HO-1是否能够调控人椎间盘退变过程中髓核细胞的凋亡以及NF-κB是否参与了这个过程并没有明确的答案。本研究拟探讨HO-1对人退变髓核细胞凋亡的作用及可能的分子机制,以期为椎间盘退变性疾病的预防和治疗提供新的思路。
1 材料与方法 1.1 材料所有标本取自2015年8月至2016年8月在重庆医科大学附属第一医院骨科行腰椎手术的患者。正常的椎间盘髓核组织及细胞取自6例因腰椎骨折(lumbar vertebral fracture,LVF)行腰椎手术治疗的年轻患者(LVF组),年龄24~35岁,平均年龄31.3岁,其中男性4例,女性2例。根据Pfirrmann退变椎间盘矢状位MRI分级标准[14],6例均为0~Ⅰ级表现。退变的椎间盘髓核组织及细胞取自10例因椎间盘退变性疾病(intervertebral disc degeneration,IDD)行腰椎手术的中老年患者(IDD组),年龄45~63岁,平均年龄52.4岁,其中男性5例,女性5例;Pfirrmann分级均为Ⅲ~Ⅳ级。患者均签署知情同意书。本研究经医院伦理委员会批准(2015)。
DMEM/F12培养基(HyClone,USA),胎牛血清(Gibco,USA),Ⅱ型胶原酶(COLLA2α1)、PDTC(Sigma,USA),TUNEL试剂盒(Roche,Switzerland),HO-1抗体、p-P65抗体、P65抗体、Bax抗体、Bcl-2抗体、Active caspase-3抗体(Abcam,USA),LV-HO-1、LV-NC慢病毒、HO-1-siRNA、negative control-siRNA以及siRNA专用转染试剂(Invitrogen,USA)。
1.2 髓核组织的获取及髓核细胞的分离、培养将在术中取得的无菌髓核组织放入含有10%胎牛血清的DMEM/F12培养基中,冰盒保存带回实验室立即处理。将仔细洗净的髓核组织分为3份,一份用于石蜡包埋,一份用于提取总蛋白,一份用于原代细胞培养。用眼科剪将其剪成1 mm3大小碎块,依次用0.25%胰酶和0.2%Ⅱ型胶原酶在37 ℃恒温水浴中消化30 min、4 h。200目细胞筛过滤、离心(1 000 r/min)取细胞沉淀。细胞以5×105 /mL种植于培养瓶中,用含20%胎牛血清的DMEM/F12培养基培养。
1.3 免疫组织化学检测将分离、PBS洗净的髓核组织固定在4%多聚甲醛中24 h后常规石蜡包埋,然后切成4 μL的薄片用于免疫组化检测。石蜡薄片常规脱蜡、水化后加入3% H2O2室温孵育10 min,PBS液清洗(5 min/次,3次)。5%BSA封闭液阻断,室温20 min,甩干,加入适当浓度HO-1(1:500)、p-P65(1:500)一抗,4 ℃过夜。PBS洗涤(5 min/次,3次),加入羊抗兔IgG二抗(1:5 000),37 ℃孵育30 min,PBS液冲洗(5 min/次,3次)。滴加链霉卵白素+辣根酶标记生物素,室温孵育30 min,PBS冲洗(5 min/次,3次)。DAB显色,蒸馏水洗涤,苏木精复染。脱水、透明、常规封片。阴性对照以一抗稀释液代替一抗。
1.4 TUNEL检测将石蜡切片进行常规脱蜡、水合,3%H2O2消除内源性过氧化物酶活性后PBS洗涤(5 min/次,3次),加入蛋白酶K工作液(20 μg/mL),30 min,PBS洗涤(5 min/次,3次)。每张切片加入TUNEL反应混合物50 μL,37 ℃孵育60 min后PBS洗涤(5 min/次,3次)。每张切片加入50 μL POD工作液,37 ℃孵育30 min,PBS洗涤(5 min/次,3次)。DAB显色,苏木精复染。脱水、透明、常规封片。
1.5 总蛋白提取及Western blot检测髓核组织总蛋白:将髓核组织在冰面上用匀浆器匀浆后加入细胞裂解液30 min;细胞总蛋白:胰酶消化离心收集细胞,PBS洗涤3次,加入细胞裂解液,冰上反应30 min。离心收集蛋白上清。BCA法测定蛋白质浓度,等量蛋白质样品进行SDS-PAGE电泳,电转至PVDF膜,5%脱脂牛奶室温下封闭1 h,一抗4 ℃孵育过夜,TBST液洗涤(10 min /次,3次);辣根过氧化物酶标记的二抗室温孵育1 h,TBST液洗涤(10 min/次,3次),ECL显色。常规压片,照相。
1.6 LV-HO-1、si-RNA转染人退变髓核细胞将P2代人退变的髓核细胞以1×106/孔接种至6孔板后培养24 h,然后参照相应说明书分别对LV-HO-1、LV-NC、si-RNA、NC-siRNA进行转染操作。
1.7 流式检测细胞凋亡率0.25%胰酶消化离心收集细胞,PBS洗涤3次,结合缓冲液重悬细胞,Annexin V-FITC和PI室温、避光条件下孵育细胞10~15 min,1 h内用FACS Calibur流式细胞仪(BD公司,美国)检测凋亡率的变化情况。早期凋亡细胞为Annexin V+,PI-;晚期凋亡细胞为Annexin V+,PI+。对早、晚期凋亡细胞共同计数。
1.8 统计学分析采用SPSS 17.0统计软件,计量资料数据以x±s表示,组间差异采用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 HO-1、p-P65在正常、退变人椎间盘髓核中的表达免疫组化结果显示,HO-1在退变髓核IDD组中的阳性表达率为(18.58±0.59)%,明显低于正常髓核LVF组(58.26±2.48)%(P < 0.05),而p-P65在退变髓核IDD组中的阳性表达率为(40.27±2.03)%,明显高于正常髓核LVF组(19.75±1.98)%(P < 0.05,图 1)。TUNEL结果(图 2)显示IDD组中髓核细胞凋亡率为(48.18±1.78)%,而LVF组中髓核细胞凋亡率为(19.56±1.26)%。Western blot检测结果也证实IDD组HO-1蛋白表达明显低于LVF组,p-P65蛋白表达明显高于LVF组(图 3)。
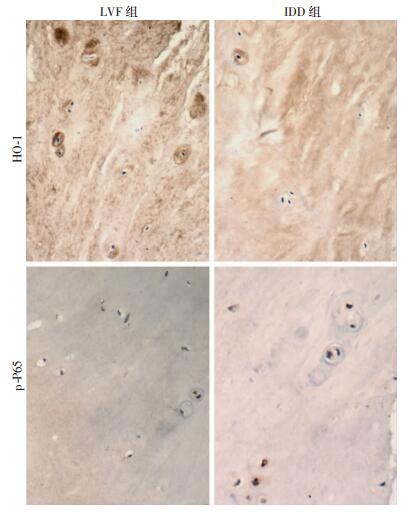
|
| 图 1 免疫组化检测LVF组和IDD组中髓核细胞HO-1、p-P65表达差异(SABC ×200) |
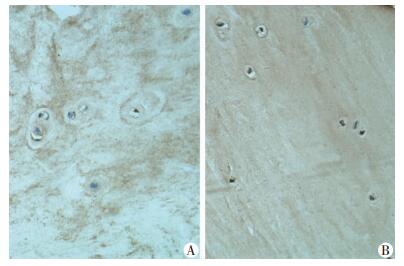
|
| 图 2 TUNEL检测LVF组(A)和IDD组(B)中髓核细胞凋亡表达(×200) |
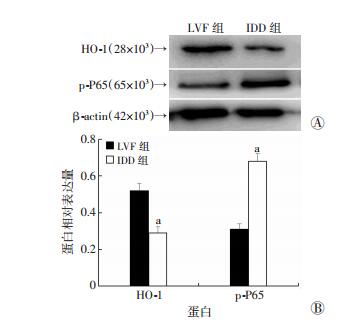
|
| A:Western blot检测结果;B:半定量分析结果a:P < 0.05,与LVF组比较 图 3 Western blot检测LVF组和IDD组中HO-1、p-P65蛋白表达 |
2.2 IL-1β促进人退变髓核细胞凋亡
为了阐明NF-κB和髓核细胞凋亡的关系,首先用IL-1β (10 ng/mL)处理髓核细胞,24 h后做相关检测。Western blot检测结果显示IL-1β能明显上调凋亡相关基因Bax、Cleaved caspase-3及p-P65的蛋白表达水平(P < 0.05),同时明显降低抗凋亡基因Bcl-2的蛋白表达水平(P < 0.05,图 4)。流式检测结果(图 5)显示对照组髓核细胞凋亡率为(6.12±1.88)%,10 ng/mL IL-1β组髓核细胞凋亡率为(19.92±1.16)%。这证实IL-1β能有效促进人退变髓核细胞凋亡,而P65信号通路参与了此过程。

|
| A: Western blot检测对照组和IL-1β组中p-P65、Bax、Bcl-2及Cleaved caspase-3的表达;B:半定量分析结果a:P < 0.05,与对照组比较 图 4 Western blot检测IL-1β对人退变髓核细胞凋亡的作用 |
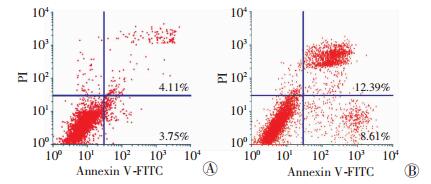
|
| A:对照组:B:IL-1β组 图 5 流式细胞仪检测对照组和IL-1β组髓核细胞凋亡率 |
2.3 HO-1抑制IL-1β诱导的人退变髓核细胞凋亡
Western blot检测结果表明,LV-HO-1能明显上调髓核细胞HO-1蛋白表达水平,HO-1-siRNA能明显抑制髓核细胞HO-1蛋白表达水平(P < 0.05,图 6A)。
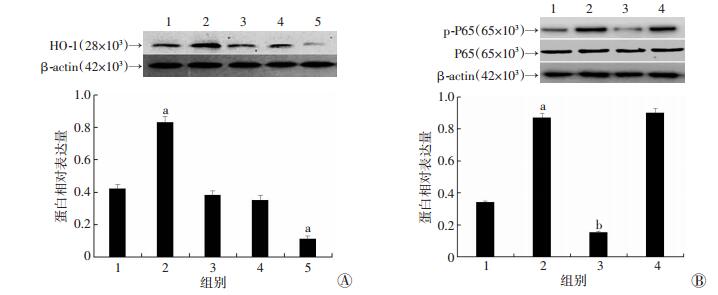
|
| A:Western blot检测各组HO-1的表达及半定量分析结果1:对照组;2:LV-HO-1组;3:LV-NC组;4:NC-siRNA组;5:HO-1-siRNA组;a:P < 0.05,与对照组比较;B:Western blot检测各组p-P65的表达及半定量分析结果1:对照组;2:IL-1β组;3:IL-1β+LV-HO-1组;4:IL-1β+HO-1-siRNA组;a:P < 0.05,与对照组比较;b:P < 0.05,与IL-1β组比较 图 6 Western blot检测HO-1抑制IL-1β诱导的人退变髓核细胞凋亡 |
IL-1β(10 ng/mL)预处理退变髓核细胞诱导其凋亡的情况下,分别用LV-HO-1和HO-1-siRNA处理髓核细胞,验证HO-1对髓核细胞凋亡信号通路的影响。Western blot检测结果显示:IL-1β组髓核细胞p-P65蛋白水平明显增高(P < 0.05),LV-HO-1+IL-1β组p-P65蛋白表达较对照组及单纯IL-1β组明显降低(P < 0.05),HO-1-siRNA+IL-1β组p-P65蛋白表达较对照组明显升高(P < 0.05),与单纯IL-1β组比较p-P65蛋白水平略有升高,但差异无统计学意义(P>0.05,图 6B)。这表明HO-1能够逆转IL-1β对髓核细胞P65信号通路的抑制作用。
流式细胞仪检测结果显示:对照组凋亡率为(5.04± 0.56)%,IL-1β组凋亡率为(21.25±2.67)%,IL-1β+LV-HO-1组凋亡率为(14.24±1.87)%,IL-1β+HO-1-siRNA组凋亡率为(33.34±2.78)%。这说明IL-1β能使髓核细胞凋亡率明显增加(P < 0.05),HO-1-siRNA处理后髓核细胞凋亡率增加得更加明显(P < 0.05),而LV-HO-1能明显抑制IL-1β诱导的髓核细胞凋亡(P < 0.05,图 7)。这表明HO-1能够挽救IL-1β诱导的髓核细胞凋亡。

|
| 图 7 流式细胞仪检测对照组(A)、IL-1β组(B)、IL-1β+LV-HO-1组(C)、IL-1β+HO-1-siRNA组(D)髓核细胞凋亡率 |
2.4 HO-1通过抑制P65磷酸化抑制退变髓核细胞凋亡
以上实验结果已经证明P65信号通路参与了IL-1β诱导的髓核细胞凋亡,而HO-1能够挽救IL-1β诱导的髓核细胞凋亡。为了进一步明确HO-1是否通过抑制P65磷酸化从而挽救IL-1β诱导的髓核细胞凋亡,我们采用NF-κB信号通路抑制剂PDTC(10 μmol/L,24 h)处理髓核细胞抑制P65磷酸化,观察在IL-1β/ HO-1-siRNA处理髓核细胞情况下髓核细胞凋亡率变化的情况。Western blot检测结果显示IL-1β(10 ng/mL)能够明显增加P65磷酸化蛋白表达,但当用PDTC(10 μmol/L,24 h)处理髓核细胞后,无论是否添加HO-1-siRNA,P65磷酸化蛋白水平明显降低(P < 0.05,图 8)。流式细胞仪检测结果显示:IL-1β组、HO-1-siRNA+IL-1β组、PDTC+IL-1β组、HO-1-siRNA+PDTC+ IL-1β组髓核细胞凋亡率分别为(21.23±2.15)%、(31.53±3.67)%、(12.85±1.96)%、(11.34± 1.52)%(图 9)。这表明HO-1对人退变髓核细胞凋亡的保护作用是通过抑制NF-κB信号通路实现的。
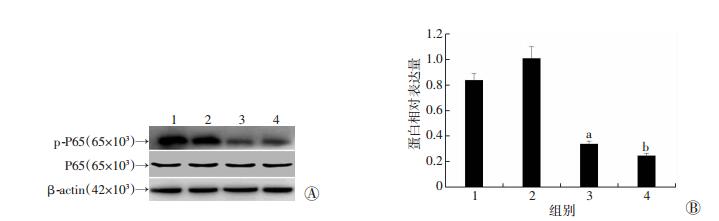
|
| 1:IL-1β组;2:HO-1-siRNA+IL-1β组;3:PDTC+ IL-1β组;4:HO-1-siRNA+ PDTC+IL-1β组A:Western blot检测结果;B:半定量分析结果a:P < 0.05,与IL-1β组比较;b:P < 0.05,与HO-1-siRNA+IL-1β组比较 图 8 Western blot检测HO-1通过抑制P65磷酸化抑制退变髓核细胞凋亡 |
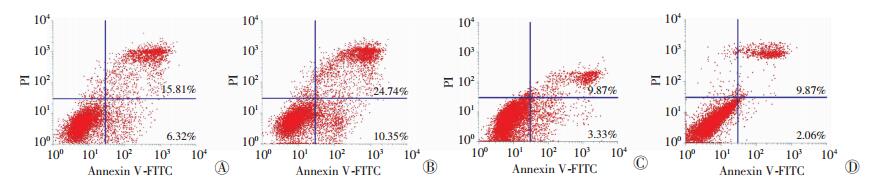
|
| 图 9 流式细胞仪检测IL-1β组(A)、HO-1-siRNA+IL-1β组(B)、PDTC+IL-1β组(C)、HO-1-siRNA+PDTC+IL-1β组(D)髓核细胞凋亡率 |
3 讨论
椎间盘髓核细胞过度凋亡在椎间盘退行性疾病进程中扮演着重要的角色。人椎间盘由中间的髓核、周围的纤维环及两端的软骨终板所构成。过度凋亡将导致髓核细胞数量大量减少,进而髓核细胞胞外基质合成明显减少,胞外基质的大量减少最终导致了椎间盘的退变。以往研究发现人退变椎间盘髓核组织中细胞凋亡数量及凋亡蛋白caspase-3的表达水平明显增高[15-17],本研究结果也证实IDD组髓核细胞凋亡率明显高于LVF组。免疫组化及Western blot检测发现HO-1在IDD组髓核中的表达明显低于LVF组,与HU等[9]报道的结果相似。因此,我们推测人椎间盘退变过程中,HO-1与髓核细胞凋亡之间可能有着密切联系。
HO-1是血红素降解的限速酶[18-19],主要包括HO-1和HO-2两个功能亚型。HO-1能显著地分解细胞内的血红素,将其转换为胆红素、碳、一氧化碳和游离铁[20]。众多研究发现HO-1在细胞凋亡和衰老过程中扮演着重要角色。比如在H9C2细胞中,过表达HO-1能显著降低高糖诱导的细胞凋亡[21-22];在SHSY5Y细胞中,姜黄素能通过上调HO-1表达进而抑制凋亡[23]。由此,我们提出假设:HO-1能抑制退变髓核细胞的凋亡。为了验证此假设,我们首先用IL-1β制作髓核细胞凋亡模型,然后用LV-HO-1/HO-1-siRNA处理细胞后检测髓核细胞凋亡的变化情况,发现LV-HO-1能明显上调退变髓核细胞HO-1表达水平,进而明显抑制IL-1β诱导的髓核细胞凋亡。由此,以上结果证实了HO-1抑制人退变椎间盘髓核细胞凋亡的假设。
NF-κB在细胞损伤、应力、凋亡及炎症应答中具有重要的作用[24-26]。近期研究发现NF-κB信号通路与椎间盘退变疾病过程密切相关,抑制NF-κB信号通路活性能显著延缓椎间盘退变[13, 27-28]。也有研究表明SDF-1/CXCR4信号轴能通过抑制NF-κB信号通路从而抑制人椎间盘髓核细胞的凋亡[29]。P65是转录因子NF-κB家族中重要的成员,也是研究最为广泛的转录因子之一。本研究结果显示相比于正常椎间盘髓核,退变髓核中凋亡细胞数和P65阳性表达明显增高。这也许意味着P65活性变化参与了人椎间盘退变,特别是髓核细胞凋亡的过程。为了进一步揭示NF-κB信号通路在HO-1调控人退变髓核细胞凋亡中的作用,本研究利用NF-κB抑制剂PDTC抑制P65磷酸化后检测HO-1对髓核细胞凋亡的影响,结果显示当P65磷酸化被PDTC抑制后,由IL-1β诱导的髓核细胞凋亡明显受到抑制,而用HO-1-siRNA沉默HO-1表达并不能增加髓核细胞的凋亡。这表明HO-1抗髓核细胞凋亡的作用是通过NF-κB信号通路实现的。本研究发现一个有趣的现象,在IL-1β诱导髓核细胞p-P65蛋白表达水平及凋亡率增加的情况下,HO-1-siRNA只能轻微升高p-P65的蛋白表达(P>0.05),但能够明显增加细胞的凋亡率(P < 0.05)。我们认为可能是IL-1β作用下P65磷酸化水平已经到达了一个比较高的水平,再加入HO-1-siRNA也许对p-P65蛋白表达增强的作用就弱化了,所以此时p-P65蛋白水平虽然稍有增加,但差异不具有统计学意义。由于p-P65的轻微增加,通过信号通路的“瀑布效应”,下游信号作用可能成倍扩大,最终导致凋亡率的明显增加。
HO-1能通过抑制NF-κB信号通路从而抑制人退变椎间盘髓核细胞凋亡,可能使HO-1成为椎间盘退变性疾病防治的新靶点。
| [1] | URBAN J P, ROBERTS S. Degeneration of the intervertebral disc[J]. Arthritis Res Ther, 2003, 5(3): 120–130. DOI:10.1186/ar629 |
| [2] | JOUD A, PETERSSON I F, ENGLUND M. Low back pain: epidemiology of consultations[J]. Arthritis Care Res(Hoboken), 2012, 64(7): 1084–1088. DOI:10.1002/acr.21642 |
| [3] | KIM K W, HA K Y, LEE J S, et al. The apoptotic effects of oxidative stress and antiapoptotic effects of caspase inhibitors on rat notochordal cells[J]. Spine, 2007, 32(22): 2443–2448. DOI:10.1097/BRS.0b013e318157395a |
| [4] | POVEDA L, HOTTIGER M, BOOS N, et al. Peroxynitrite induces gene expression in intervertebral disc cells[J]. Spine, 2009, 34(11): 1127–1133. DOI:10.1097/BRS.0b013e31819f2330 |
| [5] | ZHAO C Q, WANG L M, JIANG L S, et al. The cell biology of intervertebral discaging and degeneration[J]. Ageing Res Rev, 2007, 6(3): 247–261. DOI:10.1016/j.arr.2007.08.001 |
| [6] | TSUI T Y, LAU C K, MA J, et al. rAAV-mediated stable expression of hemeoxygenase-1 in stellate cells: A new approach to attenuate liver fibrosis in rats[J]. Hepatology, 2005, 42(2): 335–342. DOI:10.1002/hep.20803 |
| [7] | LANAVILA A, RODRIGUEZ-CALVO R, PALOMER X, et al. Atorvastatin inhibits GSK-3β phosphorylation by cardiac hypertrophic stimuli[J]. Biochim Biophys Acta, 2008, 1781(1/2): 26–35. DOI:10.1016/j.bbalip.2007.10.009 |
| [8] | GUILLER M, MEGISA J, GOMAR F, et al. Haem oxygenase-1 regulates catabolic and anabolic processes in osteoarthritic chondrocytes[J]. J Pathol, 2008, 214(4): 515–522. DOI:10.1002/path.2313 |
| [9] | HU B, SHI C, XU C, et al. Heme oxygenase-1 attenuates IL-1β induced alteration of anabolic and catabolic activities in intervertebral disc degeneration[J]. Sci Rep, 2016, 6: 21190. DOI:10.1038/srep21190 |
| [10] | NAN Y M, WANG R Q, ZHAO S X, et al. Hemeoxygenase-1 prevents non-alcoholic steatohepatitis through suppressing hepatocyte apoptosis in mice[J]. Lipids Health Dis, 2010, 9(1): 124. DOI:10.1186/1476-511X-9-124 |
| [11] | CAI C, TENG L, VU D, et al. The hemeoxygenase 1 inducer (CoPP) protects human cardiac stem cells against apoptosis through activation of the extracellular signal-regulated kinase (ERK)/NRF2 signaling pathway and cytokine release[J]. J Biol Chem, 2012, 287(40): 33720–33732. DOI:10.1074/jbc.M112.385542 |
| [12] | WANG X H, HONG X, ZHU L, et al. Tumor necrosis factor alpha promotes the proliferation of human nucleus pulposus cells via nuclear factor-κB, c-Jun N-terminal kinase, and p38 mitogen-activated protein kinase[J]. Exp Biol Med, 2015, 240(4): 411–417. DOI:10.1177/1535370214554533 |
| [13] | ZHONGYI S, SAI Z, CHAO L, et al. Effects of nuclear factor kappa B signaling pathway in human intervertebral disc degeneration[J]. Spine, 2015, 40(4): 224–232. DOI:10.1097/BRS.0000000000000733 |
| [14] | PFIRRMANN C W, METZDORF A, ZANETTI M, et al. Magnetic resonance classification of lumbar intervertebral disc degeneration[J]. Spine, 2001, 26(17): 1873–1878. DOI:10.1097/00007632-200109010-00011 |
| [15] | WANG D, HU Z, HAO J, et al. SIRT1 inhibits apoptosis of degenerative human disc nucleus pulposus cells through activation of Akt pathway[J]. Age(Dordr), 2013, 35(5): 1741–1753. DOI:10.1007/s11357-012-9474-y |
| [16] | JIANG W, ZHANG X, HAO J, et al. SIRT1 protects against apoptosis by promoting autophagy in degenerative human disc nucleus pulposuscells[J]. Sci Rep, 2014, 4: 7456. DOI:10.1038/srep07456 |
| [17] | AHSAN R, TAJIMA N, CHOSA E, et al. Biochemical and morphological changes in herniated human intervertebral disc[J]. J Orthop Sci, 2001, 6(6): 510–518. DOI:10.1007/s007760100006 |
| [18] | MAINES M D. The hemeoxygenase system and its functions in the brain[J]. Cell Mol Biol, 2000, 46(3): 573–585. |
| [19] |
郭建增, 周歧新. 脑血红素加氧酶系统的作用研究[J].
生理科学进展, 2002, 33(1): 26–29.
GUO J Z, ZHOU Q X. The research into functions of hemeoxygenase system in brain[J]. Prog Physiol Sci, 2002, 33(1): 26–29. |
| [20] | PONKA P. Tissue-specific regulation of iron metabolism and hemesynthesis: distinct control mechanisms in erythroid cells[J]. Blood, 1997, 89(1): 1–25. |
| [21] | AKI T, YAMAGUCHI K, FUJIMIYA T, et al. Phosphoinositide 3-kinase accelerates autophagic cell death during glucose deprivation in the rat cardiomyocyte-derived cell line H9c2[J]. Oncogene, 2003, 22(52): 8529–8535. DOI:10.1038/sj.onc.1207197 |
| [22] | FUKAZAWA R, MILLER T A, KURAMOCHI Y, et al. Neuregulin-1 protects ventricular myocytes from anthracycline-induced apoptosis via erbB4-dependent activation of PI3-kinase/Akt[J]. J Mol Cell Cardiol, 2004, 35(12): 1473–1479. DOI:10.1016/j.yjmcc.2003.09.012 |
| [23] | ZHENG K M, ZHANG J, ZHANG C L, et al. Curcumin inhibits appoptosin-induced apoptosis via up regulating hemeoxygenase-1 expression in SH-SY5Y cells[J]. Acta PharmacolSin, 2015, 36(5): 544–552. DOI:10.1038/aps.2014.166 |
| [24] | HAYDEN M S, GHOSH S. Shared principles in NF-kappaB signaling[J]. Cell, 2008, 132(2): 344–362. DOI:10.1016/j.cell.2008.01.020 |
| [25] |
刘浠, 易威威, 温亚枫, 等. 锌指蛋白A20及其相关炎症因子在椎间盘髓核细胞退变前后的表达变化[J].
第三军医大学学报, 2016, 38(18): 2077–2081.
LIU X, YI W W, WEN Y F, et al. Expression of zinc finger protein A20 and related inflammatory factors in nucleus pulposus cells in degenerative intervertebral disc[J]. J Third Mil Med Univ, 2016, 38(18): 2077–2081. DOI:10.16016/j.1000-5404.201602105 |
| [26] |
刘刚, 唐瑭, 吴立兵, 等. 核因子κB抑制剂Bay 11-7082和131I导致DTC细胞凋亡的效果及协同作用[J].
海南医学院学报, 2013, 11(19): 1487–1489.
LIU G, TANG T, WU L B, et al. Effect of NF-κB inhibitor BAY11-7082 and 131I of inducing apoptosis of cells of differentiated thyroid cancer and their synergistic effects[J]. J Hainan Med Univ, 2013, 11(19): 1487–1489. DOI:10.13210/j.cnki.jhmu.2013.11.036 |
| [27] |
孙中仪, 田纪伟. NF-κB信号通路与椎间盘退变的研究进展[J].
中国矫形外科杂志, 2012, 20(23): 2162–2164.
SUN Z Y, TIAN J W. Progress in the research of NF-κB signaling pathway and intervertebral disc degeneration[J]. Orthopedic J Chin, 2012, 20(23): 2162–2164. |
| [28] | NASTO L A, SEO H Y, ROBINSON A R, et al. ISSLS prize winner: inhibition of NF-κB activity ameliorates age-associated disc degeneration in a mouse model of accelerated aging[J]. Spine, 2012, 37(21): 1819. DOI:10.1097/BRS.0b013e31824ee8f7 |
| [29] | LIU Z, MA C, SHEN J, et al. SDF-1/CXCR4 axis induces apoptosis of human degenerative nucleus pulposus cells via the NF-κB pathway[J]. Mol Med Rep, 2016, 14(1): 783–789. DOI:10.3892/mmr.2016.5341 |



