肾细胞癌约占成人恶性肿瘤的2%, 占肾脏恶性肿瘤的80%~85%,在我国居泌尿系肿瘤第2位, 仅次于膀胱癌,其中透明细胞癌占肾细胞癌的75%~85%[1]。近几十年来其发病率呈上升趋势,男性发病率为女性的2倍[1]。肾细胞癌起病隐匿, 往往缺乏早期临床表现[2]。尽管由于诊断技术的改善使偶发性肾细胞癌的诊断率提高, 依然有25%~30%的肾细胞癌患者在确诊时已出现远处转移,部分患者甚至以转移症状为首发症状就诊[2]。肾细胞癌最主要的治疗方法是手术切除, 但术后复发率达25%~50%[3]。肾细胞癌对放疗和化疗均不敏感,而免疫治疗的疗效有限。当前研究表明:肾细胞癌的发生、发展是一个多因素、多基因异常及多阶段的过程。积极探索肾细胞癌新的相关基因对揭示肾细胞癌发生的分子机制和提高诊治水平具有重要意义。
钙激活核苷酸酶1(calcium-activatedn ucleotidase1, CANT1)是一种cDNA与三磷酸腺苷二磷酸酶cDNA同源的糖基化蛋白,能分泌到细胞外。与三磷酸腺苷二磷酸酶主要水解ATP与ADP不同,CANT1对UDP的活性最强,随后依次是GDP、UTP、GTP,对ADP和ATP的活性很弱,并且CANT1不能水解一磷酸核苷酸的磷酸基团[4]。CANT1在人体组织中广泛表达,大量研究表明:CANT1的突变会引起一种常染色体隐性遗传疾病Desbuquois dysplasia(DBQD),主要表现为生长迟滞、关节松弛、四肢短小、进行性脊柱侧突等症状,体现了CANT1对正常生长发育的重要作用[5-9]。现有研究表明:对正常生长起重要作用的因子往往都对肿瘤生长起着重要的作用[10]。本研究旨在观察CANT1对人肾透明细胞癌769-P细胞增殖和迁移的影响,并对其作用机制进行初步探讨,以期为肾透明细胞癌的分子靶向治疗提供新的靶点。
1 材料与方法 1.1 材料与试剂肾透明细胞癌769-P细胞系购自美国ATCC细胞库,RPMI 1640培养基购自美国Gibco公司,CCK-8试剂盒购自日本同仁化学公司,Annexin-V FITC凋亡检测试剂盒购自美国BD公司,伤口愈合2孔插件购自Ibidi公司,CANT1抗体购自Abnova公司,BCA蛋白定量试剂盒、GAPDH、TUBLIN抗体购上海碧云天公司,山羊抗鼠和山羊抗兔IgG购自中杉金桥公司。
1.2 构建shRNA稳定转染细胞系由和元生物技术(上海)有限公司设计并构建3个带有EGFP荧光和嘌呤霉素抗性基因标记的人CANT1干扰慢病毒载体(1#、2#、3#)及1个无关序列慢病毒载体(NC),表达干扰序列为1#正义链5′-GGTGATCCTGACGTTCTTT-3′,反义链5′-AAAGAACGTCA-GGATCACC-3′;2#正义链5′-CCAGATCGAAGGCAGC-AAA-3′,反义链5′-TTTGCTGCCTTCGATCTGG-3′;3#正义链5′-GCGTGAAATACGAAGGCAT-3′,反义链5′-ATGCCTTCGTATTTCACGC-3′;NC正义链5′-TTCTCCG-AACGTGTCACGT-3′,反义链5′-ACGTGACACGTTCGGAGAA-3′。将慢病毒转染6孔板内的769-P细胞,MOI=2;24 h后更换新鲜培养基,转染荧光出现后加入含2 μg/mL嘌呤霉素的培养基进行抗性筛选;连续传代,直至含荧光细胞达90%以上后,用含1 μg/mL嘌呤霉素的培养基维持培养,转染得到的细胞对应为shCANT1-1#、shCANT1-2#、shCANT1-3#及ncCANT1组。
1.3 免疫组化观察肾透明细胞癌组织及癌周正常组织中CANT1的表达取本科因肾脏包块进行手术切除、并经病理诊断为肾透明细胞癌的患者组织标本,于4%多聚甲醛中浸泡固定,石蜡包埋,连续3~4 μm切片, 常规脱蜡、脱水,PBS充分冲洗,3%过氧化氢常温孵育10 min,PBS冲洗2次,柠檬酸盐微波抗原修复3 min,冷却后PBS冲洗3次,加小牛血清37 ℃封闭30 min,倾去血清,吸水纸吸干水分,滴加CANT1抗体(1 :100稀释),4 ℃过夜。次日取出后PBS冲洗3次,每次5 min,擦干后加上SABC(1 :100),37 ℃孵育30 min,PBS冲洗3次,每次5 min,DAB显色,自来水充分冲洗,苏木精复染1 min,温水返蓝3 min,脱水,透明,封片,拍照。
1.4 RT-PCR检测shRNA的干扰效率收集已经处理好的细胞,TRIzol法提取各组细胞总RNA;取1 μg去除基因组DNA后反转录为cDNA(20 μL体系),三步法进行RT-PCR,反应体系为:蒸馏水6 μL,SYBRGreenRealtimePCRMasterMix10 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,反转录样品2 μL,反应条件:95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,40个循环。CANT1引物上游:5′-GAGGCATGGAGCTATCCGAC-3′,下游:5′-CCACATCACCCGTAGTGGTC-3′,片段大小234 bp;GAPDH引物上游:5′-CGCTGAGTACGTCGTGGAGTC-3′,下游:5′-GCTGATGATCTTGAGGCTGTTGTC-3′,片段大小172 bp。
1.5 Western blot检测shRNA的干扰效率收集各组细胞,加入细胞裂解液,冰上裂解30 min,接着用1 mL枪头刮下细胞,12 000 r/min,20 min,取上清液至新的1.5 mL EP管中。按4 :1的比例加入5×SDS PAGE上样缓冲液,100 ℃金属浴10 min。随后进行SDS-PAGE电泳,后采用250 mA恒流湿转90 min,使蛋白转移到PVDF膜上,用含5%脱脂奶粉的TBST溶液封闭2 h后,分别加入稀释后的一抗CANT1(1 :200)、GAPDH(1 :1 000)及TUBLIN(1 :1 000),4 ℃孵育过夜,次日洗膜,用1 :5 000稀释的二抗室温孵育2 h,TBST洗膜3次, 用化学发光法在凝胶成像仪上显影。
1.6 CCK-8检测CANT1敲低后对769-P细胞增殖的影响实验分空白对照ncCANT1组、干扰shCANT1组,取对数生长期的上述2组细胞经胰酶消化、细胞计数后,按每孔3 000个细胞接种于96孔板中,每组设3个复孔。孵箱培养24 h后弃去96孔板的培养基,每孔加入90 μL RPMI1640培养基和10 μL CCK-8试剂,再取3个没有接种细胞的孔加入相同量的培养基和CCK-8作为空白对照,放细胞培养箱孵育1 h后,用酶标仪测450 nm波长各孔光密度值[D(450)][11]。相同条件下实验重复3次。
1.7 划痕实验检测CANT1敲低后对769-P细胞迁移的影响将伤口愈合2孔插件置于6孔板中,将稳定转染的ncCANT1和shCANT1组细胞用含10%胎牛血清的RPMI1640培养基稀释成(3~7)×105/mL细胞悬液,各取70 μL加入插件的小孔中。待细胞铺满小孔时,用镊子移除插件,加入2 mL含2%胎牛血清的RPMI1640培养基,0、6、12 h时显微镜下拍照,记录细胞生长情况。
1.8 流式细胞仪检测CANT1敲低对769-P细胞凋亡的影响对照组和CANT1敲低组细胞经胰酶消化后,1 000 r/min、4 ℃离心10 min,弃上清,加入1 mL预冷的PBS重悬细胞,再次离心去上清。重复此步骤3次后,将细胞重悬于200 μL Binding Buffer,加入10 μL AnnexinV-FITC轻轻混匀,避光室温反应15 min;加入300 μL Binding Buffer以及5 μL PI上机检测。
1.9 流式细胞仪检测CANT1敲低对769-P细胞周期的影响取对数生长期的对照组和干扰组细胞,经胰酶消化后铺6孔板,每孔体积2 mL(细胞数约2×106/孔),生长至80%后经胰酶消化、收集细胞,加入预冷的70%乙醇4 ℃固定过夜,离心收集细胞,PBS清洗,加RNaseA(终浓度1 μg/mL),37 ℃水浴消化30 min。加PI至终浓度50 μg/mL,冰浴避光染色30 min。尼龙网过滤,流式细胞仪检测,488 nm激发光激发检测。相同条件下实验重复3次。
1.10 统计学分析计量资料数据以x±s表示。采用GraphPad 7.0软件作图,SPSS 13.0统计软件进行数据分析。两组比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准:α=0.05。
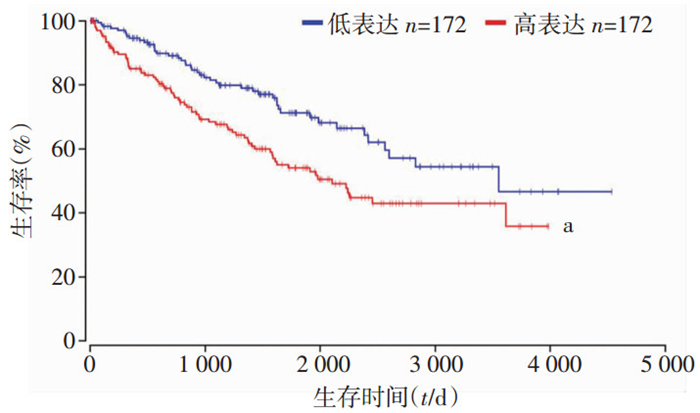
2 结果 2.1 CANT1在肾癌组织和癌周正常组织中的表达取得临床手术切除的肾透明细胞癌患者的肿瘤及其癌周正常组织,进行免疫组化染色发现:在癌周正常组织中CANT1主要表达于肾脏远曲小管,近曲小管极少或几乎没有表达,而透明细胞癌组织中CANT1则呈弥漫高表达状态(图 1)。随后利用oncolnc网站(http://www.oncolnc.org/)分析TCGA数据库的信息,发现CANT1高表达的肾癌患者生存时间明显比CANT1低表达的肾癌患者短(图 2),说明CANT1的高表达会影响肾癌患者的预后。

|
| 黑色箭头示近曲小管,红色箭头示远曲小管 图 1 免疫组化观察CANT1在肾透明细胞癌组织(A)和癌周正常肾组织(B)的表达 (SABC) |
|
| a: P<0.01, 与低表达患者比较 图 2 CANT1高表达与低表达患者的生存曲线分析 |
2.2 构建干扰CANT1表达的稳定转染细胞系
为了验证CANT1在肾透明细胞癌中的作用,使用携带shCANT1干扰片段、嘌呤霉素抗性基因及GFP的慢病毒和对照组慢病毒转染769-P细胞系,并用嘌呤霉素筛选出稳定转染的细胞系。shCANT1组较对照组在mRNA水平有明显下调,但是不同的干扰组干扰效率有所不同。shCANT1-1#干扰效率最高,为86%,shCANT1-2#干扰效率为33%,shCANT1-3#干扰效率为14%(图 3A)。在蛋白质水平,shCANT1-1#的蛋白表达明显下调,约为对照组的34.5%;shCANT1-2#蛋白下调不明显;shCANT1-3#蛋白也有明显下调,约为对照组的50%(图 3B、C)。

|
|
1:对照组;2:shCANT1-1#组;3:shCANT1-2#组;4:shCANT1-3#组;a: P<0.01, 与对照组比较 A:各组细胞CANT1 mRNA表达分析;B:Western blot检测结果;C:各组细胞CANT1蛋白表达分析 图 3 转染干扰慢病毒后各组细胞CANT1 mRNA和蛋白的表达 |
2.3 CANT1敲低对769-P细胞增殖的影响
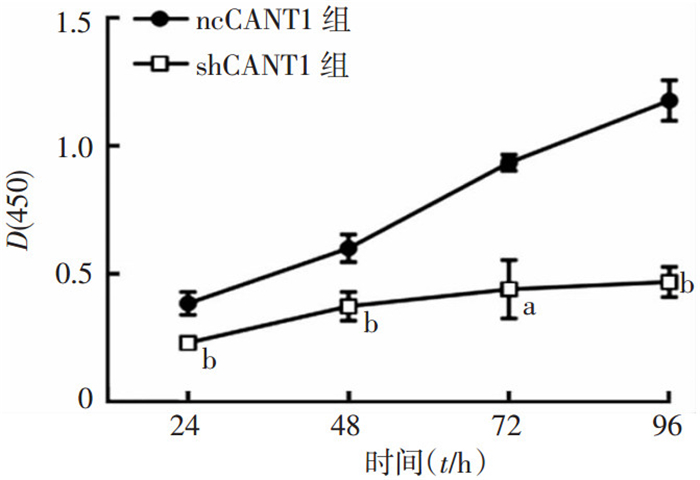
由于shCANT1-1#组细胞在mRNA和蛋白水平均显示了较高的干扰效率,后续实验中干扰组均采用shCANT1-1#,并直接用shCANT1表示。CCK-8检测细胞增殖结果显示:CANT1敲低组细胞(shCANT1)较对照组细胞(ncCANT1)增殖明显减慢(图 4),说明CANT1敲低以后细胞的增殖受到抑制。
|
| a: P<0.05, b: P<0.01,与ncCANT1组比较 图 4 CCK-8检测CANT1敲低后对769-P细胞增殖的影响 |
2.4 CANT1敲低对769-P细胞迁移的影响
划痕实验结果显示:与对照组细胞(ncCANT1)相比,下调CANT1的表达后,细胞的划痕宽度增加(划痕越宽,迁移越慢),迁移能力明显下降(图 5),在12 h时间点时,两组细胞的迁移距离相比较[ncCANT1组划痕宽度(344.5±102.5)像素,shCANT1组划痕宽度(574.2±41.3)像素],差异具有统计学意义(P<0.05)。

|
| 图 5 CANT1敲低后对769-P细胞迁移的影响 |
2.5 CANT1敲低对769-P细胞的细胞周期和凋亡的影响
由于细胞增殖速度明显减慢,检测细胞周期发现shCANT1组细胞周期阻滞在S期(ncCANT1组G1期细胞比例为44.76%,S期为36.18%,G2期为19.06%;shCANT1组G1期细胞比例为47.87%,S期为43.31%,G2期为8.82%)。同时用流式细胞仪检测两组细胞的凋亡,发现对照组细胞凋亡率为(7.2±1.3)%, shCANT1组细胞凋亡率为(18.3±2.8)%,敲低组细胞较对照组凋亡明显增多(P<0.01)。
3 讨论肾癌缺乏早期临床表现,导致很大一部分患者就诊时肿瘤已经发生转移,且肾癌对化疗和放疗均不敏感[12],导致晚期肾癌治疗手段有限。新近研究表明:肾癌的临床一线靶向药物舒尼替尼虽提高了手术后患者的无病生存期,但是对患者的总生存期并没有改善,患者不良反应事件增多[13]。肾癌晚期一旦出现转移预后极差。早期确诊肿瘤并手术切除是提高肾癌患者预后的最佳方法。为达到这一目的,研究肾癌发生和发展的分子机制尤为重要,某些分子可能成为肾癌早期发现和诊断的可靠的分子标志物。
目前认为肾癌主要起源于肾近曲小管上皮细胞[2, 12],而本研究中免疫组化结果显示:癌周正常组织中,近曲小管表达CANT1极弱,主要表达于远曲小管,可以推断在肿瘤发生过程中,CANT1在肾近曲小管上皮细胞中的表达上调。生物信息学数据也显示CANT1高表达的肾透明细胞癌患者较CANT1低表达的患者预后差,且在肾透明细胞癌769-P细胞系中敲低CANT1的表达后,肿瘤细胞的增殖和迁移能力都受到了明显的抑制,说明CANT1在肾透明细胞癌的肿瘤形成和生长中都具有重要的作用。CANT1目前已知是一种磷酸酶,能水解UDP、GDP、UTP、GTP的磷酸基团。本研究发现在肾癌细胞中,CANT1敲低后细胞周期阻滞于S期,猜测它发挥抑制肿瘤生长的作用与其磷酸酶水解作用有关,导致细胞内DNA合成的原料核苷酸dNTP(N指A、T、C、G)不足,使细胞生长缓慢。GERHARDT等[14]研究发现:在CANT1敲低的前列腺癌细胞系LNCaP和PC-3中,细胞周期阻滞在G1期, 与本研究结果有差别,其中机制需要进一步研究。
此外,免疫组化结果显示CANT1主要表达于肾远曲小管上皮细胞,此处为尿液中物质重吸收和分泌的部位,CANT1是一种可分泌到细胞外的蛋白[4],因此CANT1能分泌到尿液中,从尿液中检测CANT1的表达就成为可能。如果肿瘤组织中CANT1蛋白水平明显高于正常组织,那么尿液中的CANT1蛋白水平可能作为肾癌的早期诊断无创的、方便的诊断标志物。
本研究初步观察了CANT1在肾癌组织及癌周正常组织的表达定位,确定了CANT1促进肾透明细胞癌细胞生长的重要作用,CANT1的敲低会阻碍肾癌细胞的生长,可能为以后肾透明细胞癌的靶向治疗提供重要的分子靶点。CANT1抑制肾透明细胞癌细胞生长的具体作用机制还有待进一步研究,尿液中的CANT1蛋白作为无创性的肾癌辅助诊断标志物的设想也需要临床大样本数据的支持。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [2] | MOTZER R J, BANDER N H, NANUS D M. Renal-cell carcinoma[J]. N Engl J Med, 1996, 335(12): 865–875. DOI:10.1056/NEJM199609193351207 |
| [3] | JANZEN N K, KIM H L, FIGLIN R A, et al. Surveillance after radical or partial nephrectomy for localized renal cell carcinoma and management of recurrent disease[J]. Urol Clin North Am, 2003, 30(4): 843–852. DOI:10.1016/S0094-0143(03)00056-9 |
| [4] | SMITH T M, HICKS-BERGER C A, KIM S, et al. Cloning, expression, and characterization of a soluble calcium-activated nucleotidase, a human enzyme belonging to a new family of extracellular nucleotidases[J]. Arch Biochem Biophys, 2002, 406(1): 105–115. DOI:10.1016/S0003-9861(02)00420-4 |
| [5] | LACCONE F, SCHONER K, KRABICHLER B, et al. Desbuquois dysplasia type Ⅰ and fetal hydrops due to novel mutations in the CANT1 gene[J]. Eur J Hum Genet, 2011, 19(11): 1133–1137. DOI:10.1038/ejhg.2011.101 |
| [6] | HUBER C, OULES B, BERTOLI M, et al. Identification of CANT1 mutations in Desbuquois dysplasia[J]. Am J Hum Genet, 2009, 85(5): 706–710. DOI:10.1016/j.ajhg.2009.10.001 |
| [7] | FURUICHI T, DAI J, CHO T J, et al. CANT1 mutation is also responsible for Desbuquois dysplasia, type 2 and Kim variant[J]. J Med Genet, 2011, 48(1): 32–37. DOI:10.1136/jmg.2010.080226 |
| [8] | FADEN M, AL-ZAHRANI F, ARAFAH D, et al. Mutation of CANT1 causes Desbuquois dysplasia[J]. Am J Med Genet A, 2010, 152A(5): 1157–1160. DOI:10.1002/ajmg.a.33404 |
| [9] | BALASUBRAMANIAN K, LI B, KRAKOW D, et al. MED resulting from recessively inherited mutations in the gene encoding calcium-activated nucleotidase CANT1[J]. Am J Med Genet A, 2017, 173(9): 2415–2421. DOI:10.1002/ajmg.a.38349 |
| [10] | SHAN L, ZHOU X, LIU X, et al. FOXK2 elicits massive transcription repression and suppresses the hypoxic response and breast cancer carcinogenesis[J]. Cancer Cell, 2016, 30(5): 708–722. DOI:10.1016/j.ccell.2016.09.010 |
| [11] |
皮国成, 肖何, 罗佳, 等. Torin2对人非小细胞肺癌A549细胞生长和迁移的影响[J].
第三军医大学学报, 2016, 38(24): 2576–2579.
PI G C, XIAO H, LUO J, et al. Effects of Torin2 on cell proliferation and migration in human non-small lung cancer A549 cells[J]. J Third Mil Med Univ, 2016, 38(24): 2576–2579. DOI:10.16016/j.1000-5404.201609065 |
| [12] | TOMITA Y. Early renal cell cancer[J]. Int J Clin Oncol, 2006, 11(1): 22–27. DOI:10.1007/s10147-005-0551-4 |
| [13] | RAVAUD A, MOTZER R J, PANDHA H S, et al. Adjuvant sunitinib in high-risk renal-cell carcinoma after nephrectomy[J]. N Engl J Med, 2016, 375(23): 2246–2254. DOI:10.1056/NEJMoa1611406 |
| [14] | GERHARDT J, STEINBRECH C, BUCHI O, et al. The androgen-regulated calcium-activated nucleotidase 1 (CANT1) is commonly overexpressed in prostate cancer and is tumor-biologically relevant in vitro[J]. Am J Pathol, 2011, 178(4): 1847–1860. DOI:10.1016/j.ajpath.2010.12.046 |



