2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院医学遗传学教研室
2. Department of Medical Genetics, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
由于颌骨创伤、肿瘤手术等导致的颌骨缺损的修复重建是口腔颌面外科面临的临床难题。骨组织工程是理想的修复骨缺损的方法,而种子细胞的研究尤为关键。骨髓间充质干细胞(mesenchymalstem cells, MSCs),由于具有多潜能分化特性,如分化为骨、软骨、肌肉、脂肪等,在再生医学的治疗中得到广泛应用,为骨缺损重建和愈合带来了希望。但由于供体细胞来源的短缺以及获得方法需创伤处理,寻找新的间充质干细胞非常必要。
人脐带间充质干细胞(human umbilical cord mesenchymalstem cells,HUMSCs)作为比较原始的间充质干细胞,由于取材容易,采集方便,供源充足,具有自我更新和多向分化潜能,可以向多种组织如骨、软骨、肌肉、肌腱、肝和脂肪细胞等分化[1],并具有强大的组织损伤修复能力和极低的免疫原性,是组织工程中理想的种子来源细胞[2-3],但其在成骨分化中的作用尚有待探明。
降钙素基因相关肽(calcitonin gene related peptide,CGRP)作为一种小分子神经肽,由感觉神经纤维分泌,作为体内分布广泛的神经肽,在调节颌面骨的生长、发育、修复和改建过程中起着重要作用[4-6]。体外实验证实外源性CGRP可以增加成骨细胞集落的数目和大小,并且呈浓度依赖性[7]。骨折发生时,骨折部位及患者血浆中CGRP含量明显升高,表明具有成骨分化的能力[8]。CGRP主要分布于骨代谢活跃区域,通过提高成骨细胞活性、抑制破骨细胞骨吸收作用进而促进骨再生[9-10]。对HUMSCs的研究,研究表明CGRP可趋化HUMSCs至脊髓受损部位并修复受损脊髓[11],但CGRP对HUMSCs成骨分化的作用尚不清楚。
本研究通过在体外培养HUMSCs,诱导其向成骨细胞分化,观察不同浓度CGRP对矿化结节形成及对ERK、RUNX2、OSTERIX表达的影响,明确CGRP对HUMSCs的作用及信号通路。
1 材料与方法 1.1 主要试剂与仪器CBR-130406 HUMSCs(博赛生物技术有限责任公司),CGRP(Sigma公司,美国),RNA提取试剂盒、RT-PCR试剂盒、反转录试剂盒(TaKaRa公司,日本),DMSO(Amresco公司,美国),Ori Cell TM HUMSCs完全培养液、Ori Cell TM HUMSCs成骨诱导分化培养液试剂盒(Cyagen公司),胰蛋白酶(HyClone公司,美国),辣根酶标记山羊抗兔IgG抗体、辣根酶标记山羊抗鼠IgG抗体、茜素红S染色液(上海碧云天生物有限公司),p-ERK、RUNX2抗体(CST公司,中国),Ostreix抗体(武汉百翼有限公司),NanoDrop 2000超微量分光光度计, Gallios流式细胞仪(贝克曼公司, 美国)。
1.2 CBR-130406 HUMSCs培养与鉴定于37 ℃、5%CO2培养箱中培养CBR-130406 HUMSCs,5~6 d细胞融合达到80%后,胰蛋白酶消化传代及冻存备用。培养的细胞于倒置显微镜下观察细胞形态,通过流式细胞仪检测CD73、CD90、CD105、CD14、CD20、CD34、CD45的表达,以鉴定间充质干细胞。
1.3 CGRP对HUMSCs诱导成骨的影响按5×105/孔的密度将培养的CBR-130406 HUMSCs接种于12孔板中,待细胞融合至约80%后,培养液更换为成骨细胞诱导分化培养液,同时在成骨诱导分化培养液中加入含0、10-9、10-8、10-7 mol/L浓度的CGRP,每2天细胞换液1次。在10、14 d后进行茜素红染色,提取RNA、蛋白,进行后续实验。实验重复3次。
1.4 CGRP对诱导形成的成骨细胞的影响按5×105/孔的密度将培养的CBR-130406 HUMSCs接种于12孔板中,待细胞融合至约80%后更换为成骨诱导分化培养液,培养6 d时,茜素红染色确认矿化结节出现,同时在未染色孔板中更换培养液为含CGRP浓度为0、10-9、10-8、10-7 mol/L的成骨诱导分化培养液,每2天细胞换液1次。在培养7、9、11、14 d后进行茜素红染色,提取RNA、蛋白,进行后续实验。实验重复3次。
1.5 ERK、RUNX2及OSTERIX mRNA的表达实时定量PCR检测细胞内ERK、RUNX2及OSTERIX mRNA的表达。TRIzol法提取各分组总RNA,以提取的HUMSCs总mRNA为模板,反转录形成的cDNA为模板,每一样品做3个复孔,取其平均值。反应结束后,根据溶解曲线判断扩增产物特异性;以GAPDH为内参基因,采用相对定量法(2-△△Ct)计算ERK、RUNX2、OSTERIX、GAPDH的mRNA表达情况。RNA引物序列合成见表 1。实验重复3次。
| 基因 | 序列 | 产物大小(bp) |
| ERK | 上游5′-ATGTCATCGGCATCCGAGAC-3′ | 156 |
| 下游5′-GGATCTGGTAGAGGAAGTAGCA-3′ | ||
| RUNX2 | 上游5′-TCAACGATCTGAGATTTGTGGG-3′ | 80 |
| 下游5′-GGGAGGATTTGTGAAGACGG-3′ | ||
| OSTERIX | 上游5′-CCTCTGCGGGACTCAACAAC-3′ | 128 |
| 下游5′-AGCCCATTAGTGCTTGTAAAGG-3′ | ||
| GAPDH | 上游5′-TGTTGCCATCAATGACCCCTT-3′ | 202 |
| 下游5′-CTCCACGACGTACTCAGCG-3′ |
1.6 Western blot检测p-ERK、RUNX2及OSTERIX的蛋白表达
BCA法检测各组细胞中提取的蛋白浓度,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,将目的蛋白转移至0.2 μm的PVDF膜,p-ERK抗体(1 :1 000)、RUNX2抗体(1 :1 000)、OSTERIX抗体(1 :1 000)4 ℃孵育过夜;洗膜后用辣根过氧化物酶标记二抗(1 :5 000),GAPDH(1 :5 000)直标一抗4 ℃孵育40 min;用电化学发光法发光显影,Image Quant LAS4000数字成像系统采集影像,进行灰度值分析。实验重复3次。
1.7 统计学分析计量资料以x±s表示。研究设计了不同CGRP浓度(4个)和不同检测时间(4个水平)两个因素,采用SPSS 19.0统计软件行双因素方差分析,检验两因素间的交互效应及各因素下不同水平间的差异。检验水准:α=0.05。
2 结果 2.1 HUMSCs的培养及鉴定倒置显微镜下观察培养的CBR-130406 HUMSCs,发现培养的细胞贴壁生长,并呈成纤维细胞样(图 1)。
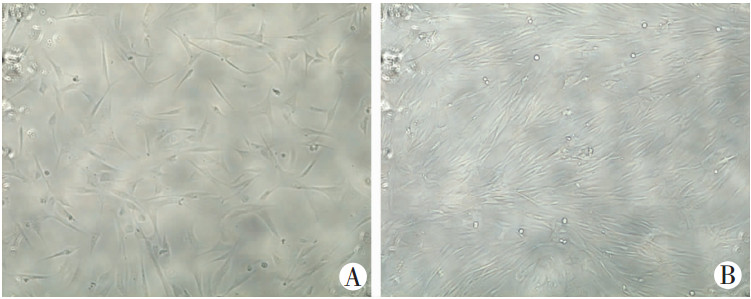
|
| A:2 d;B:4 d 图 1 倒置显微镜下观察HUMSCs培养不同时间的细胞形态 (×100) |
流式细胞仪检测结果显示培养的细胞均高表达CD73、CD90、CD105等间充质干细胞表面抗原,但不表达CD14、CD20、CD34、CD45等上皮和造血干细胞的表面抗原(图 2),说明培养的CBR-130406 HUMSCs为脐带来源的间充质干细胞。
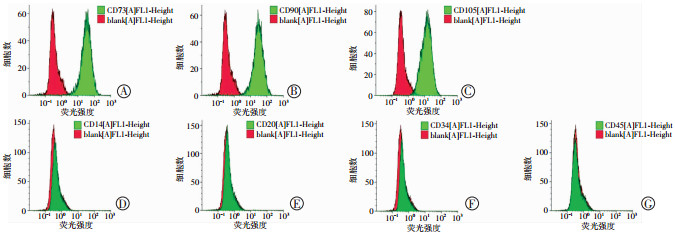
|
| A: CD73;B: CD90;C: CD105;D: CD14;E: CD20;F: CD34;G: CD45 图 2 流式细胞仪鉴定培养第3代的HUMSCs |
2.2 HUMSCs向成骨细胞的诱导分化
细胞汇合约80%左右,更换完全培养液为成骨分化诱导培养液,14、24 d后倒置显微镜观察细胞,发现体积明显增大,呈多角形、星形伸展、较多时呈拥挤生长,呈类圆形,排列呈铺路石;茜素红s染色结果显示:随着诱导培养时间的延长,红色矿化结节明显增多[14 d:(80.000±3.215),24 d:(150.700±8.452),P<0.05,图 3],说明HUMSCs具有向成骨细胞分化的能力。
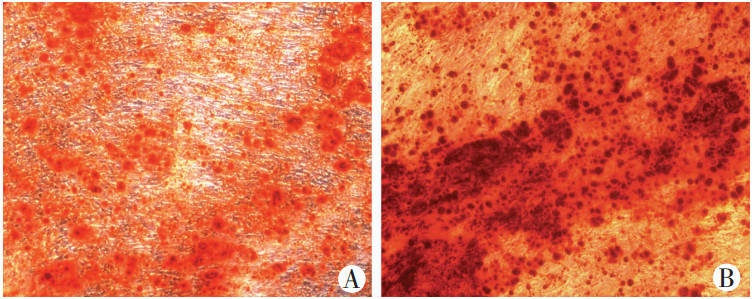
|
| A:0 mol/L CGRP成骨诱导培养14 d;B:0 mol/L CGRP成骨诱导培养24 d 图 3 茜素红染色观察HUMSCs成骨分化程度 (×100) |
2.3 CGRP对HUMSCs诱导成骨的影响
将不同浓度的CGRP加入至成骨诱导培养基中,观察其对HUMSCs向成骨细胞分化的影响,在10、14 d行茜素红染色(图 4、5)。结果显示:随着CGRP作用时间和浓度的增加,矿化结节形成的数量呈递减趋势,说明CGRP抑制了HUMSCs向成骨细胞的分化。
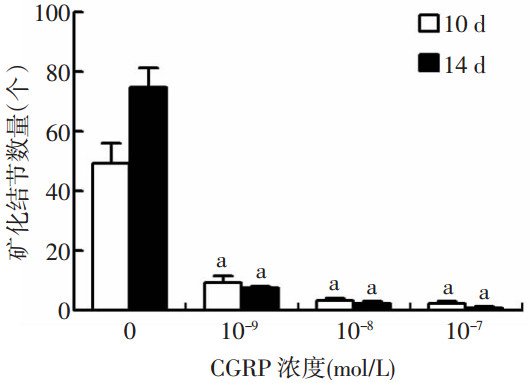
|
| a:P<0.01,不同浓度CGRP及不同时间组间比较 图 4 CGRP诱导第10、14天矿化结节茜素红染色统计结果 |
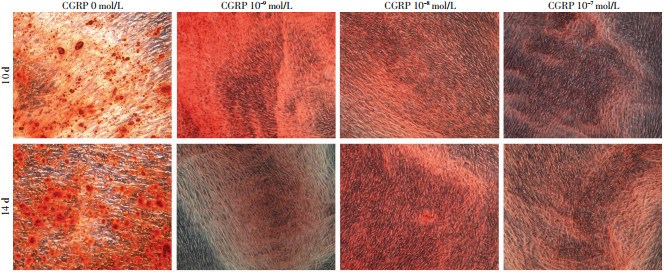
|
| 图 5 茜素红染色观察不同浓度CGRP处理不同时间对HUMSCs诱导成骨的影响 (×100) |
2.4 CGRP对诱导形成的成骨细胞的影响
为确认CGRP对已形成的成骨细胞的影响,在诱导HUMSCs分化成成骨细胞后,分别加入不同浓度的CGRP,在加入CGRP后7、9、11、14 d分别进行茜素红染色(图 6、7)。结果显示:随着CGRP浓度的升高和作用时间的增长,矿化结节的数量明显减少,说明CGRP抑制了成骨细胞的生成。
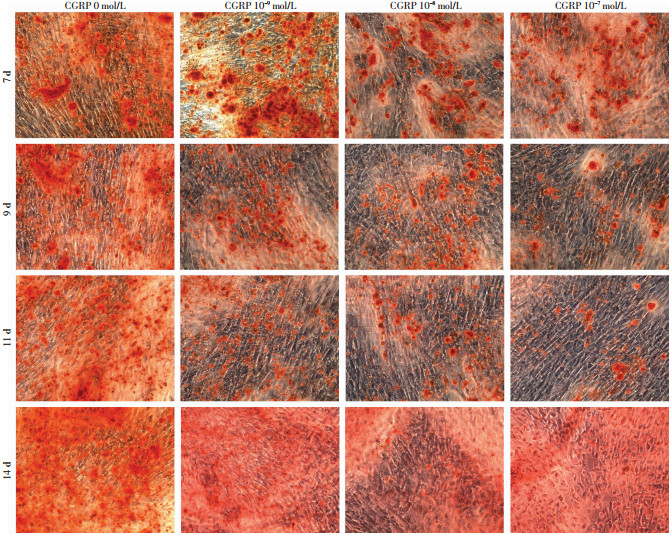
|
| 图 6 茜素红染色观察不同浓度CGRP处理不同时间对HUMSCs成骨细胞矿化能力的影响 (×100) |
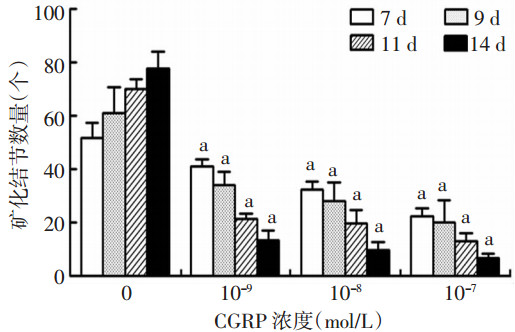
|
| a:P<0.05,不同浓度CGRP及不同时间组间比较 图 7 CGRP诱导第7、9、11、14天矿化结节茜素红染色统计结果 |
2.5 CGRP调控成骨细胞形成的作用机制
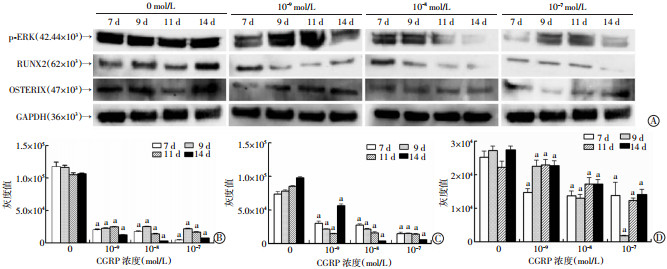
为检测CGRP是否通过激活间充质干细胞的ERK途径,通过磷酸化ERK分子进入细胞核刺激RUNX2和OSTERIX等成骨转录因子,诱导细胞向成骨细胞分化途径影响HUMSCs向成骨细胞的分化,从基因和蛋白水平检测了与成骨细胞形成相关的ERK、RUNX2和OSTERIX的表达。结果显示:随着CGRP浓度升高,ERK的表达呈降低趋势,RUNX2、OSTERIX的mRNA和蛋白表达与ERK的表达变化一致(P<0.05,图 8、9),表明CGRP可通过ERK途径影响HUMSCs向成骨细胞的分化。
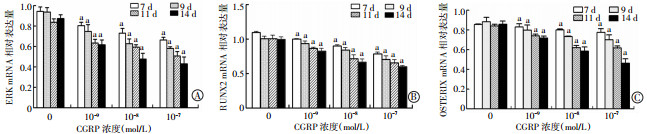
|
|
a:P<0.01,不同浓度CGRP及不同时间组间比较 A:ERK;B:RUNX2;C:OSTERIX 图 8 实时定量PCR检测不同浓度CGRP对成骨细胞形成的影响 |
|
|
a: P<0.05,不同浓度CGRP及不同时间组间比较 A:Western blot检测;B~D:分别为p-ERK、RUNX2、OSTERIX蛋白表达灰度值分析 图 9 Western blot检测不同浓度CGRP对p-ERK、RUNX2、OSTERIX蛋白表达的影响 |
3 讨论
MSCs无论来源于骨髓还是脐带,都可以作为未来治疗骨缺损修复的来源,具有一定的临床应用前景[12]。由于HUMSCs具有MSCs一些无法比拟的优点,如材料易得、低免疫原性等,在临床上得到广泛应用。以往的研究表明HUMSCs具有向成骨细胞分化的能力,本研究结果也证实了这一结论。与CGRP具有促MSCs向成骨细胞分化的潜能相对比,本研究结果表明CGRP抑制了HUMSCs向成骨细胞的分化,并对体外HUMSCs已诱导形成的成骨细胞也具有抑制作用。CGRP表现出对HUMSCs与MSCs向成骨细胞分化完全不同的反应特点,推测与HUMSCs的特性相关。如在成骨分化方面,不仅分化能力低于MSCs,而且一些蛋白的表达,如CBRT1、OAT、HSP27及PSAT1也低于MSCs[13-14]。另外,CGRP可促进IL-1β的产生,放大炎性反应,如基因敲除CGRP,单核细胞和树突状细胞IL-1β的水平明显降低[15];在培养的外周单核细胞中,CGRP可呈剂量依赖性地刺激单核细胞的IL-1β分泌,而炎症可抑制成骨细胞的形成。这可能是导致CGRP对HUMSCs成骨分化表现出抑制的原因。
在MSCs向成骨细胞的分化过程中,较多的信号途径如Wnt、Notch、BMP、Hippo等参与其中[16-17],而ERK信号途径在间充质干细胞向成骨细胞分化中作用显著,如VEGF-C可通过ERK和RUNX2促进人间充质干细胞成骨分化[18]。活化的ERK可磷酸化ELK-1,在成骨细胞分化过程中可激活众多的靶蛋白,而且ERK不仅影响成骨细胞的增殖[19-20],而且对成骨细胞的粘附、迁移等均具重要意义[21-22]。虽然CGRP可通过PI3K/Akt和p38-MAPK途径趋化HUMSCs,但对其成骨分化并无影响[11],因此,我们选择ERK进行研究。结果表明CGRP影响了p-ERK的表达,并具有浓度和时间的依赖性,同时CGRP还影响了ERK下游与成骨细胞形成相关的基因如RUNX2、OSTERIX的表达,说明CGRP可通过ERK途径影响HUMSCs向成骨细胞的分化。
在体内,HUMSCs向成骨细胞的分化受多种因素的影响,如钙离子浓度、蛋白激酶C、胰岛素样生长因子-Ⅰ和炎性因子等。此外,BMP-2也可促进HUMSCs向成骨细胞分化[12],CGRP是神经末梢释放的神经因子,在骨折发生后,会有较多的因子释放及细胞的活化,随着骨免疫学的提出,一些免疫细胞及细胞因子在干细胞向成骨细胞分化中的作用也逐渐明朗[23-24]。因此,在多因素条件下研究CGRP对HUMSCs向成骨细胞的分化的作用,将有利于加深对干细胞的理解,能为HUMSCs应用于颌面部骨性损伤的治疗提供新的思路。
综上所述,本研究表明:在体外条件下,CGRP通过ERK途径抑制了HUMSCs向成骨细胞的分化,并呈现出时间和浓度的依赖性。
| [1] |
常正奇, 许建中, 梁进, 等. 人脐带间充质干细胞的新分离方法及其作为骨组织工程种子细胞的相关研究[J].
第三军医大学学报, 2015, 37(19): 1930–1935.
CHANG Z Q, XU J Z, LIANG J, et al. New isolation method of human umbilical cord mesenchymal stem cells and relative research of them as seed cells in tissue engineering bone[J]. J Third Mil Med Univ, 2015, 37(19): 1930–1935. DOI:10.16016/j.1000-5404.201501035 |
| [2] | LOH Y, OYAMA Y, STATKUTE L, et al. Development of a secondary autoimmune disorder after hematopoietic stem cell transplantation for autoimmune diseases: role of conditioning regimenused[J]. Blood, 2007, 109(6): 2643–2648. DOI:10.1182/blood-2006-07-035766 |
| [3] | AGGARWAL S, PITTENGER M F. Human mesenchymal stem cells modulate allogeneic immune cell responses[J]. Blood, 2005, 105(4): 1815–1822. DOI:10.1182/blood-2004-04-1559 |
| [4] | SAMPLE S J, HAO Z, WILSON A P, et al. Role of calcitonin gene-related peptide in bone repair after cyclic fatigue loading[J]. PLoS ONE, 2011, 6(6). DOI:10.1371/journal.pone.0020386 |
| [5] | ZHAO X G, ZHAO G F, MA Y F, et al. Research progress in mechanism of traumatic brain injury affecting speed of fracture healing[J]. Chin J Traumatol, 2007, 10(6): 376–380. |
| [6] | DA PAZ A C, CAROD ARTAL F J, KALIL R K. The function of proprioceptors in bone organization: a possible explanation for neurogenic heterotopic ossification in patients with neurological damage[J]. Med Hypotheses, 2007, 68(1): 67–73. DOI:10.1016/j.mehy.2006.06.035 |
| [7] | IMAI S, MATSUSUE Y. Neuronal regulation of bone metabolism and anabolism: calcitonin gene-related peptide-, substance P-, and tyrosine hydroxylase-containing nerves and the bone[J]. Microsc Res Tech, 2002, 58(2): 61–69. DOI:10.1002/jemt.10119 |
| [8] | LI J, KREICBERGS A, BERGSTROM J, et al. Site-specific CGRP innervation coincides with bone formation during fracture healing and modeling: a study in rat angulated tibia[J]. J Orthop Res, 2007, 25(9): 1204–1212. DOI:10.1002/jor.20406 |
| [9] | VILLA I, MRAK E, RUBINACCI A, et al. CGRP inhibits osteoprotegerin production in human osteoblast-like cells via cAMP/PKA-dependent pathway[J]. Am J Physiol Cell Physiol, 2006, 291(3): C529–C537. DOI:10.1152/ajpcell.00354.2005 |
| [10] | MRAK E, GUIDOBONO F, MORO G, et al. Calcitonin gene-related peptide (CGRP) inhibits apoptosis in human osteoblasts by beta-catenin stabilization[J]. J Cell Physiol, 2010, 225(3): 701–708. DOI:10.1002/jcp.22266 |
| [11] | ZHANG Y, YANG J, ZHANG P, et al. Calcitonin gene-related peptide is a key factor in the homing of transplanted human MSCs to sites of spinal cord injury[J]. Sci Rep, 2016, 6: 27724. DOI:10.1038/srep27724 |
| [12] | MARUPANTHORN K, TANTRAWATPANC, KHEOLAMAI P, et al. Bone morphogenetic protein-2 enhances the osteogenic differentiation capacity of mesenchymal stromal cells derived from human bone marrow and umbilical cord[J]. Int J Mol Med, 2017, 39(3): 654–662. DOI:10.3892/ijmm.2017.2872 |
| [13] | KIM J, SHIN J M, JEON Y J, et al. Proteomic validation of multifunctional molecules in mesenchymal stem cells derived from human bone marrow, umbilical cord blood and peripheral blood[J]. PLoS ONE, 2012, 7(5): e32350. DOI:10.1371/journal.pone.0032350 |
| [14] | HEO J S, CHOI Y, KIM H S, et al. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue[J]. Int J Mol Med, 2016, 37(1): 115–125. DOI:10.3892/ijmm.2015.2413 |
| [15] | LEE J K, JUNG J S, PARK S H, et al. Deficiency of alpha-calcitonin gene-related peptide induces inflammatory responses and lethality in sepsis[J]. Cytokine, 2013, 64(2): 548–554. DOI:10.1016/j.cyto.2013.07.030 |
| [16] | LONG H, SUN B, CHENG L, et al. miR-139-5p Represses BMSC osteogenesis via targeting Wnt/beta-Catenin signaling pathway[J]. DNA Cell Biol, 2017, 36(8): 715–724. DOI:10.1089/dna.2017.3657 |
| [17] | FAKHRY M, HAMADE E, BADRANB, et al. Molecular mechanisms of mesenchymal stem cell differentiation towards osteoblasts[J]. World J Stem Cells, 2013, 5(4): 136–148. DOI:10.4252/wjsc.v5.i4.136 |
| [18] | MURAKAMI J, ISHⅡ M, SUEHIRO F, et al. Vascular endothelial growth factor-C induces osteogenic differentiation of human mesenchymal stem cells through the ERK and RUNX2 pathway[J]. Biochem Biophys Res Commun, 2017, 484(3): 710–718. DOI:10.1016/j.bbrc.2017.02.001 |
| [19] | LI B, QU C, CHEN C, et al. Basic fibroblast growth factor inhibits osteogenic differentiation of stem cells from human exfoliated deciduous teeth through ERK signaling[J]. Oral Dis, 2012, 18(3): 285–292. DOI:10.1111/j.1601-0825.2011.01878.x |
| [20] | ZHAO Y, ZHANG S, ZENG D, et al. rhPDGF-BB promotes proliferation and osteogenic differentiation of bone marrow stromal cells from streptozotocin-induced diabetic rats through ERK pathway[J]. Biomed Res Int, 2014, 2014: 637415. DOI:10.1155/2014/637415 |
| [21] |
邹薇, 刘慧通, 焦富勇. ERK信号传导通路在人脐带间充质干细胞向成骨细胞分化作用中的研究进展[J].
中国美容医学, 2010, 19(10): 1569–1571.
ZOU W, LIU H T, JIAO F Y. Research associated with the role of the ERK signaling pathway which played in osteogenic differentiation of the human umbilical cord mesenchymal stem cells[J]. Chin J Aesthetic Med, 2010, 19(10): 1569–1571. DOI:10.3969/j.issn.1008-6455.2010.10.069 |
| [22] | KIM J M, LEE J E, RYU S H, et al. Chlormadinone acetate promotes osteoblast differentiation of human mesenchymal stem cells through the ERK signaling pathway[J]. Eur J Pharmacol, 2014, 726: 1–8. DOI:10.1016/j.ejphar.2014.01.013 |
| [23] | ONO T, TAKAYANAGI H. Osteoimmunology in Bone Fracture Healing[J]. Curr Osteoporos Rep, 2017, 15(4): 367–375. DOI:10.1007/s11914-017-0381-0 |
| [24] | FIERRO F A, NOLTA J A, ADAMOPOULOS I E. Concise review: stem cells in osteoimmunology[J]. Stem Cells, 2017, 35(6): 1461–1467. DOI:10.1002/stem.2625 |



