2. 050051 石家庄,河北省人民医院:神经外二科
2. Second Department of Neurosurgery, Hebei People's Hospital, Shijiazhuang, Hebei Province, 050051, China
胶质瘤是最常见的中枢神经系统肿瘤,首要治疗方法是通过手术切除,切除术中常存在肿瘤边界不清、与重要功能区或致痫灶关系密切难以切除等问题。目前临床常用的定位方法有CT、MRI、DTI、MRA、MEG、神经导航、术中超声、术中荧光显像、术中MRI等,对于手术入路的设计和方案的选择均具有一定的辅助作用,但也有各自的缺陷和不足,综合应用多种影像模式即多模态影像能够取长补短获得更好的结果[1]。本研究回顾性分析了手术切除的42例胶质瘤患者临床资料,对多模态影像神经导航联合术中超声在切除颅内胶质瘤中的应用价值进行总结分析。
1 资料与方法 1.1 一般情况收集2007年12月31日至2014年6月30日在河北省人民医院神经外二科进行颅内胶质瘤手术的42例患者的临床资料(根据2007年WHO标准符合胶质瘤诊断),其中男性31例,女性11例,年龄19~70(48.2±12.9)岁。本研究经过河北省人民医院伦理委员会审批[(2016)科伦审第(45)号]。
纳入标准:使用多模态影像神经导航联合术中超声辅助下进行手术的胶质瘤患者。排除标准:经视频脑电监测发现多灶性癫痫者;结合MRI等影像资料、脑电监测结果及癫痫发作特点考虑致痫灶与胶质瘤无直接关系者。
1.2 临床表现26例患者首发症状为癫痫,33例患者出现过至少1次癫痫发作。发作类型:复杂部分性癫痫发作9例,简单部分性发作14例,全面性强直阵挛性发作10例。14例患者存在肢体麻木、无力症状,12例患者伴头痛、眼底水肿,3例患者有视野缺损。13例患者神经系统查体阴性。
1.3 影像学检查全部患者行CT、MRI、DTI、MRA检查。肿瘤位于额叶16例,颞叶9例,枕叶4例,顶叶2例,多脑叶11例。MRI测量病灶直径2.1~9.6(4.3±1.9)cm。
1.4 致痫灶定位与脑功能区定位全部患者应用美国Nicolet64导视频脑电监测系统,按照国际10/20系统安置电极,描记清醒、睡眠期脑电,捕捉发作期脑电图 3~5次,根据发作间期和发作期异常放电,结合发作期临床表现,定位致痫灶。
全部患者行MEG检查。采用芬兰Neuromeg公司设计的MEG-Segmentation软件对MRI原始图像进行三维重建,获得三维立体脑图像。对患者进行体感诱发磁场(somatosensory evoked magnetic field,SEF)、运动诱发磁场(motor evoked magnetic field,MEF)、听觉诱发磁场(auditory evoked magnetic field,AEF)以及视觉诱发磁场(visual evoked magnetic field,MEF)刺激,用芬兰Neuromeg公司设计的MEG-MRI Integration软件将MEG所获得的脑功能信息与MRI获得的解剖结构图像进行叠加,完成脑功能图像(图 1)。
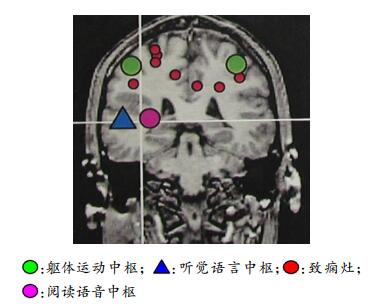
|
| 图 1 右额颞胶质瘤患者脑磁图 |
1.5 手术方法
配合美国Medtronic Stealhealth S7手术导航系统。术前根据CT、MRI、DTI、MRA MEG等信息,辅助神经导航勾画确定切除范围和功能区保护范围,包括肿瘤、致痫灶、功能区、重要神经纤维、血管结构等(图 2), 设计手术入路。
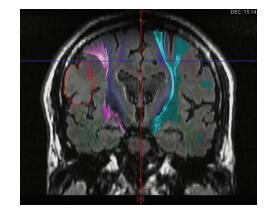
|
| 图 2 多模态影像神经导航融合图像显示右额颞胶质瘤,DTI提示右侧锥体束受损 |
常规开颅后剪开硬膜,根据多模态影像神经导航指引结合大脑皮层沟回解剖结构,初步确定手术切除区域及手术入路。术中超声仪器选用GE-Logiq 5彩色多普勒超声仪,随机配备8C凸阵术中专用探头,探头频率5.0~10.0 MHz。超声探头上涂抹耦合剂,外包无菌塑料保护套,置于脑组织表面,进行冠状、矢状、水平等多平面探测,在导航的基础上进行超声观察血管情况,确定手术入路。
显微镜下切除肿瘤及致痫灶,妥善止血清理术腔,将术腔内注满生理盐水,将探头置于术腔再次行超声扫描以确定已切除范围,如果发现有异常声影需扩大切除范围者,进行再次切除。再次切除后的组织单独留取病理标本,以便术后验证并分析患者术中超声表现及定位意义。
患者行肿瘤切除术同时行致痫灶切除,肿瘤切除前后均在多模态影像神经导航、术中超声技术指导下进行皮层脑电监测,以达到最大程度切除致痫灶。在功能区监测到的致痫灶,进行皮层热灼术,至异常放电消失为止。
2 结果 2.1 手术情况及病理类型正常脑组织在术中超声表现为均匀的低回声区,脑室及脑脊液表现为无回声区。颅内胶质瘤的超声表现与正常脑组织有一定程度的差别。术中超声监测病灶直径2.5~11.4(5.3±2.1)cm,较术前MRI测量的体积稍大。
低级别胶质瘤的术中超声表现为局限性稍高回声区,边界清晰,形态较为规整,内部回声较为均匀,瘤周轻度水肿,部分伴有点状强回声的钙化灶,后方多不伴有声影(图 3)。高级别胶质瘤在术中超声表现为弥漫性高回声区,边界不清,形态多数不规则,内部常伴有低回声或无回声的坏死囊变区,瘤周水肿较为明显,肿瘤内部很少有钙化的强回声(图 4)。
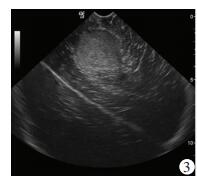
|
| 图 3 低级别星形胶质细胞瘤超声显示局限性稍高回声区,边界清晰,内部回声较均匀 |
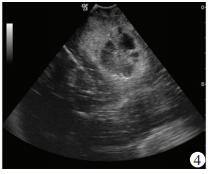
|
| 图 4 胶质母细胞瘤超声显示弥漫性高回声区,边界不清,内部低回声坏死囊变区 |
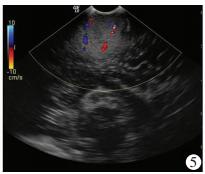
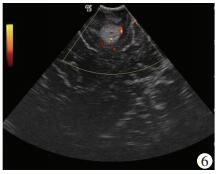
42例胶质瘤切除前在多模态影像神经导航的基础上均进行了超声监测,发现其中有9例胶质瘤的周边有大血管环绕或紧邻(图 5),因此调整了手术入路,此9例胶质瘤均为高级别胶质瘤。依照神经导航设计范围切除肿瘤后,行术中超声检查,发现20例有残余肿瘤(图 6),需再次切除,其中低级别胶质瘤8例,高级别胶质瘤12例。残余肿瘤直径1.2~4.3(2.4±0.4)cm。经术后病理验证,再次切除的部分均存在肿瘤细胞。
|
| 图 5 超声显示高级别胶质瘤周边包绕血管,需侧方位入路切除 |
|
| 图 6 术中超声显示低级别胶质瘤切除术后仍有少量残留,需进一步切除 |
全部手术患者无术后血肿、感染、偏瘫出现。术后48 h复查MRI,与术前肿瘤对比切除程度。MRI显示肿瘤全切34例。大部切除8例。术后病理报告示低级别胶质瘤30例,高级别胶质瘤12例。病理类型见表 1。
| 病理类型 | 分级 | 例数 |
| 星形胶质细胞瘤 | Ⅰ级 | 13 |
| Ⅱ级 | 9 | |
| Ⅲ级 | 8 | |
| Ⅳ级 | 4 | |
| 少突胶质细胞瘤 | Ⅱ级 | 5 |
| 胚胎发育不良性神经上皮瘤 | Ⅰ级 | 2 |
| 血管中心性胶质瘤 | Ⅰ级 | 1 |
2.2 肿瘤控制情况
42例患者随访13~47个月,平均28.4个月。4例多发胶质瘤患者分别于治疗后17~41个月肿瘤复发、死亡。1例少突胶质细胞瘤患者、6例星形胶质细胞瘤Ⅲ级患者术后25~39个月肿瘤复发,再次手术切除。其余患者肿瘤控制良好,未见肿瘤复发征象。
2.3 癫痫控制情况全部患者术后规律服用抗癫痫药物,定期复查VEEG、血药浓度、肝肾功能等检查。术后1年评估癫痫控制情况,至少有1次癫痫发作的33例患者中,Engel’s Ⅰ级17例,Engel’sⅡ级11例,Engel’s Ⅲ级5例。
3 讨论胶质瘤是颅内最常见的恶性肿瘤,其治疗方式是以手术为主,结合放疗及化疗的综合治疗。其中手术的切除范围是决定生存期的关键,胶质瘤和正常脑组织分界不清,手术切除不彻底是复发率较高的重要因素。
低级别胶质瘤显微镜下全切除者,以下7个条件如满足3条及以上为高危,行术后辅助放疗:星形细胞瘤,肿瘤直径超过6 cm,肿瘤侵及双侧大脑半球,年龄>40岁,卡氏功能状态评分 < 70,术前神经功能明显受损,未发现1p19q联合缺失或IDH1/IDH2突变者。其余做定期复查,暂不做进一步治疗[2]。低级别胶质瘤如术后有残留,行三维适形放疗。高级别胶质瘤术后均辅助放化疗。
多模态影像神经导航可对患者病变部位进行术前定位,可以此为参考准确找到并切除肿瘤。但术中脑脊液的丢失,脱水剂的应用以及重力的影响等因素,往往容易造成脑组织的移位,导致精确度下降。再者,部分胶质瘤术前MRI影像与正常脑组织分界不清,神经导航也容易出现偏差[3]。术中超声具有可反复进行扫查、实时定位的优点,可准确判断出病灶的位置、病灶和手术切口的关系以及病灶切除的范围,同时超声能够及时纠正组织移位方向和距离,能够实时判别肿瘤内部及周边血管的走行情况,均是神经导航系统不能比拟的[4-5]。
本组42例胶质瘤患者术前在神经导航的基础上均进行了超声监测,确定胶质瘤的边界以及与血管的毗邻关系,发现9例胶质瘤的内部(或周边)血运丰富,或毗邻重要血管,因此我们在术中超声实时引导下调整了手术入路,避免大血管及重要功能区的损伤。此9例胶质瘤患者术后病理均为高级别胶质瘤,原因可能是胶质瘤血管生成程度与肿瘤的恶性程度有关,级别越高的胶质瘤新生血管密度越大。同时,高级别胶质瘤的水肿明显,对周围的脑组织压迫程度较严重,更容易造成血管移位。
依照神经导航设计范围切除肿瘤后,行术中超声检查,发现高级别和低级别的胶质瘤残留程度具有一定差异。高级别胶质瘤恶性程度越高,对周围组织的浸润越严重,因此导致手术残留率较高[6-7]。
水肿是胶质瘤的一大特征,MRI影像上与脑胶质瘤不易区分,容易将水肿组织切除而带来不必要的损伤。水肿组织即使在超声的引导下有时也很难区分。在保留神经功能的同时实施肿瘤根治术可以提高临床治疗有效率[7]。肿瘤切除后,术中再次行超声或超声造影观察肿瘤残腔的情况,参照文献[8-9]对残留的判断方法进行判断,通过术中超声对疑似残留的组织再次切除并送病理检查,可提高了胶质瘤的全切率及患者生存期。
超声影像容易受多种因素的影响,还存在空间性、对比性差的缺点。相信随着更小、分辨率更高的探头出现,超声影像清晰度的提高,以及超声与多模态影像神经导航、神经内镜技术、术中荧光等技术有效的结合,术中实时超声定位在功能区胶质瘤术中的应用会更加完善[10-13]。
对胶质瘤继发性癫痫患者癫痫的治疗,单纯切除肿瘤是远远不够的,需要将致痫灶一并切除,致痫灶的切除比胶质瘤病灶的切除更为重要[14]。只有通过缜密的术前评估、明确致痫灶与胶质瘤的位置关系,切除肿瘤并清除致痫灶,才能确保疗效。希望通过大范围切除胶质瘤来控制癫痫发作的做法,不能提高癫痫控制率。
MEG对癫痫患者术前语言、运动、感觉区精确定位评估具有重要意义,MEG指导功能区癫痫手术入路设计,与多模态影像神经导航结合应用于手术中,既可以显示胶质瘤位置,又能反映癫痫灶和脑功能区域[15]。将神经导航系统和MEG图像资料进行融合,通过观察棒的指引,在实际解剖部位区显示功能图像,可为避免术后出现语言、记忆、运动、感觉等神经功能障碍的问题提供了重要信息。
神经导航系统目前已由单纯解剖导航向功能导航方向发展,通过对CT、MR、MEG等多种影像资料融合后的多模态影像神经导航,可以在术前对脑肿瘤、致痫灶位置及邻近重要功能区进行准确定位,确定边界,合理规划手术切口及入路,避开重要功能结构, 联合术中超声能在术中实时定位示踪,实现最大程度切除肿瘤及致痫灶,降低术后神经功能障碍的发生率。
| [1] | SELBEKK T, JAKOLA A S, SOLHEIM O, et al. Ultrasound imaging in neurosurgery: approaches to minimize surgically induced image artefacts for improved resection control[J]. ACTA Neurochir, 2013, 155(6): 973–980. DOI:10.1007/s00701-013-1647-7 |
| [2] |
《中国中枢神经系统胶质瘤诊断和治疗指南》编写组. 中国中枢神经系统胶质瘤诊断与治疗指南(2015)[J].
中华医学杂志, 2016, 96(7): 485–509.
China Central Nervous System Glioma Diagnosis And Treatment Guideline Writing Group. China central nervous system glioma diagnosis and treatment guideline (2015)[J]. Nat Med J China, 2016, 96(7): 485–509. DOI:10.3760/cma.j.issn.0376-2491.2016.07.003 |
| [3] | COENEN V A, KRINGS T, WEIDEMANN J, et al. Sequential visualization of brain and fiber tract deformation during intracranial surgery with three-dimensional ultrasound: an approach to evaluate the effect of brain shift[J]. Neurosurgery, 2005, 56(1 Suppl): 133–141. DOI:10.1227/01.neu.0000144315.35094.5f |
| [4] | RENNER C, LINDNER D, SCHNEIDER J P, et al. Evaluation of intra-operative ultrasound imaging in brain tumor resection: a prospective study[J]. Neurol Res, 2005, 27(4): 351–357. DOI:10.1179/016164105X40039 |
| [5] | YAMADA H, FUJIMATSU T, SUZUKI H, et al. Surgical excision of left atrial myxoma shortly after cerebral embolism; report of a case[J]. Kyobu Geka, 2015, 68(3): 221–223. |
| [6] | UNSGAARD G, OMMEDAL S, MULLER T, et al. Neuronavigation by intraoperative three-dimensional ultrasound: initial experience during brain tumor resection[J]. Neurosurgery, 2002, 50(4): 804–812. DOI:10.1097/00006123-200204000-00022 |
| [7] | COBURGER J, MERKEL A, SCHERER M, et al. Low-grade glioma surgery in intraoperative magnetic resonance imaging: results of a multicenter retrospective assessment of the german study group for intraoperative magnetic resonance imaging[J]. Neurosurgery, 2016, 78(6): 775–786. DOI:10.1227/NEU.0000000000001081 |
| [8] | KANNO S, TOMIZAWA A, HIURA T, et al. Inhibitory effects of naringenin on tumor growth in human cancer cell lines and sarcoma S-180-implanted mice[J]. Biol Pharm Bull, 2005, 28(3): 527–530. DOI:10.1248/bpb.28.527 |
| [9] | WOYDT M, PEREZ J, MEIXENSBERGER J, et al. Intra-operative colour-duplex-sonography in the surgical management of cerebral AV-malformations[J]. Acta Neurochir (Wien), 1998, 140(7): 689–698. DOI:10.1007/s007010050164 |
| [10] | LIN J, JANDIAL R, NESBIT A, et al. Current and emerging treatments for brain metastases[J]. Oncology (Williston Park, NY), 2015, 29(4): 250–257. |
| [11] |
葛亚娟, 杨磊, 高军喜, 等. 术中超声造影定量分析在诊断不同级别胶质瘤瘤体及瘤周水肿的临床价值[J].
中国超声医学杂志, 2015, 31(3): 193–196.
GE Y J, YANG L, GAO J X, et al. The clinical value of quantitative analysis of contrast-enhanced ultrasonography in the diagnosis of different grades of glioma in tumor and peritumoral edema[J]. Chin J Ultrasound Med, 2015, 31(3): 193–196. |
| [12] |
贺焱, 何文, 杜丽娟, 等. 术中超声造影评价脑胶质瘤病理分级及瘤周水肿[J].
中华超声影像学杂志, 2011, 20(12): 1036–1039.
HE Y, HE W, DU L J, et al. Intraoperative contrast-enhanced ultrasonic imaging in the evaluation of pathologic grades of cerebral gliomas and peritumoral cerebral edema[J]. Chin J Ultrasonograph, 2011, 20(12): 1036–1039. DOI:10.3760/cma.j.issn.1004-4477.2011.12.008 |
| [13] |
王佳, 段云友, 刘禧, 等. 术中超声引导脑胶质瘤手术对患者生存时间的评价[J].
中华超声影像学杂志, 2013, 22(11): 941–944.
WANG J, DUAN Y Y, LIU X, et al. Evaluation of intra-operative ultrasonography-guided cerebral glioma surgery on long-term follow-up results of patients[J]. Chin J Ultrasonograph, 2013, 22(11): 941–944. DOI:10.3760/cma.j.issn.1004-4477.2013.11.007 |
| [14] |
郭韬, 刘倩薇, 陈尧, 等. 脑磁图联合弥散张量成像在常规磁共振成像阴性的额叶局灶性皮质发育不良术前评估中的应用价值[J].
中国全科医学, 2015, 18(6): 729–732.
GUO T, LIU Q W, CHEN Y, et al. Values of combined application of magnetoencephalography and diffusion tensor imaging in the preoperative evaluation of mri-negative frontal focal cortical dysplasia[J]. Chin Gen Prac, 2015, 18(6): 729–732. DOI:10.3969/j.issn.1007-9572.2015.06.030 |
| [15] |
郭韬, 梁传栋, 吴玉锦, 等. 脑磁图联合DTI对大脑半球萎缩继发癫痫患者术前功能区评估的价值[J].
中华神经医学杂志, 2014, 13(9): 919–924.
GUO T, LIANG C D, WU Y J, et al. Preoperative functional assessment of epilepsy patients secondary to cerebral hemisphere atrophy by magnetoencephalogram and diffusion tensor imaging[J]. Chin J Neuromed, 2014, 13(9): 919–924. DOI:10.3760/cma.j.issn.1671-8925.2014.09.012 |



