胃癌(stomach cancer)是全世界发病率最高的肿瘤之一,也是中国的第2大常见肿瘤。我国的胃癌患病率和死亡率均是世界水平的2倍多[1]。相比其他国家,我国的胃癌防治形势更加严峻。尽管近年来胃癌的综合治疗取得一定进步,但胃癌患者5年总体生存率仍不令人满意[2]。化疗敏感性降低是胃癌患者治疗失败的主要原因之一。顺铂(cisplatin)是治疗胃癌的一线化疗药,但顺铂化疗敏感性降低在临床上较为普遍,成为影响胃癌预后的重要因素。因此,深入研究胃癌顺铂化疗敏感性降低的分子机制,对胃癌的治疗有重要意义。细胞自噬是真核生物中一种高度保守的分解和回收细胞内物质(包括蛋白质、损伤的细胞器等)的过程。大量研究表明,细胞自噬不仅参与维持生理状态下的细胞稳态,而且与肿瘤的发生发展[3-5]、化疗敏感性[6-10]等密切相关。近年研究表明,升高的自噬水平能抑制肿瘤细胞对顺铂的化疗敏感性。但目前顺铂激活细胞自噬的机制尚不清楚。文献[11]报道,顺铂发挥作用是通过与DNA结合,引起交叉联结,造成DNA损伤,进而杀伤肿瘤细胞。因此,DNA损伤修复能力对顺铂化疗敏感性有着重要作用[12]。O-6-甲基鸟嘌呤-DNA甲基转移酶(O-6-methylguanine-DNA methyl-transferase,MGMT)能够将DNA鸟嘌呤上的烷基转移到自身,使DNA鸟嘌呤还原,而MGMT则因烷基化而失去活性,最终被细胞内的蛋白酶体系统降解清除,从而完成修复过程。文献[13]报道,在胆囊癌细胞中,顺铂能抑制MGMT启动子转录活性,从而抑制MGMT mRNA表达。亦有研究表明,DNA损伤可激活细胞自噬[14]。由此我们推测,顺铂可能通过影响DNA损伤修复蛋白MGMT从而激活细胞自噬,影响肿瘤细胞化疗敏感性。本研究旨在明确MGMT与细胞自噬的相互关系,探讨顺铂激活肿瘤细胞自噬的具体机制,以求为增强顺铂在胃癌中的化疗敏感性提供新的策略。
1 材料与方法 1.1 细胞株人胃癌细胞株SGC-7901系本科实验室保存。
1.2 主要试剂和药品高糖DMEM培养基和青霉素链霉素双抗溶液(HyClone公司),胎牛血清(Biological Industries公司),LC3、MGMT抗体(Cell Signal Technology公司),p62抗体(Santa公司),GAPDH抗体、IP蛋白裂解液、PMSF、BCA蛋白浓度测定试剂盒、山羊抗鼠和山羊抗兔二抗(碧云天公司),qRT-PCR引物(上海捷瑞公司),过表达MGMT慢病毒载体(吉玛公司),顺铂(齐鲁制药)。
1.3 方法 1.3.1 细胞培养人胃癌SGC-7901细胞置于含1%青霉素链霉素双抗溶液和10%胎牛血清的高糖DMEM培养基中,于5%CO2、37 ℃细胞培养箱中培养。
1.3.2 Western blot法检测自噬相关蛋白、MGMT蛋白IP裂解液提取总蛋白,经BCA蛋白浓度测定试剂盒定量,加入SDS沸水浴5 min使蛋白变性。蛋白上样量为30 μg,经SDS-PAGE凝胶电泳分离,湿转法将蛋白转移0.2 μm PVDF膜上,5%脱脂牛奶室温封闭2 h,一抗4 ℃过夜孵育(MGMT、LC3、1 :1 000,p62:1 :500,GAPDH:1 :10 000),二抗孵育2 h(山羊抗鼠1 :5 000,山羊抗兔1 :10 000),ECL化学发光法曝光。
1.3.3 qRT-PCR法检测MGMT基因mRNA表达水平TRIzol法提取细胞总RNA,经TaKaRa反转录酶试剂盒逆转录得到cDNA,按说明书使用TaKaRa的SYBRⅡ试剂检测MGMT基因mRNA水平,PCR反应体系为20 μL。GAPDH作为内参,每个标本均设3个复孔。MGMT引物上游:5′-TTTTCCAGCAAGAGTCGTTCAC-3′,下游:5′-GGGACAGGATTGCCTCTCAT-3′,片段长度157 bp;GAPDH引物上游:5′-GGAGCGAGATCCCTCCAAAAT-3′,5′-GGCTGTTGTCATACTTCTCATGG-3′,片段长度191 bp。引物由上海捷瑞生物工程公司合成。数据分析采用ΔΔCt法。
1.3.4 GFP-LC3质粒转染检测细胞自噬小体水平胃癌SGC-7901细胞在12孔板中爬片,过夜培养,当细胞融合至60%~70%时,转染GFP-LC3表达质粒,转染6 h后换液。24 h后加入终浓度为10 μg/mL的顺铂和培养基预混液,处理24 h后,于激光共聚焦显微镜下采集图像。
1.4 统计学分析采用SPSS 22.0统计软件,计量资料数据以x±s表示,两组间比较用t检验以及单因素方差分析。检验水准:α=0.05。
2 结果 2.1 顺铂激活胃癌SGC-7901细胞自噬,且呈剂量依赖性为证明在胃癌细胞中顺铂是否激活细胞自噬,分别用不同浓度的顺铂处理胃癌SGC-7901细胞24 h,Western blot检测自噬相关蛋白变化情况。结果显示,随着顺铂浓度升高,自噬底物蛋白p62逐渐降低,自噬标志分子Ⅱ和Ⅰ型微管相关蛋白轻链3(mircotuble-associated protein light chain 3,LC3)的比值逐渐增高(图 1)。
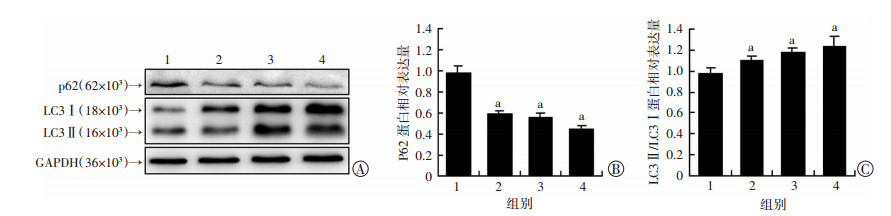
|
|
1:对照组;2~4:5、10、20 μg/mL顺铂处理组 A:Western blot检测顺铂处理24 h后p62和LC3蛋白表达;B、C:半定量分析结果a: P < 0.05,与对照组比较 图 1 Western blot检测顺铂激活胃癌SGC-7901细胞自噬 |
同时,用10 μg/mL顺铂处理转染GFP-LC3表达质粒的胃癌SGC-7901细胞24 h后,激光共聚焦显微镜下观察发现,与对照组相比,顺铂组胃癌SGC-7901细胞中的自噬小体数量明显增加(图 2)。说明顺铂可激活胃癌SGC-7901细胞自噬,且呈剂量依赖性。

|
| A:对照组;B:10 μg/mL顺铂处理组 ↑:自噬小体 图 2 顺铂处理胃癌SGC-7901细胞后GFP-LC3荧光蛋白变化 |
2.2 顺铂剂量依赖性抑制胃癌SGC-7901细胞MGMT水平
为证明MGMT是否参与顺铂对胃癌SGC-7901细胞的作用,分别采用qRT-PCR和Western blot检测经不同浓度的顺铂处理胃癌SGC-7901细胞24 h后,MGMT mRNA及蛋白水平变化。如图 3所示,随着顺铂浓度增大,MGMT mRNA(P < 0.05)和蛋白水平均呈剂量依赖性减低。说明顺铂能剂量依赖性地抑制MGMT。

|
|
1:对照组;2~4:5、10、20 μg/mL顺铂处理组 a:P < 0.05,与对照组比较 A:qRT-PCR检测;B、C:Western blot检测及半定量分析 图 3 qRT-PCR与Western blot检测顺铂处理胃癌SGC-7901细胞24 h后MGMT mRNA和蛋白水平变化 |
2.3 MGMT抑制胃癌SGC-7901细胞基础自噬水平
在胃癌SGC-7901细胞中用慢病毒载体过表达MGMT,qRT-PCR结果表明,过表达MGMT组的MGMT mRNA相对表达量(523.100±19.000)明显高于空载组(1.001±0.029,P < 0.05)。Western blot检测结果表明,与空载组相比,过表达MGMT组可有效地高表达MGMT(图 4A、B)。同时,与空载组相比,过表达MGMT组的自噬底物蛋白p62增加,自噬标志分子LC3Ⅱ/LC3Ⅰ值显著下降(图 4C~E)。表明过表达MGMT可抑制细胞基础自噬水平。
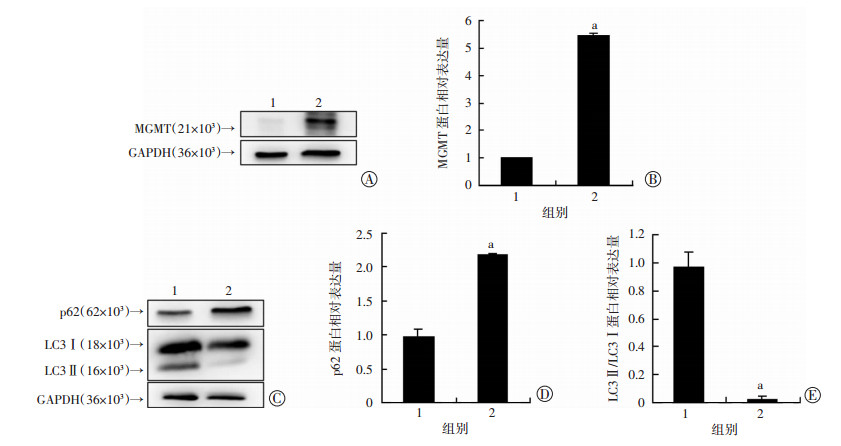
|
|
1:空载组;2:过表达MGMT组 a:P < 0.05,与空载组比较 A、B:Western blot法验证MGMT过表达效果及其半定量分析;C~E:Western blot检测过表达MGMT后胃癌SGC-7901细胞自噬水平及其半定量分析 图 4 MGMT抑制胃癌SGC-7901细胞基础自噬水平 |
2.4 MGMT抑制顺铂激活的胃癌SGC-7901细胞自噬
为进一步明确MGMT对胃癌SGC-7901细胞自噬的抑制作用,我们接下来在MGMT组和空载组细胞中,分别采用10 μg/mL顺铂处理细胞24 h,经Western blot检测自噬相关蛋白。结果表明,与空载组相比,MGMT组的p62蛋白水平明显升高,LC3Ⅱ/LC3Ⅰ值明显降低(图 5)。表明过表达MGMT能抑制顺铂激活的细胞自噬。
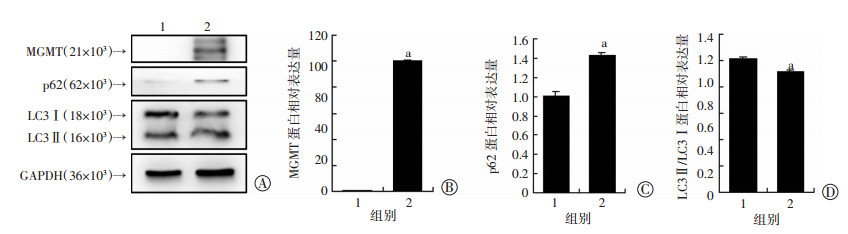
|
|
1:空载组+10 μg/mL顺铂;2:过表达MGMT组+10 μg/mL顺铂 A:Western blot法检测空载组和过表达MGMT组经顺铂处理后细胞自噬水平;B~D:半定量分析a:P < 0.05,与空载组+10 μg/mL顺铂比较 图 5 Western blot检测顺铂处理过表达MGMT胃癌SGC-7901细胞后自噬水平 |
3 讨论
顺铂是临床上常用的一种细胞非特异性化疗药,具有抗癌谱广、作用强、与多种抗肿瘤药物有协同作用、价格经济等优点,对于胃癌、头颈部鳞癌、卵巢癌、肺癌等肿瘤有良好的治疗效果。但顺铂耐药在临床上屡见不鲜。因此,研究如何提高顺铂化疗敏感性符合临床需求。
细胞自噬被认为是一种能降解、循环利用蛋白质和细胞器、为细胞提供能量的保护性机制,能减少饥饿、缺氧、能量缺乏和放化疗等外界刺激对细胞的影响。近年来研究发现,细胞自噬与肿瘤化疗敏感性之间存在紧密联系,因此调控自噬也被认为是提高肿瘤细胞化疗敏感性的可能方法之一[15]。既往研究表明,在鼻咽癌中,使用自噬抑制剂氯喹可以增加鼻咽癌细胞对顺铂的敏感性[16];抑制细胞自噬水平,可减轻骨肉瘤细胞的顺铂耐药[17]。MA等[18]研究亦发现,在恶性胶质瘤细胞中,抑制自噬可促进顺铂诱导的细胞凋亡。以上研究表明,在多种肿瘤中顺铂均可激活细胞自噬,抑制细胞自噬能增强肿瘤细胞对顺铂的化疗敏感性[19-23]。本研究通过Western blot检测自噬底物蛋白p62、自噬标志分子LC3Ⅱ/LC3Ⅰ和GFP-LC3荧光显像等多种方法,评价顺铂激活的胃癌SGC-7901细胞自噬水平,发现顺铂可剂量依赖性激活胃癌SGC-7901细胞自噬,提示激活细胞自噬可能是顺铂化疗敏感性降低的原因之一。但目前顺铂激活细胞自噬的具体机制尚不明确。文献[24]报道,葫芦素B造成DNA损伤后,可通过激活PTEN信号通路进而激活保护性细胞自噬。遗传毒性物质造成DNA损伤后,其主要应答分子E2F1可上调LC3、自噬相关基因4和5(autophagy-related gene, ATG)、损伤相关自噬调节器(damage-related autophagy modulator, DRAM)等,进而激活细胞自噬[25]。提示药物造成的DNA损伤及DNA修复过程可激活细胞自噬。
MGMT是一种重要的DNA损伤修复分子。作为一种“自杀式”的DNA损伤修复酶,文献[18]报道在顺铂处理胆囊癌细胞后,MGMT mRNA表达水平下降。本研究通过qRT-PCR检测表明,在胃癌SGC-7901细胞中,顺铂可剂量依赖性地抑制MGMT mRNA水平,Western blot检测结果显示,顺铂亦可剂量依赖性地抑制MGMT的蛋白水平,提示MGMT可能参与了顺铂诱导的胃癌SGC-7901细胞损伤修复过程。同时,过表达MGMT的胃癌SGC-7901细胞中基础自噬水平及顺铂激活的细胞自噬水平均下降,顺铂可以通过抑制MGMT进而激活胃癌SGC-7901细胞自噬,为顺铂激活细胞自噬的具体机制提供了新的方向。本研究不足之处在于尚未解析MGMT抑制胃癌SGC-7901细胞自噬的具体机制,我们拟从MGMT影响自噬相关基因表达的角度,筛选自噬相关基因,从而进一步佐证MGMT对自噬的抑制作用。
综上所述,本研究发现顺铂可剂量依赖性地抑制胃癌SGC-7901细胞MGMT表达,进而激活细胞自噬、降低顺铂化疗敏感性,为更好地增强顺铂治疗胃癌临床疗效提供新策略。
| [1] | JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69–90. DOI:10.3322/caac.20107 |
| [2] | ALMHANNA K. Targeted therapy for gastric adenocarcinoma[J]. Adv Pharmacol, 2012, 65: 437–470. DOI:10.1016/B978-0-12-397927-8.00014-2 |
| [3] | CHOI A M, RYTER S W, LEVINE B. Autophagy in human health and disease[J]. New Engl J Med, 2013, 368(7): 651–662. DOI:10.1056/NEJMra1205406 |
| [4] | SHINTANI T, KLIONSKY D J. Autophagy in health and disease: a double-edged sword[J]. Science, 2004, 306(5698): 990–995. DOI:10.1126/science.1099993 |
| [5] | ZHAO X, HE Y, CHEN H. Autophagic tumor stroma: mechanisms and roles in tumor growth and progression[J]. Int J Cancer, 2013, 132(1): 1–8. DOI:10.1002/ijc.27664 |
| [6] |
柴婷, 任爽, 张燕燕, 等. 抑制自噬对贝伐单抗诱导的结肠癌HCT116细胞凋亡的影响[J].
郑州大学学报(医学版), 2017, 52(3): 356–359.
CHAI T, REN S, ZHANG Y Y, et al. Effect of autophagy inhibition on bevacizumab-induced apoptosis of human colon cancer HCT116 cells[J]. J Zhengzhou Univ(Med Sci), 2017, 52(3): 356–359. DOI:10.13705/j.issn.1671-6825.2017.03.028 |
| [7] | YAO C J, CHOW J M, CHUANG S E, et al. Induction of forkhead class box O3a and apoptosis by a standardized ginsenoside formulation, KG-135, is potentiated by autophagy blockade in A549 human lung cancer cells[J]. J Ginseng Res, 2017, 41(3): 247–256. DOI:10.1016/j.jgr.2016.04.003 |
| [8] | HU F, GUO X L, ZHANG S S, et al. Suppression of p53 potentiates chemosensitivity in nutrient-deprived cholangiocarcinoma cells via inhibition of autophagy[J]. Oncol Lett, 2017, 14(2): 1959–1966. DOI:10.3892/ol.2017.6449 |
| [9] | CHEN Q C, YE L, FAN J J, et al. Autophagy suppression potentiates the anti-glioblastoma effect of asparaginase in vitro and in vivo[J]. Oncotarget, 2017, 8: 91052–91066. DOI:10.18632/oncotarget.19409 |
| [10] | LIU J, CHEN Z, GUO J, et al. Ambra1 induces autophagy and desensitizes human prostate cancer cells to cisplatin[J]. Biosci Rep, 2017 Nov 3. pii: BSR20170770. DOI: 10.1042/BSR20170770.[Epubaheadofprint] |
| [11] | TRIMMER E E, ESSIGMANN J M. Cisplatin[J]. Essays Biochem, 1999, 34: 191–211. DOI:10.1042/bse0340191 |
| [12] | OLAUSSEN K A, DUNANT A, FOURET P, et al. DNA repair by ERCC1 in non-small-cell lung cancer and cisplatin-based adjuvant chemotherapy[J]. New Engl J Med, 2006, 355(10): 983–991. DOI:10.1056/NEJMoa060570 |
| [13] | SATO K, KITAJIMA Y, NAKAGAWACHI T, et al. Cisplatin represses transcriptional activity from the minimal promoter of the O6-methylguanine methyltransferase gene and increases sensitivity of human gallbladder cancer cells to 1-(4-amino-2-methyl-5-pyrimidinyl) methyl-3-2-chloroethyl)-3-nitrosourea[J]. Oncol Rep, 2005, 13(5): 899–906. |
| [14] |
王越, 刘春禹, 王增艳, 等. 土槿皮乙酸通过DNA损伤反应诱导细胞自噬来抑制凋亡[J].
吉林中医药, 2017, 37(4): 381–384.
WANG Y, LIU C Y, WANG Z Y, et al. Pseudolaric acid b induced autophagy through dna damage response to inhibit apoptosis[J]. Jilin J Tradit Chin Med, 2017, 37(4): 381–384. DOI:10.13463/j.cnki.jlzyy.2017.04.017 |
| [15] | LEI Y, ZHANG D, YU J, et al. Targeting autophagy in cancer stem cells as an anticancer therapy[J]. Cancer Lett, 2017, 393: 33–39. DOI:10.1016/j.canlet.2017.02.012 |
| [16] | SU Z, LI G, LIU C, et al. Autophagy inhibition impairs the epithelial-mesenchymal transition and enhances cisplatin sensitivity in nasopharyngeal carcinoma[J]. Oncol Lett, 2017, 13(6): 4147–4154. DOI:10.3892/ol.2017.5963 |
| [17] | LI Y, JIANG W, HU Y, et al. MicroRNA-199a-5p inhibits cisplatin-induced drug resistance via inhibition of autophagy in osteosarcoma cells[J]. Oncol Lett, 2016, 12(5): 4203–4208. DOI:10.3892/ol.2016.5172 |
| [18] | MA B, YUAN Z, ZHANG L, et al. Long non-coding RNA AC023115.3 suppresses chemoresistance of glioblastoma by reducing autophagy[J]. Biochim Biophys Acta, 2017, 1864(8): 1393–1404. DOI:10.1016/j.bbamcr.2017.05.008 |
| [19] | DONG X, WANG Y, ZHOU Y, et al. Aquaporin 3 facilitates chemoresistance in gastric cancer cells to cisplatin via autophagy[J]. Cell Death Discov, 2016, 2: 16087. DOI:10.1038/cddiscovery.2016.87 |
| [20] | SHIN D, KIM E H, LEE J, et al. RITA plus 3-MA overcomes chemoresistance of head and neck cancer cells via dual inhibition of autophagy and antioxidant systems[J]. Redox Biol, 2017, 13: 219–227. DOI:10.1016/j.redox.2017.05.025 |
| [21] | ZHU Q, LI H, LIU Y, et al. Knockdown of CFTR enhances sensitivity of prostate cancer cells to cisplatin via inhibition of autophagy[J]. Neoplasma, 2017, 64(5): 709–717. DOI:10.4149/neo_2017_508 |
| [22] | MIYAMOTO M, TAKANO M, AOYAMA T, et al. Inhibition of autophagy protein LC3A as a therapeutic target in ovarian clear cell carcinomas[J]. J Gynecol Oncol, 2017, 28(3): e33. DOI:10.3802/jgo.2017.28.e33 |
| [23] | LEE Y J, LEE G J, YI S S, et al. Cisplatin and resveratrol induce apoptosis and autophagy following oxidative stress in malignant mesothelioma cells[J]. Food Chem Toxicol, 2016, 97: 96–107. DOI:10.1016/j.fct.2016.08.033 |
| [24] | NIU Y, SUN W, LU J J, et al. PTEN Activation by DNA damage induces protective autophagy in response to cucurbitacin B in hepatocellular carcinoma cells[J]. Oxid Med Cell Longev, 2016, 2016: 4313204. DOI:10.1155/2016/4313204 |
| [25] | POLAGER S, OFIR M, GINSBERG D. E2F1 regulates autophagy and the transcription of autophagy genes[J]. Oncogene, 2008, 27(35): 4860–4864. DOI:10.1038/onc.2008.117 |



