在临床中由创伤或骨病所致关节骨软骨损伤十分常见,其中软骨缺损者可达50%[1],进而发展成为骨性关节炎等各类退行性关节疾病[2],严重影响患肢功能和患者生活质量。关节软骨自身缺乏血供,修复能力低下,现有医学临床治疗措施包括保守治疗和关节清理术、微骨折术(microfracture)、自体或异体骨软骨移植、自体同源基质诱导软骨再生技术(autologous matrix-induced chondrogenesis, AMIC)等[3]。但这些治疗手段都有不同程度的缺陷。比如微骨折术,通过动员骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)来修补缺失的软骨,最后往往在空缺部位形成纤维软骨,其生物学以及力学性质都与透明软骨相去甚远[4]。组织工程技术被认为是最具治疗潜力的方案,但仍然存在组织过度纤维化、移植物下沉、软骨细胞死亡、深静脉血栓形成、关节内出血、感染等缺点[5]。工程化骨软骨研究之所以存在诸多问题,重要原因之一是缺少软骨与骨之间的“界层结构”——钙化层。本课题组前期通过人关节骨软骨形态结构分析,初步阐明钙化层结构特点为致密,呈“齿梳”状,平均厚度为(104.16±20.87)μm[6]。钙化层的隔离造成了透明软骨的“乏氧”和软骨下骨的“有氧”。同时,钙化层和软骨下骨弹性模量的差异[7]也提示钙化层在透明软骨和软骨下骨之间的应力传导中起着重要作用。这一界层结构的特点一定程度上解释了现在组织工程软骨难以形成透明软骨、移植区域塌陷、移植物与宿主整合欠佳等的原因。基于对钙化层的认识,本研究构建了含有透明软骨层、天然钙化软骨层、软骨下骨层三层结构的骨软骨支架,在骨软骨全层缺损的贵州小香猪模型中,于透明软骨层种植自体BMSCs后,移植入膝关节缺损处,分析含有“界层结构”的骨软骨支架是否比无“界层结构”的支架有更良好的修复效果。
1 材料与方法 1.1 实验动物及分组14月龄贵州小香猪30只,60膝,雌雄不限,普通实验猪膝关节8个,由第三军医大学动物实验中心提供。按随机数字表法分为3组:空白对照组、无钙化层组(阴性对照组,不含钙化层支架修复)、含钙化层组(含有钙化层支架修复),每组10只(20膝)。各组于植入后12、24周取材观察,每个时间点10膝。
1.2 主要试剂与仪器胎牛血清(Gibco,美国),PBS液(北京中杉公司),Percoll分离液(Pharmacia,美国),DMEM-F12培养基(HyClone,美国),成骨诱导分化培养基、成软骨诱导分化培养基、成脂诱导分化培养基(Cyagen,美国),胰蛋白酶、胃蛋白酶、番红O-固绿染色液(Sigma,美国)。显微镜(ZEISS,德国),高速离心机(Thermo,美国),SMZ-T6连续变倍体式显微镜(重庆奥特),3.0T磁共振仪(Siemens,德国)。
1.3 种子细胞:贵州小香猪BMSCs的获取与鉴定小香猪无菌条件下抽取髂骨骨髓液20 mL,离心管分装。用Percoll分离液获取BMSCs,含10%胎牛血清的DMEM/F-12培养基常规培养,待细胞生长至80%~90%汇合,传代培养。取第3代细胞用于成软骨、成骨、成脂多向分化鉴定,三系分化鉴定成功后,保留备用。
1.4 具有“界层结构”骨软骨仿生支架的制备从普通实验猪膝关节面钻取直径8 mm骨软骨柱,去除透明软骨,然后按照文献[8]进行脱细胞处理。经切片证实骨柱完全脱细胞后,将课题组前期提取的Ⅱ型胶原蛋白水凝胶[9]嫁接在界面表面,经过低温冻干和京尼平化学交联即可制备出含天然“界层结构”的骨软骨仿生支架。采用同样的方法,Ⅱ型胶原蛋白水凝胶直接嫁接到去除透明软骨和钙化层的脱细胞骨柱上,制备出无“界层结构”的骨软骨支架,行组织学观察。所有制备的支架使用Co60辐照(20 kGy)灭菌备用。
1.5 移植修复材料构建无菌条件下,将收集扩增的BMSCs,与适宜浓度的Ⅱ型胶原蛋白水凝胶复合后接种于支架的软骨层,软骨下骨层不接种细胞,构建移植修复材料。分别构建无钙化层移植修复材料20个,有钙化层移植修复材料20个,随即按分组要求进行缺损造模和移植。
1.6 手术方法麻醉动物,消毒铺单,猪膝关节内侧纵向切口,切开关节囊,于关节滑车面孔钻钻取直径8 mm、深1 cm骨软骨缺损。空白对照组:造模后不做处理,关闭切口;无钙化层组在缺损处植入含有自体BMSCs的无钙化层骨软骨修复材料;含钙化层组则植入有“界层结构”的骨软骨修复材料,调整软骨面与关节面平齐,无血液渗出即可关闭关节腔,缝合切口。见图 1。
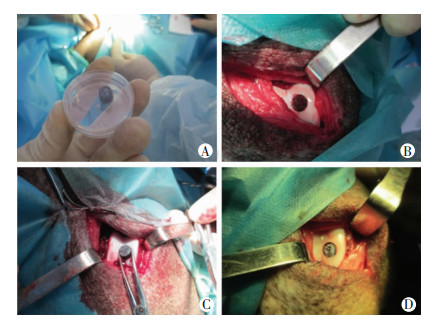
|
| A:复合细胞的移植修复材料;B:猪膝关节滑车软骨缺损(直径8 mm);C:植入修复材料;D:调整修复材料与关节面平齐 图 1 软骨缺损造模及修复手术 |
1.7 观察指标 1.7.1 术后一般情况
观察动物饮食精神状态、肢体活动、伤口感染以及愈合情况。
1.7.2 大体观察切开关节,分离股骨胫骨,暴露关节面,肉眼观察术后12、24周各组关节面是否光滑,关节腔内是否有感染,滑膜是否增生,缺损修复情况;沿缺损部位纵向切开标本,体视显微镜细致观察缺损部位情况。
1.7.3 MRI检测术后不同时间点(12、24周)处死实验猪,取下后腿,捆绑固定后进行MRI检测。
1.7.4 组织学观察取下缺损区及周围组织,4%多聚甲醛固定24 h,PBS漂洗数次,EDTA脱钙、脱水,石蜡包埋切片,行HE、番红O-固绿,以及Ⅰ、Ⅱ型胶原蛋白免疫组化染色观察。
1.8 统计学处理采用O’Driscoll组织学评分方法对3组骨软骨修复结果进行半定量分析。符合正态分布的计量资料数据以x±s表示,采用SPSS 17.0统计软件,进行双因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 骨软骨仿生支架含天然钙化层结构的骨软骨支架冻干后成乳白色,京尼平交联后冻干的Ⅱ型胶原蛋白附着在钙化层上,连接紧密,支架呈黑色(图 2)。两种骨软骨支架组织学观察比较,可见有钙化层支架“界层结构”明显, 软骨层、钙化层、软骨下骨层三层结构清晰;而无钙化层支架冻干Ⅱ型胶原蛋白直接与软骨下骨交联,只有两层结构(图 3)。
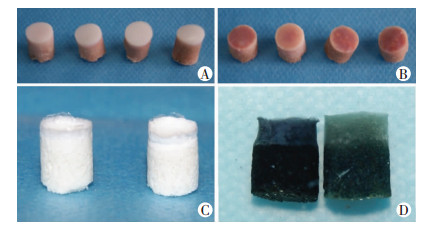
|
| A:直径8 mm骨软骨柱;B:去除透明软骨层后进行脱细胞处理;C:软骨层嫁接Ⅱ型胶原低温冻干;D:化学交联后的骨软骨支架 图 2 含有天然钙化层的骨软骨支架制备 |
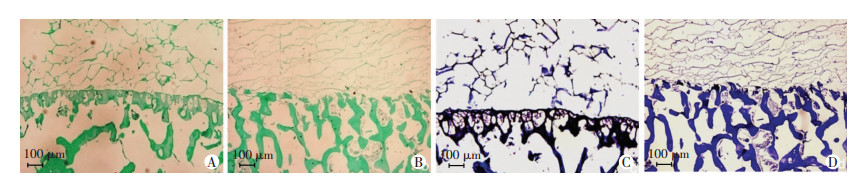
|
| A:有钙化层骨软骨支架固绿染色;B:无钙化层支架固绿染色;C:有钙化层骨软骨支架阿尔新蓝染色;D:无钙化层支架阿尔新蓝染色 图 3 有天然钙化层和无钙化层支架组织学观察 |
2.2 术后一般情况
术后动物生命体征平稳,手术切口无感染,10 d左右切口1期愈合。初期表现患肢功能不全,数周后功能大部分恢复,活动稍受限,有钙化层组恢复更快。24周内没有动物死亡。
2.3 大体观察肉眼观察术后12、24周各组膝关节均无感染,关节液清亮,滑膜无增生。术后12周:空白对照组软骨表面可见缺损未修复,深及软骨下骨;无钙化层组及含钙化层组缺损较浅,含钙化层组表面有透明组织覆盖。术后24周,各组软骨表面的缺损均有不同程度的修复,空白对照组缺损依然较深,无钙化层组次之,含钙化层组缺损基本被填充,与关节面平齐(图 4)。
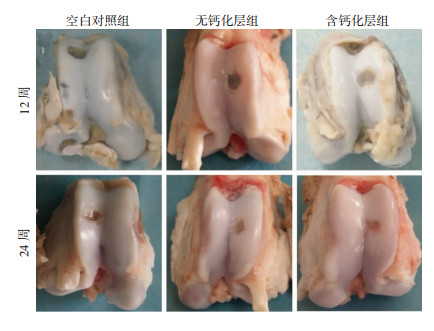
|
| 图 4 术后12、24周3组猪膝关节骨软骨缺损修复情况大体观察 |
体视显微镜观察修复组织纵切面。术后12周:空白对照组缺损依然较深大,深及软骨下骨,缺损以纤维组织填充;无钙化层组缺损较浅,可见植入材料,边缘有少量的修复组织;含钙化层组可见缺损被填充,表面与关节面平齐,软骨层和软骨下骨分界明显,植入物和宿主间连接处有透明组织填充。术后24周,各组软骨表面的缺损均明显变小,空白对照组缺损较12周稍改善,边缘和底部有纤维组织填充;无钙化层组缺损底部有骨组织形成,但表面修复效果欠佳;含钙化层组可见缺损修复较完整,三层结构清晰,软骨下骨与宿主融合,软骨表面与关节面平齐,但表面微凹陷(图 5)。

|
| 图 5 体视显微镜观察术后12、24周3组猪膝关节骨软骨缺损修复情况 |
2.4 MRI检测
术后12、24周各组关节腔均无积液,滑膜无增生。术后12周:空白对照组骨软骨缺损区域可见高信号,提示缺损未完整修复;无钙化层组软骨下骨可见部分低信号,但软骨区可见明显的低信号,提示软骨下骨部分修复,而软骨未被修复;含钙化层组软骨下骨可见部分低信号,软骨区可见正常骨软骨组织信号,边界低信号,提示软骨下骨和软骨均有不同程度修复。术后24周:空白对照组骨软骨缺损信号依然可见,但较12周明显变小;无钙化层组软骨下骨信号与正常组织相似,但软骨区仍然可见明显的低信号,提示软骨下骨修复完整,而软骨未修复;含钙化层组缺损区软骨以及软骨下骨MRI信号与正常骨软骨组织相似,提示缺损修复较好(图 6)。
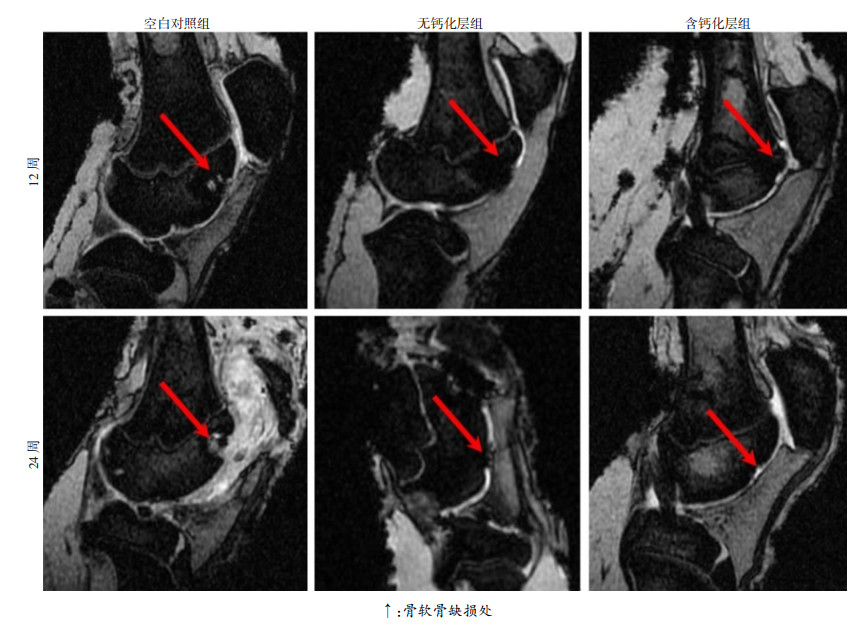
|
| ↑:骨软骨缺损处 图 6 MRI检测术后12、24周3组猪膝关节骨软骨缺损修复情况 |
2.5 组织学观察 2.5.1 HE染色观察
术后12周:空白对照组缺损深大,几乎全是纤维组织填充;无钙化层组缺损较浅,可见植入材料,边缘有少量的修复组织;含钙化层组可见缺损表面与关节面平齐,软骨层和软骨下骨分界明显,植入物和宿主间连接处透明组织填充。术后24周,各组软骨表面的缺损均明显变小,空白对照组缺损较12周变浅,依然是纤维组织填充,修复区与宿主界限明显;无钙化层组缺损底部有骨组织形成,但表面为纤维组织填充;含钙化层组可见缺损修复较完整,表面与关节面平齐,软骨下骨骨小梁清晰,与宿主间无差异,但软骨微凹陷(图 7)。
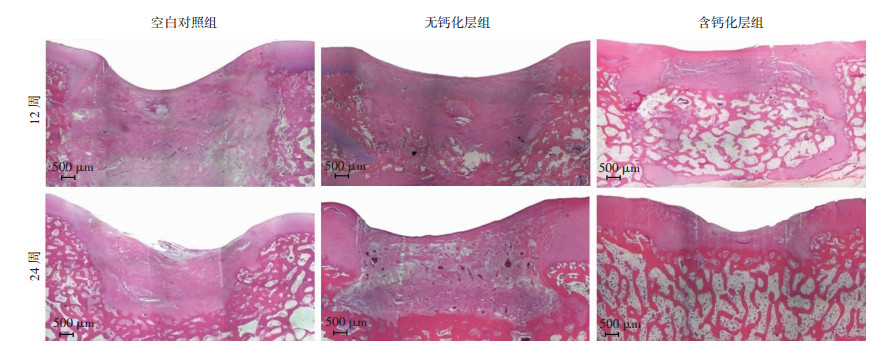
|
| 图 7 HE染色观察术后12、24周3组猪膝关节骨软骨缺损修复情况 |
2.5.2 番红O-固绿染色观察
番红O可以将透明软骨染成红紫色,固绿可以将软骨下骨染成深蓝色,而番红O-固绿可以将钙化层染成深红色,因此番红O-固绿染色可以标示出骨软骨三层结构。空白对照组缺损表面修复组织以纤维组织为主,内可见血管,无界层结构;无钙化层组虽然在术后24周可以看到界层结构,但软骨区修复组织为纤维软骨。含钙化层组修复组织三层结构分界清楚,染色与正常骨软骨一致,钙化层结构清楚(图 8)。
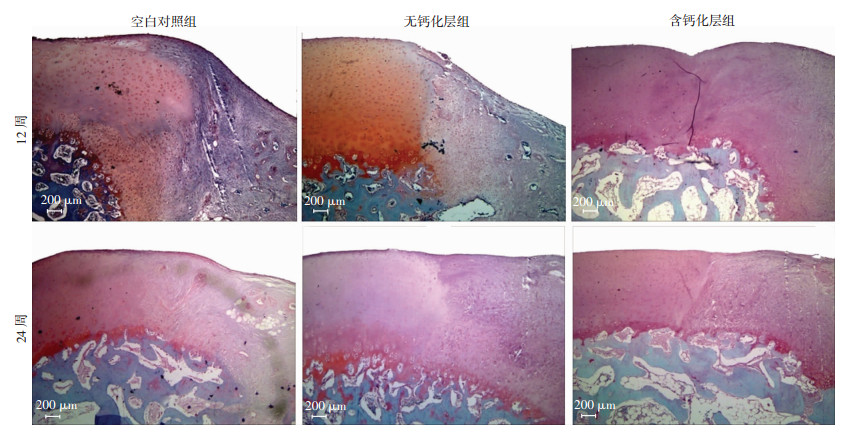
|
| 图 8 番红O-固绿染色观察术后12、24周3组猪膝关节骨软骨缺损修复情况 |
2.5.3 Ⅰ、Ⅱ型胶原蛋白免疫组化
空白对照组缺损表面修复组织Ⅰ型胶原蛋白免疫组化染色呈强阳性,Ⅱ型胶原蛋白免疫组化染色呈阴性,表明修复主要为纤维组织;无钙化层组修复组织Ⅰ型胶原蛋白免疫组化染色呈强阳性,Ⅱ型胶原蛋白免疫组化染色呈弱阳性,提示修复主要为纤维软骨;含钙化层组修复组织Ⅰ型胶原蛋白免疫组化染色呈阴性,Ⅱ型胶原蛋白免疫组化染色呈强阳性,提示修复主要为透明软骨(图 9)。

|
| 图 9 Ⅰ、Ⅱ型胶原蛋白免疫组化观察术后12、24周3组猪膝关节骨软骨缺损修复情况 |
2.5.4 O’Driscoll组织学评分
采用O’Driscoll组织学评分方法对3组骨软骨修复结果进行半定量分析。主要观察4部分:修复组织性状、修复组织结构特征、修复组织有无细胞退变和周围正常软骨有无退变。术后12周, 空白对照组得分最低,含钙化层组最高,各组间差异有统计学意义(P < 0.01,图 10);术后24周,3组评分结果均有不同程度增高,但各组间差异仍有统计学意义(P < 0.01,图 10),含钙化层组得分最高,说明含钙化层组修复效果最好。
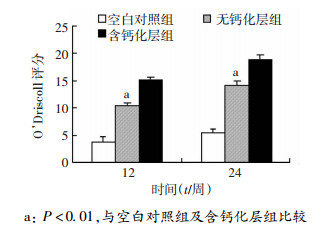
|
| a: P < 0.01,与空白对照组及含钙化层组比较 图 10 各组每个时间点O’Driscoll评分比较 |
3 讨论
直径超过6 mm的骨软骨缺损无法完全自行修复[10],目前最有可能解决骨软骨缺损的治疗手段为组织工程技术,但现有的支架往往没有考虑到软骨和软骨下骨迥然不同的生理环境[11],以及维持这不同生理环境的钙化层结构。本实验以自体BMSCs为种子细胞,以含有钙化层的脱细胞猪骨交联Ⅱ型胶原蛋白为支架,构建移植修复材料,修复贵州小香猪膝关节。经过24周,含有钙化层组修复效果明显优于无钙化层组和空白对照组,O’Driscoll评分具有统计学意义。
本实验成功建立了小香猪骨软骨缺损的动物模型。相较于其他动物骨软骨缺损模型,如鼠[12]、兔[13]等,小香猪具有体型适中,和人类膝关节结构类似,生命力强等优点,为以后的骨软骨缺损研究提供了很好的模型基础。实验组中所使用新型支架分为三层,其中钙化层和软骨下骨层来自猪骨,进行了脱细胞处理,消除其免疫原性;软骨层采用Ⅱ型胶原冻干,形成具有一定孔隙结构的Ⅱ型胶原软骨支架,此支架包含了软骨细胞最重要的外基质成分——Ⅱ型胶原,从而更好地促进BMSCs朝软骨分化,并维持软骨细胞表型[14]。钙化层这一界面层结构的存在,一方面在修复过程中发挥一定的物质阻隔作用,让软骨层和软骨下骨层处在相对独立的生理环境中,组织学观察也证实相较于无钙化层组和空白对照组,含钙化层组的BMSCs合成更多的Ⅱ型胶原,更少的Ⅰ型胶原。在恢复过程中,实验动物日常活动对膝关节有反复的力学加压。在修复早期(12周),有支架组(无钙化层组和含钙化层组)对缺损的填充效果要优于空白对照组,而无钙化层组与含钙化层组新生组织填充效果差别不大。但是到了24周,含钙化层组几乎恢复了正常骨软骨组织的结构,拥有完整的三层结构,和毗邻组织无差别连接,软骨下骨被骨组织填充,软骨组织也与正常软骨组织平齐,残留微小缺损;无钙化层组三层组织结构区分不明显,软骨下骨也没能很好地生成骨组织,软骨表面有塌陷,这些缺陷都是造成骨性关节炎的重要因素。有界层结构的支架能够很好地修复缺损,很可能是因为钙化层在生理力学传导过程中发挥了缓冲和支撑作用。
本研究验证了在骨软骨缺损修复过程中,模拟其自然生理环境和力学环境的重要性和必要性,同时也验证了钙化层在其中发挥着不可替代的作用。因此,在未来组织工程支架设计中,钙化层这一界层组织是不得不考虑的因素。然而目前专注于钙化层的研究比较少。ZHANG等[15]分析了其化学成分;ARKILL等[16]研究其通透性,表明钙化层可以透过小分子物质;PAN等[17]阐明其扩散系数比软骨和软骨下骨小很多;同时很多学者也报道在骨性关节炎(osteoarthritis,OA)的发生发展过程中,出现钙化层加厚、微裂隙、血管神经长入等现象[18-19]。这些都提示钙化层作为软骨和骨的交界结构,在生理和病理状态下都发挥着不可或缺的功能,但是具体形成的机制,对物质隔绝作用的机制,以及在OA形成的过程其重塑的机制与作用都不得而知,尚需要更多的研究证实,以便更好地采用非天然的材料来模拟钙化层结构。天然骨柱脱细胞,交联冻干Ⅱ型胶原,在实验动物身上没有出现排异反应,这为未来仿生支架材料的设计提供新的参考,但是Ⅱ型胶原支架和软骨下骨支架怎样结合一体成型,还需要进一步探讨。相较于其他材料的支架[20],天然生物材料比较难以获得,脱细胞、脱免疫原步骤繁琐,在体外用生物替代材料构建含有三层结构的仿生支架是需要改进的问题。此外,自体BMSCs种植之前经过了提取和体外扩增,实验动物经历了两次手术,如果应用于临床,则需改良方案,争取让所有操作一次手术完成。
| [1] | SAVAGE-ELLIOTT I, ROSS K A, SMYTH N A, et al. Osteochondral lesions of the talus: a current concepts review and evidence-based treatment paradigm[J]. Foot Ankle Spec, 2014, 7(5): 414–422. DOI:10.1177/1938640014543362 |
| [2] | CHARALAMBOUS C P. Articular Cartilage. Part Ⅱ: degeneration and osteoarthrosis, repair, regeneration, and transplantation[J]. Instr Course Lect, 2014, 47: 487–504. |
| [3] | YASUI Y, WOLLSTEIN A, MURAWSKI C D, et al. Operative treatment for osteochondral lesions of the talus: biologics and Scaffold-Based Therapy[J]. Cartilage, 2017, 8(1): 42–49. DOI:10.1177/1947603516644298 |
| [4] | KRYCH A J, HARNLY H W, RODEO S A, et al. Activity levels are higher after osteochondral autograft transfer mosaicplasty than after microfracture for articular cartilage defects of the knee: a retr ospective comparative study[J]. J Bone Joint Surg Am Volume, 2012, 94(11): 971–978. DOI:10.2106/JBJS.K.00815 |
| [5] | ATHIVIRAHAM A, KODALI P, MINIACI A. Surgical treatment of osteochondral defects of the knee, knee surgery, with mosaicplasty technique[M]//Sports Injuries. Springer Berlin Heidelberg, 2013, 1-10. |
| [6] | WANG F, YING Z, DUAN X, et al. Histomorphometric analysis of adult articular calcified cartilage zone[J]. J StructBiol, 2009, 168(3): 359–365. DOI:10.1016/j.jsb.2009.08.010 |
| [7] | SUN L, CHEN C, YIN L, et al. Probing the elasticity of calcified cartilage zone using nano-indentation[J]. J Biomater Tiss Eng, 2017, 7(7): 556–560. DOI:10.1166/jbt.2017.1599 |
| [8] |
谭洪波, 崔运利, 王富友, 等. 脱细胞骨软骨支架复合自体骨髓间充质干细胞修复羊骨软骨缺损的研究[J].
中华关节外科杂志:电子版, 2010, 4(6): 37–40.
TAN H B, CUI Y L, WANG F Y, et al. Acellular osteochondral scaffold combined with autologous mscs repair goat osteochondral defects[J]. Chin J Joint Surg(Electr Vers), 2010, 4(6): 37–40. |
| [9] |
宁志刚, 王富友, 崔运利, 等. 可溶性猪软骨Ⅱ型胶原蛋白的提取与鉴定[J].
重庆医学, 2011, 40(10): 954–955, 958.
NING Z G, WANG F Y, CUI Y L, et al. Isolation and identification of soluable collagen type Ⅱ from porcine articular cartilage[J]. Chongqing Med, 2011, 40(10): 954–955, 958. DOI:10.3969/j.issn.1671-8348.2011.10.008 |
| [10] | JACKSON D W, LALOR P A, ABERMAN H M, et al. Spontaneous repair of full-thickness defects of articular cartilage in a goat model. A preliminary study[J]. J Bone Joint Surg Am, 2001, 83-A(1): 53–64. DOI:10.2106/00004623-200101000-00008 |
| [11] | NGUYEN L T, MIN Y K, LEE B T. Nanoparticle biphasic calcium phosphate loading on gelatin-pectin scaffold for improved bone regeneration[J]. Tissue Eng Part A, 2015, 21(7-8): 1376–1387. DOI:10.1089/ten.TEA.2014.0313 |
| [12] | MARTINEZ R, FIGUEROA D, CALVO R, et al. Osteochodral lesion mouse model:an alternative for experimental work[J]. Rev Esp Cir Ortop Traumatol, 2015, 59(1): 9–13. DOI:10.1016/j.recot.2014.06.006 |
| [13] | GUZZARDELLA G A, MORRONE G, FINI M, et al. Histologic evaluation of the repair process of chondral and osteochondral lesions in a rabbit model[J]. J Appl Anim Res, 2000, 17(2): 217–224. DOI:10.1080/09712119.2000.9706305 |
| [14] |
王冠, 陈星星, 薛鑫, 等. Ⅱ型胶原体外促进大鼠骨髓间充质干细胞向软骨细胞分化[J].
第三军医大学学报, 2015, 37(9): 886–890.
WANG G, CHEN X X, XUE X, et al. Collagen Ⅱ promotes differentiation of rat bone marrow mesenchymal stem cells into chondrocytes in vitro[J]. J Third Mil Med Univ, 2015, 37(9): 886–890. DOI:10.16016/j.1000-5404.201412113 |
| [15] | ZHANG Y, WANG F, TAN H, et al. Analysis of the mineral composition of the human calcified cartilage zone[J]. Int J Med Sci, 2012, 9(5): 353–360. DOI:10.7150/ijms.4276 |
| [16] | ARKILL K P, WINLOVE C P. Solute transport in the deep and calcified zones of articular cartilage[J]. Osteoarthr Cartilage, 2008, 16(6): 708–714. DOI:10.1016/j.joca.2007.10.001 |
| [17] | PAN J, ZHOU X, LI W, et al. In situ measurement of transport between subchondral bone and articular cartilage[J]. J Orthop Res, 2009, 27(10): 1347–1352. DOI:10.1002/jor.20883 |
| [18] | IMHOF H, SULZBACHER I, GRAMMP S, et al. Subchondral bone and cartilage disease: a rediscovered functional unit[J]. Invest Radiol, 2000, 35(10): 581–588. DOI:10.1097/00004424-200010000-00004 |
| [19] | LANE L B, VILLACIN A, BULLOUGH P G. The vascularity and remodelling of subchondrial bone and calcified cartilage in adult human femoral and humeral heads. An age-and stress-related phenomenon[J]. J Bone Joint Surg Br, 1977, 59(3): 272–278. |
| [20] |
樊东力, 张一鸣. 生物医用材料和组织工程技术在组织修复中的应用及进展[J].
第三军医大学学报, 2015, 37(19): 1909–1913.
FAN D L, ZHANG Y M. Application and progress of biomaterial and tissue engineering in tissue repair[J]. J Third Mil Med Univ, 2015, 37(19): 1909–1913. DOI:10.16016/j.1000-5404.201507041 |



