2. 100039 北京,武警总医院消化内科
2. Department of Gastroenterology, General Hospital of Chinese People's Armed Police Forces, Beijing, 100039, China
胃黏膜肠上皮化生(gastric intestinal metaplasia,GIM)是指胃黏膜上皮细胞被肠型上皮细胞所代替,即胃黏膜中出现类似肠黏膜的上皮细胞,是胃黏膜常见病变[1-3]。目前普遍认为胃癌的发展模式为慢性非萎缩性胃炎—慢性萎缩性胃炎—胃黏膜肠上皮化生—异型增生—胃癌,因此GIM被认为是一种癌前病变[4]。重点随访监测具有GIM的患者,及早发现早期胃癌,进行内镜下切除或者外科手术治疗,从而提高胃癌患者的生存率,具有十分重要的临床价值[5-6]。GIM的诊断有赖于组织活检,但是GIM呈多灶分布,白光内镜下形态缺乏特异性,胃镜下诊断与病理学诊断一致性较差[7-9],因此需要一种新的内镜成像技术,在进行白光内镜检查的同时实现对胃黏膜病变的实时成像来帮助医师进行即时诊断和早期治疗。我们自主研发的高分辨率显微内镜(high resolution microendoscopy,HRME)是基于光纤导光和传像原理而设计的一种能够实现组织虚拟病理学成像的新型成像方式。前期研究表明HRME能够对胃癌发生、发展过程中的初始阶段和最终阶段进行成像,具有良好的诊断价值[10-13]。故本研究拟使用HRME对胃癌发生、发展的中间过程GIM进行成像分析。使用HRME对病理确诊为GIM的活检标本进行成像,提出GIM的HRME诊断标准。在此基础上,利用HRME对内镜下疑诊为GIM的活检标本进行前瞻性研究,进一步评估HRME对GIM的诊断价值。
1 资料与方法 1.1 一般资料 1.1.1 研究对象收集2016年10月至2017年1月就诊于武警总医院消化内窥镜中心行内镜检查时病理确诊为GIM的活检标本20例及正常十二指肠黏膜活检标本10例用于GIM诊断标准的制定。2017年2-7月,选择具有10年以上反复上消化道症状(上腹不适、腹胀、腹痛、反酸等)的患者及既往内镜检查确诊为慢性萎缩性胃炎或GIM的患者共49例,用于HRME对GIM诊断的前瞻性研究,其中男性28例,女性21例,年龄32~76岁,平均51岁。本研究于2015年经过医院伦理委员会批准,患者均签署知情同意书。
1.1.2 试剂和药品0.05%吖啶黄盐酸盐(美国Sigma公司)、生理盐水(辰欣药业股份有限公司)、链霉蛋白酶颗粒(北京泰德制药股份有限公司)、碳酸氢钠(北京泰德制药股份有限公司)等。
1.1.3 成像设备自主研发的HRME成像设备包括1根1.8 m长的含30 000单丝的光纤、×10物镜、500 nm二向色镜、激发光及发射光滤光片、科学级低温制冷CCD相机、440~480 nm波段的LED光源。设备成像过程中空间分辨率为4.4 μm,能以17帧/s的速度进行图像采集并传输至电脑进行图像处理。见图 1。
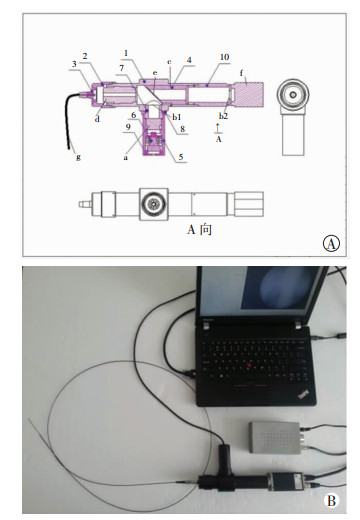
|
| A:HRME原理图 1:主体套筒, 2:前端套, 3:SWA905连接器, 4:内套筒, 5:LED套筒, 6:LED散热片, 7:LED连接座, 8:LED转接环, 9:LED散热底盖, 10:CCD相机连接件, a:准直装置, b1:避光装置, b2:滤光片, c:二向色镜, d:物镜, e:管状镜, f:CCD相机, g:光纤束;B:HRME设备组件 图 1 高分辨率显微内镜设备结构 |
1.2 研究方法 1.2.1 检查过程
患者均行常规内镜检查,白光内镜下GIM主要表现为灰白色或淡黄色结节、瓷白色小结节及弥漫颗粒状改变。根据病变形态在白光内镜下对观察到的胃黏膜病变进行GIM(+)和GIM(-)的判断,并对该病变进行靶向活检。
1.2.2 标本的处理获得标本后立即对标本进行处理,保持标本新鲜度。首先用生理盐水去除表面残留物,再用链蛋白酶和碳酸氢钠混合制成的去黏液剂洗去表面残留黏液,最后使用生理盐水将标本表面残留的去黏液剂洗去,纱布擦干备用。
1.2.3 HRME成像过程将处理好的标本黏膜面朝上展平置于黑色卡纸上,局部喷洒0.05%吖啶黄素盐酸盐2~3 mL,30 s后用生理盐水冲洗表面残留染料。干纱布轻轻擦干标本表面液体。将光纤头端以不同角度对标本进行HRME成像,将每个标本获得的图像保存在1个文件夹中并进行编号。
1.2.4 病理检查标本在HRME成像结束后均立即用福尔马林液固定,常规HE染色后行病理学诊断。
1.2.5 HRME图片质量控制对得到的HRME图片进行质量筛选,选取运动伪影及组织碎片不影响观察、清晰且可视面积大于80%的图片用于本研究。将每个标本质量最好的8张图片用于后续分析。
1.2.6 HRME诊断标准的制定选取2名高年资内镜主治医师对20例GIM及10例正常十二指肠黏膜标本的HRME图像特征进行回顾性分析,依据腺管开口、腺体形态、细胞核数量与形态等,同时参照组织病理学结果,制定出GIM的HRME诊断标准。
1.2.7 HRME对GIM诊断的前瞻性研究根据制定的GIM诊断标准,由2名不知内镜及病理诊断结果的内镜主治医师对用于前瞻性研究的49例患者的胃黏膜活检标本的HRME图片进行预诊断,诊断结果包括GIM(+)和GIM(-)2个部分。将预诊断结果与病理结果相比较,评估HRME对GIM的诊断价值。
1.3 统计学分析使用SPSS 17.0统计软件进行数据处理。计量资料按照四格表法进行统计,分析比较白光内镜与HRME对GIM诊断的敏感度、特异度、准确性、阳性预测值(PPV)和阴性预测值(NPV)。采用Kappa值分析HRME与病理诊断的一致性。
2 结果 2.1 一般情况用于回顾性研究的20例GIM标本(包括胃底3例、胃体4例、胃窦13例)与10例正常十二指肠球部黏膜标本共30个成像位点240张图片纳入HRME图像解读和GIM诊断标准的制定研究。纳入前瞻性研究的49例患者共计91处胃黏膜病变进行白光内镜观察和靶向活检,其中胃窦69处、胃角9处、胃体13处。对91处胃黏膜病变的活检标本进行HRME成像,经筛选后共获得728张HRME图片。
2.2 HRME诊断标准的制定根据本团队前期研究结果,在HRME设备性能及成像特点的基础上,依据腺体形态、腺管开口、细胞核数量与形态,结合病理诊断结果和正常十二指肠黏膜的HRME图像特征,制定出GIM的HRME诊断标准。正常十二指肠球部黏膜HRME图像特征:可见绒毛呈宽大的指状,周围可见发亮的绒毛结构,绒毛两侧有锯齿状凹陷,立体感明显,间隙呈裂隙状。GIM的HRME诊断标准:小凹周围细胞排列规则,腺体呈绒毛状或宽大杵指状基础上可见发亮的腺体边缘。绒毛结构呈明暗交界的特征:周围一圈高亮,中间区域稍暗。见图 2。
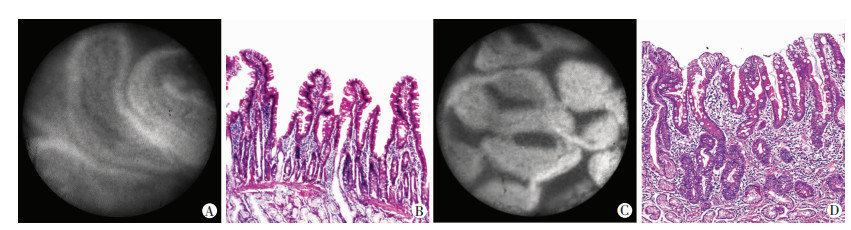
|
| A:正常十二指肠黏膜组织的高分辨率显微内镜观;B:正常十二指肠黏膜组织的病理变化(HE×200);C:胃黏膜肠上皮化生组织的高分辨率显微内镜观;D:胃黏膜肠上皮化生组织的病理变化(HE×200) 图 2 正常十二指肠黏膜和胃黏膜肠上皮化生组织的高分辨率显微内镜观及相应的病理变化 |
2.3 白光内镜对GIM的诊断结果
在观察并活检的91处胃黏膜病变部位中,白光内镜共诊断GIM(+)30个部位,经病理证实为25例。白光内镜诊断GIM(-)61个部位,经病理证实29例。经统计学分析白光内镜诊断GIM的敏感性、特异性、阳性预测值、阴性预测值分别为43.86%、85.29%、83.33%、47.54%,与病理诊断的一致性Kappa值为0.25(表 1)。
| 诊断方法 | 病理诊断 | 合计 | ||
| GIM(+) | GIM(-) | |||
| 白光内镜 | GIM(+) | 25 | 5 | 30 |
| GIM(-) | 32 | 29 | 61 | |
| 高分辨率显微内镜 | GIM(+) | 52 | 4 | 56 |
| GIM(-) | 5 | 30 | 35 | |
2.4 HRME对GIM的诊断结果
利用HRME对白光内镜观察并活检的91处胃黏膜病变标本进行成像后,根据前期制定的GIM诊断标准,做出预诊断。HRME共诊断为GIM(+)56个部位,经病理证实52个。HRME诊断GIM(-)35个部位,经病理证实30个。经统计学分析,HRME诊断GIM的敏感性、特异性、阳性预测值和阴性预测值分别为91.23%、88.24%、92.86%、85.71%,与病理诊断的一致性Kappa值为0.79(表 1)。
3 讨论HRME是基于高分辨率光纤和分子成像开发出的一种显微成像技术,能够在细胞水平实现对组织结构的实时成像[11]。HRME通过高分辨光纤将455 nm激发光和生物组织表面产生的515 nm荧光进行共通道的传输,由二向色镜将激发光及荧光信号分开, 能只将荧光信号传导至CCD芯片上进行成像,从而得到被检测组织的细胞学成像[11, 14]。近年国外学者使用HRME对口腔黏膜、食管癌变等进行了成像研究,结果表明HRME具有良好的诊断效果和应用前景[15-16]。在国外学者的研究基础上,我们课题组自主搭建了一套HRME成像系统,并完成了对正常胃黏膜及胃癌组织的成像研究,取得了很好的成像效果[12-13, 17]。
GIM是胃癌发生、发展过程中的重要一环,是一种较难逆转的癌前病变[18]。有内镜随访研究表明,GIM患者中12.8%~56.0%患者可进展为异型增生[19],0.18%可进展为胃癌[20]。对GIM病变进行干预,阻止其发生癌变或使其逆转为正常胃黏膜对降低胃癌发生率有重要意义。目前常用的药物干预其有效性仍有待研究,故防止GIM恶变的关键仍在于加强胃镜和胃黏膜组织活检监测。由于白光内镜诊断GIM主要依靠胃黏膜病变的形态特征和操作者的经验及主观判断,且目前尚无明确定义的GIM的内镜下诊断标准,导致内镜下诊断与病理一致性很低。本研究表明,白光内镜诊断GIM的特异性及敏感性分别为43.86%及85.29%,与病理诊断的一致性Kappa值仅为0.25。
GIM最主要的组织学特征就是胃黏膜中出现杯状细胞和有刷状缘的柱状吸收上皮细胞[21-22]。我们在对正常十二指肠黏膜及GIM标本的HREM图像进行回顾性分析时发现,GIM图像中存在与正常十二指肠黏膜图像相似的绒毛状腺体及明亮的腺体边缘结构。所以我们考虑吖啶黄对黏膜标本进行喷洒染色时,位于外表面的柱状吸收上皮的染色效果好于固有层细胞,HRME成像时吸收上皮荧光信号强度高于固有层细胞,出现明亮的腺体边缘结构。基于此我们制定了HRME下的GIM诊断标准:小凹周围细胞排列规则,腺体呈绒毛状或宽大杵指状基础上可见发亮的腺体边缘。绒毛结构呈明暗交界的特征:周围一圈高亮,中间区域稍暗。为了进一步验证诊断标准的可行性及准确性,我们对具有长期慢性胃炎病史和既往确诊为GIM或萎缩性胃炎患者的活检标本进行前瞻性研究,根据制定的诊断标准,HRME对GIM诊断的敏感性及特异性分别为91.23%及88.24%,与病理的一致性为0.79,前瞻性研究结果也进一步证实了诊断标准的可靠性。
上述研究结果显示HMRE比白光内镜具有更好的诊断GIM的效果,展现出了对GIM诊断的良好应用前景。但本研究也有一些局限性,如:(1)本装置为小视野成像,需宽视野内镜的辅助来对可疑病变进行定位;(2)本研究中HRME仅对活检标本进行成像,还未对组织进行在体成像,同时由于设备分辨率限制无法实现对杯状细胞的成像,下一步准备改进成像设备实现更高分辨率下的在体组织成像。
综述所述,HRME作为一种新兴的能够对组织进行实时病理学成像的工具,可以很好地对胃黏膜是否有肠上皮化生进行区分,提高胃镜下判断GIM的准确性,具有很好的应用前景。
| [1] | GIROUX V, RUSTGI A K. Metaplasia: tissue injury adaptation and a precursor to the dysplasia-cancer sequence[J]. Nat Rev Cancer, 2017, 17(10): 594–604. DOI:10.1038/nrc.2017.68 |
| [2] | JEONG S, CHOI E, PETERSEN C P, et al. Distinct metaplastic and inflammatory phenotypes in autoimmune and adenocarcinoma-associated chronic atrophic gastritis[J]. United European Gastroenterol J, 2017, 5(1): 37–44. DOI:10.1177/2050640616644142 |
| [3] | CORREA P, PIAZUELO M B, WILSON K T. Pathology of gastric intestinal metaplasia: clinical implications[J]. Am J Gastroenterol, 2010, 105(3): 493–498. DOI:10.1038/ajg.2009.728 |
| [4] | CORREA P. A human model of gastric carcinogenesis[J]. Cancer Res, 1988, 48(13): 3554–3560. |
| [5] | PASECHNIKOV V, CHUKOV S, FEDOROV E, et al. Gastric cancer: prevention, screening and early diagnosis[J]. World J Gastroenterol, 2014, 20(38): 13842–13862. DOI:10.3748/wjg.v20.i38.13842 |
| [6] | LORDICK F, ALLUM W, CARNEIRO F, et al. Unmet needs and challenges in gastric cancer: the way forward[J]. Cancer Treat Rev, 2014, 40(6): 692–700. DOI:10.1016/j.ctrv.2014.03.002 |
| [7] | KANEMITSU T, YAO K, NAGAHAMA T, et al. Extending magnifying NBI diagnosis of intestinal metaplasia in the stomach: the white opaque substance marker[J]. Endoscopy, 2017, 49(6): 529–535. DOI:10.1055/s-0043-103409 |
| [8] | SIMKO V, ANAND N, GINTER E. Gastric intestinal metaplasia -age, ethnicity and surveillance for gastric cancer[J]. Bratisl Lek Listy, 2015, 116(1): 3–8. DOI:10.4149/bll_2015_001 |
| [9] | ZUO X L, LI Z, LI C Q, et al. Probe-based endomicroscopy for in vivo detection of gastric intestinal metaplasia and neoplasia: a multicenter randomized controlled trial[J]. Endoscopy, 2017, 49(11): 1033–1042. DOI:10.1055/s-0043-115382 |
| [10] | LOUIE J S, RICHARDS-KORTUM R, ANANDASABAPATHY S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia[J]. Clin Gastroenterol Hepatol, 2014, 12(11): 1789–1792. DOI:10.1016/j.cgh.2014.08.004 |
| [11] | PIERCE M, YU D, RICHARDS-KORTUM R. High-resolution fiber-optic microendoscopy for in situ cellular imaging[J]. J Vis Exp, 2011(47): 2306. DOI:10.3791/2306 |
| [12] |
谈涛, 屈亚威, 舒娟, 等. 高分辨率显微内镜对消化道正常黏膜的成像研究[J].
中国内镜杂志, 2016, 22(6): 81–85.
TAN T, QU Y W, SHU J, et al. High resolution micro-endoscopy for digestive tract normal mucosa[J]. Chin J Endosc, 2016, 22(6): 81–85. DOI:10.3969/j.issn.1007-1989.2016.06.020.issn.1007-1989.2016.06.020 |
| [13] |
谈涛, 屈亚威, 刘敏黎, 等. 高分辨率显微内镜诊断胃癌的可行性研究[J].
中华消化内镜杂志, 2016, 33(9): 598–602.
TAN T, QU Y W, LIU M L, et al. Feasibility of high resolution micro-endoscopy for diagnosis of gastric cancer[J]. Chin J Digest Endosc, 2016, 33(9): 598–602. DOI:10.3760/cma.j.issn.1007-5232.2016.09.006 |
| [14] | HUR C, CHOI S E, KONG C Y, et al. High-resolution microendoscopy for esophageal cancer screening in China: a cost-effectiveness analysis[J]. World J Gastroenterol, 2015, 21(18): 5513–5523. DOI:10.3748/wjg.v21.i18.5513 |
| [15] | PATSIAS A, GIRALDEZRODRIGUEZ L, POLYDORIDES A, et al. Feasibility of transoral robotic-assisted high-resolution microendoscopic imaging of oropharyngeal squamous cell carcinoma[J]. Head Neck, 2015, 37(8): E99–102. DOI:10.1002/hed.23892 |
| [16] | SHIN D, LEE M H, POLYDORIDES A D, et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of neoplasia in patients with Barrett's esophagus[J]. Gastrointest Endosc, 2016, 83(1): 107–114. DOI:10.1016/j.gie.2015.06.045 |
| [17] |
屈亚威, 谈涛, 张宇, 等. 高分辨率显微内镜成像系统的构建与初步应用[J].
中国医疗器械杂志, 2016, 40(3): 161–163, 168.
QU Y W, TAN T, ZHANG Y, et al. Construction and preliminary application of high resolution microendoscopy imaging system[J]. Chin J Med lnst, 2016, 40(3): 161–163, 168. DOI:10.3969/j.issn.1671-7104.2016.03.002 |
| [18] | ISOBE Y, NASHIMOTO A, AKAZAWA K, et al. Gastric cancer treatment in Japan: 2008 annual report of the JGCA nationwide registry[J]. Gastric Cancer, 2013, 16(1): 1–27. DOI:10.1007/s10120-012-0163-4 |
| [19] | DINIS-RIBEIRO M, DA COSTA-PEREIRA A, LOPES C, et al. Feasibility and cost-effectiveness of using magnification chromoendoscopy and pepsinogen serum levels for the follow-up of patients with atrophic chronic gastritis and intestinal metaplasia[J]. J Gastroenterol Hepatol, 2007, 22(10): 1594–1604. DOI:10.1111/j.1440-1746.2007.04863.x |
| [20] | HASSAN C, ZULLO A, DI GIULIO E, et al. Cost-effectiveness of endoscopic surveillance for gastric intestinal metaplasia[J]. Helicobacter, 2010, 15(3): 221–226. DOI:10.1111/j.1523-5378.2010.00752.x |
| [21] | CHIU P W, NG E K, TO K F, et al. Recognition of goblet cells upon endocytoscopy indicates the presence of gastric intestinal metaplasia[J]. Dig Endosc, 2014, 26(1): 52–56. DOI:10.1111/den.12050 |
| [22] | GUO Y T, LI Y Q, YU T, et al. Diagnosis of gastric intestinal metaplasia with confocal laser endomicroscopy in vivo: a prospective study[J]. Endoscopy, 2008, 40(7): 547–553. DOI:10.1055/s-2007-995633 |



