2. 400016 重庆,重庆医科大学:附属第一医院老年病科;
3. 400016 重庆,重庆医科大学:生理学教研室
2. Department of Physiology, College of Basic Medical Sciences, Chongqing Medical University, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China;
3. Department of Geriatrics, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
抑郁症是一种常见的心境障碍,其核心症状是快感丧失和心境低落,严重者可出现自杀念头和行为。到2014年,全球已经有超过3亿5 000万的人受到抑郁症的影响[1]。然而,即使遇到同样强烈的压力,也只有20%~25%的人在面临重大压力事件的情况下发展成抑郁症[2]。这种对压力反应的个体差异性是抑郁症发病的重要机制之一。因此了解压力耐受的作用机制,对于探索潜在的抗抑郁机制至关重要。
大脑是对压力做出反应的中枢,白质作为连接大脑各脑区的重要结构,探讨其与压力耐受相关的研究却相对较少。而一些影像学研究显示抑郁症患者也普遍存在白质改变[3-4]。本团队前期的体视学精确定量研究也发现慢性不可预知性应激(chronic unpredictable stress,CUS)抑郁模型大鼠白质体积显著减少[5]。具有压力耐受能力个体是否同样存在白质体积改变呢?国内外尚少见相关研究报道。有髓神经纤维是白质结构的主要组成部分,一直是神经系统疾病的研究重点[6]。大脑白质内有髓神经纤维的破坏与抑郁症发病和疗效密切相关[5, 7]。弥散张量成像(diffusion tensor imaging, DTI)研究显示抑郁患者大脑皮质和皮质下区域各向异性分数(fractional anisotropy,FA)数值减小[4]。而对压力耐受个体的研究中,也有与FA值相关的报道[8-9]。影像学研究显示压力耐受个体FA值的增高,只能提示压力耐受个体大脑白质纤维结构的完整性和连通性更好,而无法提供白质内神经纤维改变更具体的证据和数据。对于压力耐受个体白质内有髓神经纤维是否存在改变,国内外也少见文献报道。现代体视学方法对于白质体积及白质内有髓神经纤维体积的定量研究提供了非常有用的手段[10]。因此,我们运用现代体视学方法研究具有压力耐受能力大鼠白质的改变。CUS可以导致压力易感大鼠出现蔗糖偏好降低,此现象模拟了抑郁症中的核心症状——快感缺失[11-12]。而压力耐受组没有蔗糖偏好的降低,提示其未表现出快感缺失的症状[13]。因此,根据最后1周的蔗糖偏好实验结果将给予了4周CUS的大鼠分为压力耐受组和压力易感组。再运用体视学方法,对空白对照组、压力耐受组和压力易感组大鼠白质体积及白质内有髓神经纤维的总体积进行三维定量研究,旨在为压力耐受的神经结构基础提供理论依据。
1 材料与方法 1.1 实验动物雄性Sprague-Dawley(SD)大鼠(4~5周龄,体质量120~160 g)由重庆医科大学实验动物中心提供,5只/笼,维持室温(22±1) ℃,湿度(55±10)%,自由进食进水、昼夜交替。在1周的适应性喂养之后,对大鼠进行糖水训练。待大鼠糖水基线稳定后,根据糖水偏好实验(sucrose preference test, SPT)[11]选择初始蔗糖偏好大于65%的50只大鼠。
1.2 实验动物分组及制备CUS模型采用完全随机法将雄性SD大鼠分为空白对照组(12只)和CUS模型组(38只)。空白对照组大鼠(5只/笼)不给予任何应激,按正常量进食进水,定期称体质量和饲养笼清洗。CUS模型是结合KATZ等[14]和WILLNER等[11]的建模方法并根据我们自身的实验条件制定的应激方案,每只大鼠单笼喂养,连续28 d,每天1~2次应激。慢性应激包括11种不同的压力源,包括:禁食/禁饮24 h,45 ℃倾斜鼠笼24 h,潮湿垫料/空垫料24 h,热水浴(45 ℃,5 min),冰水浴(4 ℃,5 min),昼夜颠倒12 h/12 h,行为限制1 h,80 db噪音4 h,频闪12 h,夹尾根部1 min,足底电击5 min。为了防止大鼠对应激的适应,实验后期逐渐适当增加刺激强度和频率。应激过程中,每周日进行糖水偏好测定,在进行糖水偏好测定期间不进行任何应激干预。应激结束后,根据糖水偏好测定结果,将CUS模型大鼠分为压力易感组(蔗糖偏好百分比<65%[11],n=12),压力耐受组(蔗糖偏好百分比与空白对照组无差异[13],n=12)。
1.3 大鼠体质量的测定给予CUS应激后,每周定期测量各组每只大鼠的体质量。
1.4 行为学测试 1.4.1 SPTSPT是评价动物快感缺乏程度的金标准[11-12]。在大鼠适应1%蔗糖后,对大鼠采用SPT进行测试。在这项实验中,我们将给予动物1%的蔗糖水和纯水各1瓶供自由选择,在12 h后切换位置,第2天早上对糖水和水的消耗量进行称量。并按如下公式计算糖水偏好百分比。
糖水偏好百分比=糖水消耗(g)/总液体消耗(g)×100%
1.4.2 旷场实验(open field test, OFT)该实验能评估大鼠的焦虑程度以及活动探索能力[15],在第4周应激结束后进行。将动物置于定制的有机塑料敞箱内(100 cm×100 cm×40 cm)。敞箱底部被划分为25个同等大小的格子,在绝对安静的环境下,将单只大鼠置于敞箱底部中央方格内,通过敞箱上方安装的自动摄像设备自动记录每只大鼠5 min的活动情况。分析录像时将记录的水平得分(大鼠4只爪均进入方格可计1分)及垂直得分(大鼠2只前爪均抬高1 cm以上计1分)进行相加,得出总评分。总评分越低,表明其自发活动减少,越焦虑。每次测试完成后,用70%的酒精对敞箱进行清除,保持敞箱干净,以防止任何嗅觉引起的行为改变。
1.5 标本的固定与取材在最后的行为测试结束后,每组随机抽取5只大鼠用于体视学分析。大鼠腹腔注射1%戊巴比妥钠(4 mL/kg),等其深度麻醉之后,开胸并经心脏予以灌注固定,先灌注加肝素的生理盐水,待大鼠体内血液变为澄清液时,再灌注4%多聚甲醛液20 mL/min,达到固定大脑的作用。灌注后开颅取出大脑并随机抽取一侧大脑半球,予以6%琼脂凝胶包埋后沿冠状方向连续切成1 mm厚的大脑切片。每张脑片用放大10倍的解剖显微镜拍照,拍照时脑片尾侧面朝上。在大脑半球的1 mm连续切片中,随机等距抽取连续5张含有白质的脑片。将等距测点的透明胶片随机叠加在脑片上,并抽取与白质重叠的组织块[10]。每只动物随机抽取5块1 mm3大小的白质组织块。这样可以保证大脑白质的各个部位的抽中概率相同[16]。
1.6 制备电镜切片将抽取出的1 mm3大小的白质组织块在4 ℃的条件下浸泡在4%戊二醛中2 h,然后用(0.1 mol/L,pH 7.2)PBS冲洗3次,1%锇酸染色后置于4 ℃冰箱固定2 h,经50%、70%、90%的乙醇,90%乙醇与90%丙酮的混合物后再经100%丙酮溶液梯度脱水,之后浸泡在100%环氧树脂中。为了确保各个方向的白质内有髓神经纤维被抽取的概率一致,先使用球切法(isector)[17]将组织块包埋成直径5 mm的树脂小球,之后再用常规电镜的包埋方法将小球再次包埋。每个包埋好的组织块中随机切取1张60 nm的超薄切片。先将放大倍数调至500~1 000倍,观察整个圆形铜网各个方孔的标本情况,确定随机等距抽取视野的大致距离。然后,经透射电子显微镜放大8 000倍后拍下随机抽取的8个视野拍照,避开血管和细胞,视野之间不重叠,尽量让所取的视野均匀分布于整个标本。每只动物拍摄40张电镜照片。
1.7 体视学方法分析 1.7.1 大脑白质总体积在大鼠大脑组织连续脑片的解剖显微镜照片上随机叠加等距测点,计数所有落在大鼠一侧半脑白质上的测试点数∑P(wm)(图 1),并根据卡瓦列原理计算出整个大鼠白质总体积[16-17]。
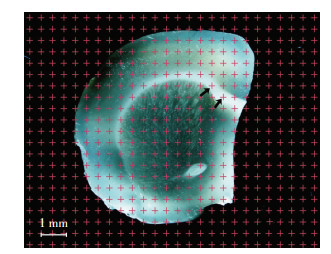
|
| 黑色箭头示击中白质的点,计数所有落在白质上的点数 图 1 大鼠脑切片的解剖显微镜观察 |
1.7.2 大脑白质内有髓神经纤维的体积密度及总体积
将等距测点框随机叠加在所得到的电镜照片上(放大8 000倍),并分别计数落在整个大鼠大脑白质内的测点数、白质内有髓神经纤维上的测点数,以及整个照片视野内的测点数(图 2)。计算出大鼠大脑白质内有髓神经纤维的体积密度和大脑白质内有髓神经纤维总体积[16-17]。

|
| 图 2 大脑白质内有髓神经纤维总体积的体视学计数示意图 |
1.8 统计学处理
使用SPSS 19.0统计软件,计量资料数据以x±s表示,体质量、SPT数据进行重复测量数据的方差分析,其余数据运用单因素方差分析。白质总体积数据方差不齐,予以lgα转换之后方差齐,再运用单因素方差分析比较各组之间数据的差异。检验水准:α=0.05。
2 结果 2.1 大鼠体质量实验过程中,空白对照组大鼠平均体质量逐渐增加,而压力易感组大鼠和压力耐受组大鼠平均体质量都逐渐下降。应激第3周末和第4周末,压力易感组和压力耐受组大鼠平均体质量均显著低于空白对照组(P < 0.01,图 3)。
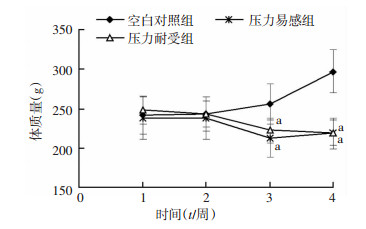
|
| a: P < 0.01,与空白对照组比较 图 3 3组大鼠体质量变化趋势 |
2.2 3组大鼠SPT和OFT结果比较
在给予4周的CUS期间,空白对照组和压力耐受组的糖水偏好百分比都稳定在90%左右,而压力易感组大鼠糖水偏好百分比逐渐下降;第4周末压力易感组糖水偏好百分比明显低于对照组和压力耐受组(P < 0.01,表 1)。与空白对照组的OFT得分相比,压力易感组大鼠在OFT中的总得分虽有下降,但差异不具有统计学意义(P > 0.05);而压力耐受组大鼠在OFT中的总评分显著高于空白对照组和压力易感组(P < 0.01,表 1)。
| 组别 | 第4周糖水偏好(%) | OFT得分 |
| 空白对照组 | 92.93±4.48 | 58.08±21.4 |
| 压力易感组 | 46.04±31.53a | 50.25±29.29 |
| 压力耐受组 | 96.94±1.65b | 87.16±23.39ab |
| a:P < 0.01,与空白对照组; b:P < 0.01,与压力易感组比较 | ||
2.3 3组大鼠大脑白质体积及白质内有髓神经纤维总体积的比较
如表 2所示:压力耐受组与空白对照组大鼠大脑白质总体积相比,差异无统计学意义(P > 0.05),但均显著高于压力易感组大鼠(P < 0.01);压力耐受组与空白对照组大鼠白质有髓神经纤维总体积相比,差异无统计学意义(P > 0.05),但均显著高于压力易感组(P < 0.01,P < 0.05)。
| 组别 | 白质体积 | 有髓神经纤维总体积 |
| 空白对照组 | 74.76±7.75 | 57.14±6.79 |
| 压力易感组 | 55.37±4.54b | 40.80±11.21a |
| 压力耐受组 | 87.51±10.7c | 69.29±8.41c |
| a:P < 0.05,b:P < 0.01,与空白对照组比较;c:P < 0.01,与压力易感组比较 | ||
3 讨论
抑郁症已经成为全球疾病负担的主要原因,严重威胁人们的生命财产安全,降低患者生活质量。压力是抑郁症的重要因素。但是在压力面前,个体的耐受力不同。压力耐受能力又称为心理弹性、心理复原力等,这种内在潜能被美国心理学会定义为在面临逆境、创伤、威胁、艰辛及其他生活重压下能够良好适应的“反弹能力”[18]。它的这种特性,使它可以成为一种潜在的心理疾病的预防能力,甚至可以通过应激接种,使压力易感的个体或者正常的人拥有这种抵抗压力的能力[19]。FRIEDMAN等[20]把这种具有压力耐受能力小鼠保持稳态适应压力的机制,应用到压力易感小鼠的身上,还可以达到治疗抑郁的效果。对压力的这种耐受能力,引发了越来越多科研人员的兴趣。抑郁症的核心症状是快感缺失和心境低落,而SPT能有效评价抑郁大鼠是否存在快感缺乏,是目前最常用的行为学检测手段[11-13]。在本实验中,CUS引起了压力易感组大鼠和压力耐受组大鼠体质量的显著下降,表明其均受到了压力的影响,但是压力易感组大鼠糖水偏好显著下降,而压力耐受组大鼠的糖水偏好与未经受压力的空白对照组的差异无统计学意义。那么压力耐受组大鼠适应压力的机制是什么呢?
目前在对压力耐受个体的研究中已经确定了一些与压力耐受有关的神经生物学物质(如睾酮、mGluR5、ΔFosB、K+离子通道和神经肽等)[21-25]。大脑在压力反应中扮演着关键的角色,其中海马、杏仁核、前额叶皮质等与抑郁症相关的脑区与压力耐受密切相关[26-28]。白质作为连接大脑各脑区的重要结构,大量研究提示抑郁患者大脑内普遍存在白质的改变[3-4]。BALLMAIER等[29]的临床研究显示抑郁症患者白质总体积显著性减少。本团队前期的体视学精确定量研究也发现在给予4周CUS干预后,抑郁模型大鼠白质体积显著性下降[5]。但对压力耐受的患者、对压力耐受的动物白质体积是否存在改变,尚少见研究报道。我们运用体视学方法对CUS模型白质体积进行精确定量研究发现:压力易感组大鼠的白质体积较空白对照组大鼠明显减小,再次证明白质萎缩可能参与了抑郁症的发病。值得注意的是压力耐受组大鼠的白质体积显著高于压力易感组,与未经受压力的空白对照组差异没有统计学意义,说明白质体积可能与压力耐受有关。
为什么压力耐受组不存在白质体积的改变呢?众所周知,有髓神经纤维作为白质最主要的组成成分,与大脑白质的完整性密切相关。而大脑白质的完整性是大脑网络系统众多信息传递畅通的重要结构基础,一旦皮质与皮质间联系的白质纤维完整性被破坏就会导致皮层间环路连接受损,导致情绪障碍[30]。越来越多的研究表明大脑白质完整性破坏包括大脑白质内有髓神经纤维的改变,与抑郁症的发病密切相关[30-32]。BERGAMINO等[4]DTI研究显示抑郁患者大脑皮质和皮质下区域FA值减小,提示有髓神经纤维的完整性降低,且微细结构遭到破坏。本团队前期的体视学研究发现,抑郁CUS模型大鼠的大脑白质内有髓神经纤维大量丢失可能是白质体积减小的重要原因[5]。那么有髓神经纤维是否参与了压力耐受性的改变呢?MATTHEWS等[8]通过DTI研究发现,没有发展成抑郁症的退伍军人的白质上纵束(SLF)区域FA值高于患有抑郁症的退伍军人。不仅如此,GALINOWSKI等[9]最近在对青少年抗压能力的DTI研究中发现,压力耐受组的青少年白质胼胝体区域的FA值,不仅显著高于压力易感组,而且显著高于正常对照组。而白质的FA值增高,意味着白质内纤维排序更规则,完整性更好,信息传导能力也更强等。可见,白质内有髓神经纤维结构和功能的完整性与压力的耐受性密切相关。然而, 这些影像学研究都是定性研究,且影像学技术不能对白质内有髓神经纤维超微结构的变化进行直接观察。而体视学方法为进一步定量研究大脑白质内有髓神经纤维的结构变化提供了非常好的手段。因此本实验将现代体视学方法与电镜技术相结合,对3个组的白质有髓神经纤维进行了精确的定量研究。本研究结果显示:压力易感大鼠大脑白质内有髓神经纤维的总体积较空白对照组显著性降低,再次说明压力易感大鼠大脑白质内有髓神经纤维的显著丢失可能是造成白质体积减小的主要原因之一。而压力耐受大鼠大脑白质内有髓神经纤维的总体积显著性高于压力易感大鼠,这可能是造成压力耐受组大鼠白质体积显著性大于压力易感组大鼠的主要原因之一。而压力耐受大鼠大脑白质内有髓神经纤维的总体积与空白对照组相比不存在显著性差异。本体视学研究更准确地支持以前的影像学研究结果,即白质内有髓神经纤维的结构和功能状态与压力易感性之间存在相关关系。
综上所述,本研究提示白质及白质内的有髓神经纤维的结构改变可能是抑郁症重要的病理改变之一,其也可能是压力耐受的重要神经结构基础。白质和白质内有髓神经纤维有望成为新的抗抑郁治疗的结构靶点。
| [1] | LEDFORD H. Medical research: if depression were cancer[J]. Nature, 2014, 515(7526): 182–184. DOI:10.1038/515182a |
| [2] | COHEN S, JANICKI-DEVERTS D, MILLER G E. Psychological stress and disease[J]. JAMA, 2007, 298(14): 1685–1687. DOI:10.1001/jama.298.14.1685 |
| [3] | KIRTON J W, RESNICK S M, DAVATZIKOS C, et al. Depressive symptoms, symptom dimensions, and white matter lesion volume in older adults: a longitudinal study[J]. Am J Geriatr Psychiatry, 2014, 22(12): 1469–1477. DOI:10.1016/j.jagp.2013.10.005 |
| [4] | BERGAMINO M, KUPLICKI R, VICTOR T A, et al. Comparison of two different analysis approaches for DTI free-water corrected and uncorrected maps in the study of white matter microstructural integrity in individuals with depression[J]. Hum Brain Mapp, 2017, 38(9): 4690–4702. DOI:10.1002/hbm.23694 |
| [5] | GAO Y, MA J, TANG J, et al. White matter atrophy and myelinated fiber disruption in a rat model of depression[J]. J Comp Neurol, 2017, 525(8): 1922–1933. DOI:10.1002/cne.24178 |
| [6] | YUEN T J, SILBEREIS J C, GRIVEAU A, et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis[J]. Cell, 2014, 158(2): 383–396. DOI:10.1016/j.cell.2014.04.052 |
| [7] | THAM M W, WOON P S, SUM M Y, et al. White matter abnormalities in major depression: evidence from post-mortem, neuroimaging and genetic studies[J]. J Affect Disord, 2011, 132(1-2): 26–36. DOI:10.1016/j.jad.2010.09.013 |
| [8] | MATTHEWS S C, STRIGO I A, SIMMONS A N, et al. A multimodal imaging study in U.S. veterans of Operations Iraqi and Enduring Freedom with and without major depression after blast-related concussion[J]. Neuroimage, 2011, 54(Suppl 1): S69–S75. DOI:10.1016/j.neuroimage.2010.04.269 |
| [9] | GALINOWSKI A, MIRANDA R, LEMAITRE H, et al. Resilience and corpus callosum microstructure in adolescence[J]. Psychol Med, 2015, 45(11): 2285–2294. DOI:10.1017/S0033291715000239 |
| [10] | LI C, YANG S, CHEN L, et al. Stereological methods for estimating the myelin sheaths of the myelinated fibers in white matter[J]. Anat Rec (Hoboken), 2009, 292(10): 1648–1655. DOI:10.1002/ar.20959 |
| [11] | WILLNER P, TOWELL A, SAMPSON D, et al. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant[J]. Psychopharmacology (Berl), 1987, 93(3): 358–364. DOI:10.1007/bf00187257 |
| [12] | KIM C S, BRAGER D H, JOHNSTON D. Perisomatic changes in h-channels regulate depressive behaviors following chronic unpredictable stress[J]. Mol Psychi, 2017. DOI:10.1038/mp.2017.28 |
| [13] | ZURAWEK D, KUSMIDER M, FARON-GORECKA A, et al. Reciprocal microRNA expression in mesocortical circuit and its interplay with serotonin transporter define resilient rats in the chronic mild stress[J]. Mol Neurobiol, 2017, 54(8): 5741–5751. DOI:10.1007/s12035-016-0107-9 |
| [14] | KATZ R J. Animal model of depression: pharmacological sensitivity of a hedonic deficit[J]. Pharmacol Biochem Behav, 1982, 16(6): 965–968. DOI:10.1016/0091-3057(82)90053-3 |
| [15] | LIU J, DIETZ K, DELOYHT J M, et al. Impaired adult myelination in the prefrontal cortex of socially isolated mice[J]. Nat Neurosci, 2012, 15(12): 1621–1623. DOI:10.1038/nn.3263 |
| [16] | TANG Y, NYENGAARD J R, PAKKENBERG B, et al. Age-induced white matter changes in the human brain: a stereological investigation[J]. Neurobiol Aging, 1997, 18(6): 609–615. DOI:10.1016/s0197-4580(97)00155-3 |
| [17] | TANG Y, NYENGAARD J R. A stereological method for estimating the total length and size of myelin fibers in human brain white matter[J]. J Neurosci Methods, 1997, 73(2): 193–200. DOI:10.1016/s0165-0270(97)02228-0 |
| [18] |
李杰, 厉萍. 抑郁症患者心理弹性的研究进展[J].
精神医学杂志, 2014, 27(3): 235–237.
LI J, LI P. Research progress of resilience in patients with depression[J]. J Psychiatry, 2014, 27(3): 235–237. |
| [19] | CHAUDHURY D, WALSH J J, FRIEDMAN A K, et al. Rapid regulation of depression-related behaviours by control of midbrain dopamine neurons[J]. Nature, 2013, 493(7433): 532–536. DOI:10.1038/nature11713 |
| [20] | FRIEDMAN A K, WALSH J J, JUAREZ B, et al. Enhancing depression mechanisms in midbrain dopamine neurons achieves homeostatic resilience[J]. Science, 2014, 344(6181): 313–319. DOI:10.1126/science.1249240 |
| [21] | HERRERA-P REZ J J, MART NEZ-MOTA L, CHAVIRA R, et al. Testosterone prevents but not reverses anhedonia in middle-aged males and lacks an effect on stress vulnerability in young adults[J]. Horm Behav, 2012, 61(4): 623–630. DOI:10.1016/j.yhbeh.2012.02.015 |
| [22] | SHIN S, KWON O, KANG J I, et al. mGluR5 in the nucleus accumbens is critical for promoting resilience to chronic stress[J]. Nat Neurosci, 2015, 18(7): 1017–1024. DOI:10.1038/nn.4028 |
| [23] | NESTLER E J. ΔFosB: a transcriptional regulator of stress and antidepressant responses[J]. Eur J Pharmacol, 2015, 753: 66–72. DOI:10.1016/j.ejphar.2014.10.034 |
| [24] | FRIEDMAN A K, JUAREZ B, KU S M, et al. KCNQ channel openers reverse depressive symptoms via an active resilience mechanism[J]. Nat Commun, 2016, 7: 11671. DOI:10.1038/ncomms11671 |
| [25] | KAUTZ M, CHARNEY D S, MURROUGH J W. Neuropeptide Y, resilience, and PTSD therapeutics[J]. Neurosci Lett, 2017, 649: 164–169. DOI:10.1016/j.neulet.2016.11.061 |
| [26] | SUN H, SU R, ZHANG X, et al. Hippocampal GR-and CB1-mediated mGluR5 differentially produces susceptibility and resilience to acute and chronic mild stress in rats[J]. Neuroscience, 2017, 357: 295–302. DOI:10.1016/j.neuroscience.2017.06.017 |
| [27] | FEBBRARO F, SVENNINGSEN K, TRAN T P, et al. Neuronal substrates underlying stress resilience and susceptibility in rats[J]. PLoS ONE, 2017, 12(6): e0179434. DOI:10.1371/journal.pone.0179434 |
| [28] | WORLEY N B, HILL M N, CHRISTIANSON J P. Prefrontal endocannabinoids, stress controllability and resilience: A hypothesis[J]. Prog Neuro Psychopharmacol Biol Psychiatry, 2017. DOI:10.1016/j.pnpbp.2017.04.004 |
| [29] | BALLMAIER M, TOGA A W, BLANTON R E, et al. Anterior cingulate, gyrus rectus, and orbitofrontal abnormalities in elderly depressed patients: an MRI-based parcellation of the prefrontal cortex[J]. Am J Psychiatry, 2004, 161(1): 99–108. DOI:10.1176/appi.ajp.161.1.99 |
| [30] | HEMANTH KUMAR B S, MISHRA S K, TRIVEDI R, et al. Demyelinating evidences in CMS rat model of depression: a DTI study at 7 T[J]. Neuroscience, 2014, 275: 12–21. DOI:10.1016/j.neuroscience.2014.05.037 |
| [31] | KIESEPP T, EEROLA M, M NTYL R, et al. Major depressive disorder and white matter abnormalities: a diffusion tensor imaging study with tract-based spatial statistics[J]. J Affect Disord, 2010, 120(1-3): 240–244. DOI:10.1016/j.jad.2009.04.023 |
| [32] | LI W, MUFTULER L T, CHEN G, et al. Effects of the coexistence of late-life depression and mild cognitive impairment on white matter microstructure[J]. J Neurol Sci, 2014, 338(1/2): 46–56. DOI:10.1016/j.jns.2013.12.016 |



