ZHOU Lin, E-mail:linzhou65@hotmail.com
肾脏缺血再灌注(ischemia-reperfusion,IR)损伤是临床最常见的急重症之一。近年来,随着灾害、创伤复合伤及各类介入手术的增加,其发病率呈逐年上升趋势。在常规住院患者中发生率为3%~7.2%,重症监护病房(ICU)患者中发生率为5%~30%,病死率更是高达28%~82%,并且预后不良[1-2],造成严重的社会经济和家庭负担。近曲小管细胞受损是肾脏缺血再灌注损伤的主要病理基础[3],但是其小管损伤的具体调控分子机制尚不清楚。因此,明确近曲小管细胞损害发生机制,寻找有效干预靶点,阻断I/R损伤的最终发生,对于肾脏器官功能保护具有重大意义。
G蛋白偶联受体激酶(G protein-coupled receptor kinase 4,GRK)家族是一类丝氨酸/苏氨酸激酶,由7种亚型组成,其中GRK4主要在肾脏等组织中高丰度表达[4]。我们前期研究发现,GRK4参与了原发性高血压在内多种慢性心血管和肾脏疾病的发生,其机制可能与GRK4激活肾脏内肾素-血管紧张素系统(renin-angiotensin system,RAS)及增加AT1R介导的尿钠排泄障碍有关[5-6]。但是,GRK4是否参与调控急性肾脏缺血再灌注损伤的发生,目前尚不清楚。因此,本研究通过建立GRK4转基因小鼠急性肾脏I/R模型,探讨GRK4对肾脏急性缺血再灌注损伤的影响及其作用机制。
1 材料与方法 1.1 实验材料人源性GRK4转基因C57BL/6小鼠由北京华夏凯奇生物技术有限公司构建和鉴定。GRK4、AT1R兔源性抗体购于美国Santa Cruz公司。磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)兔源抗体购于武汉三鹰公司。山羊抗兔IRDye800 CW二抗购于美国LI-COR生物科技公司。TUNEL细胞凋亡检测试剂盒(in situ cell death detection kit,POD)购自罗氏公司。总超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(WST-8法)、脂质氧化(MDA)检测试剂盒(lipid peroxidation MDA assay kit)购于南京建成生物科技公司。RIPA细胞裂解液(RIPA lysis buffer)、蛋白质BCA法定量试剂盒、乙二胺四乙酸(EDTA)-柠檬酸钠抗原修复液、4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)染液和抗荧光淬灭封片剂购自碧云天生物科技公司。苏木精、伊红购于美国Sigma公司。戊巴比妥钠、PBS、多聚甲醛等均为市售分析纯。
1.2 动物模型的制备与分组选取SPF级饲养条件,健康野生型小鼠[8周龄,体质量(21.34±0.42)g]和GRK4转基因型C57BL/6小鼠[8周龄,体质量(21.87±0.68)g]各12只,由第三军医大学大坪医院实验动物中心提供[合格证号SCXK(渝)2012-0005]。各型分别按随机数表法分为4组(n=6):野生型假手术对照组、野生型肾脏缺血再灌注损伤组、GRK4转基因型假手术对照组、GRK4转基因型肾脏缺血再灌注损伤组。构建肾脏缺血再灌注损伤模型前[7],小鼠禁食24 h。1 %戊巴比妥钠水溶液、60 mg/kg腹腔注射麻醉小鼠,麻醉后剃净腹部毛发,将小鼠固定于恒温加热台,碘伏消毒腹部皮肤切口区域,腹部中央行剖腹术,游离暴露一侧肾门部结扎肾动脉和输尿管,切除该侧肾脏,留取肾脏组织标本。暴露对侧肾脏的肾门部分离肾动脉,用微动脉夹将肾动脉进行咬合夹闭造成肾脏缺血,肾脏由鲜红色变为紫黑色,假手术对照组肾门不夹闭。缺血夹闭45 min后,松开血管夹,见肾脏由紫黑色恢复鲜红色,表明成功恢复血流灌注。腹腔放入约1 mL温生理盐水,缝合切口后放回笼中恢复。术后小鼠正常进食水24 h后,经眼球静脉丛取血。将肾脏组织纵向剖开,一部分于4%多聚甲醛中固定,其余肾脏冻存于-80 ℃冰箱。
1.3 肾脏功能检测将静脉血标本以3 000 r/min离心10 min,分离上层血清。由第三军医大学大坪医院检验科采用Analyzer Medical Systems SaBa18全自动生化分析仪,测定血清肌酐、血尿素氮等肾脏功能指标。
1.4 肾脏组织病理检查和损伤评分用4%多聚甲醛溶液固定肾脏组织24 h,常规脱水、石蜡包埋、切片厚度4 μm,二甲苯脱蜡、酒精透明、HE染色、中性树胶封片剂封片。在光学显微镜下,每张切片选取肾皮质区10个视野,采用两人盲法,随机拍照观察肾脏组织的损伤病理改变。在显微镜下观察小管细胞变性死亡、出现管型的所占比例,进行小管损伤半定量病理评分[8]。具体评分标准为:0分为正常;1分为≤10%;2分为11%~25%;3分为26%~50%;4分为51%~75%;5分为≥75%,400倍镜下按象限各选取3个视野评分,并取评分的算术平均值。
1.5 TUNEL试剂盒检测肾小管细胞凋亡情况将肾脏组织石蜡切片常规脱蜡后,放入乙二胺四乙酸(EDTA)柠檬酸钠抗原修复液中,微波炉加热15 min。用磷酸盐缓冲液(PBS)洗涤3次,在标本上滴加50 μL TUNEL检测液(含有2 μL TdT酶、48 μL荧光标记液),避光37 ℃孵育1 h,PBS洗涤3次。4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)染液50 μL染核1 min,PBS洗涤3次,抗荧光淬灭封片剂封片。在荧光显微镜下观察,每张切片在400倍镜下选取皮质区6个视野,计数小管细胞凋亡数,并取计数的算术平均值。
1.6 肾脏组织氧化应激指标检测根据总SOD和MDA检测试剂盒说明书,利用酶联免疫吸附实验法分别测定肾脏组织中总SOD和MDA含量,结果用组织总蛋白浓度进行校正,总SOD活性单位为U/mg,MDA含量单位为nmol/mg。
1.7 蛋白质免疫印迹检测GRK4及AT1R的表达称取肾脏组织80 μg放入玻璃研磨匀浆器中,加入400 μL RIPA细胞裂解液,经超声破碎和冰上裂解后,4 ℃ 12 000×g离心40 min,取上清为各组提取的肾脏组织的总蛋白。采用蛋白质BCA定量法(碧云天)测定蛋白质浓度。取等体积2倍上样缓冲液混合后100 ℃煮沸10 min。将100 μg变性后的蛋白质进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,湿转至硝酸纤维素(nitrocellulose blotting membranes,NC)膜,含5 %脱脂奶粉TBST溶液室温下封闭1 h。分别用兔源性GRK4抗体(Santa Cruz,1 :500)、AT1R抗体(Santa Cruz,1 :500)和GAPDH(武汉三鹰,1 :1 000)4 ℃孵育过夜。室温复温30 min后,TBST 10 min/次、洗涤3次,羊抗兔IRDye800二抗(1 :10 000)室温孵育1 h,TBST 10 min/次、洗涤3次。采用美国LI-COR公司的Odyssey双色红外荧光成像系统,扫描确定分析蛋白条带。结果经过Quantity One软件对条带面积的灰度值分析,以内参GAPDH灰度的比值校正作为相对浓度,进行定量分析。
1.8 统计学分析采用SPSS 23.0软件分析,计量资料结果以x±s表示;计量资料两组间比较采用两独立样本t检验;多组间比较采用双因素方差分析。
2 结果 2.1 肾脏缺血再灌注损伤后GRK4蛋白表达量增高野生型小鼠的实验结果表明,与假手术对照组相比,缺血再灌注损伤后的肾脏功能受损,血清中的肌酐[(172.79±6.94)vs(23.88±5.18)μmol/L,P < 0.05]和尿素氮[(45.41±6.53)vs(7.17±0.81)mmol/L,P < 0.05]均出现明显升高,差异具有统计学意义,表明成功建立了小鼠肾脏缺血再灌注损伤模型。同时,与假手术对照组对比,缺血再灌注损伤组小鼠肾脏组织中GRK4蛋白的相对表达量[(2.30±0.05)vs(1.04± 0.13),P < 0.05]出现明显上升,差异具有统计学意义,提示GRK4可能参与了缺血再灌注后肾脏损伤的发生,如图 1所示。

|
| 1:野生型假手术对照组;2:野生型缺血再灌注损伤组 图 1 蛋白质免疫印迹检测肾脏缺血再灌注损伤对小鼠肾脏功能和GRK4蛋白表达量的影响 |
2.2 过表达GRK4加重肾脏缺血再灌注后小鼠肾功能损伤
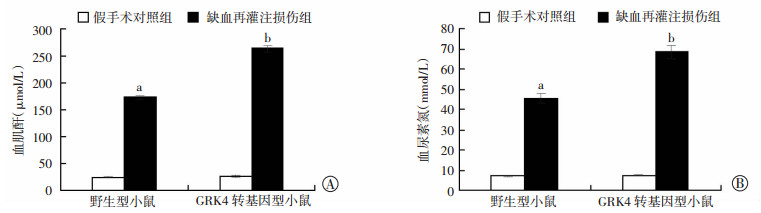
进一步在GRK4转基因小鼠上研究结果发现,与野生型小鼠缺血再灌注组比较,GRK4转基因型小鼠缺血再灌注组血清中肌酐[(263.30±12.68)vs (172.79±6.94) μmol/L,P < 0.05]和尿素氮[(68.19± 5.93)vs(45.41±6.53) mmol/L,P < 0.05]明显升高,提示过表达GRK4加重肾脏缺血再灌注后肾功能损伤,见图 2。
|
| A:血肌酐含量;B:血尿素氮含量 a:P < 0.05,与假手术对照组比较;b:P < 0.05,与野生型小鼠比较 图 2 过表达GRK4对肾脏缺血再灌注后小鼠血肌酐、血尿素氮的影响(n=6,x±s) |
2.3 过表达GRK4促进肾脏缺血再灌注后病理结构损伤
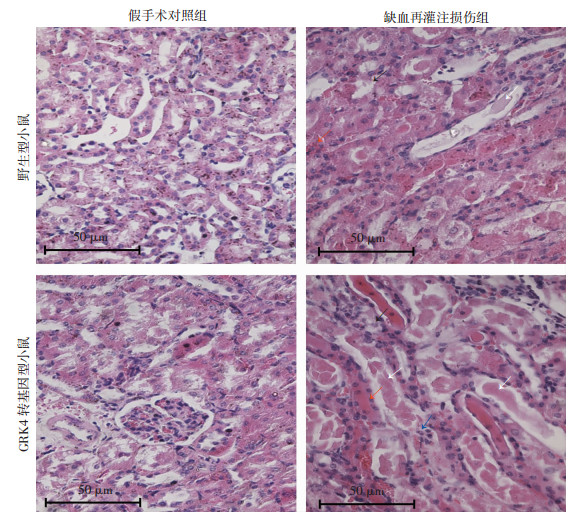
观察光镜下肾脏组织病理切片,假手术对照组肾脏组织结构均无明显损伤。野生型小鼠缺血再灌注损伤组的肾脏皮质区结构有明显损伤,肾小管所在肾脏间质出现充血、蛋白管型,局部肾小管上皮细胞出现固缩死亡和炎性细胞浸润。与野生型小鼠缺血再灌注损伤组对比,GRK4转基因型小鼠缺血再灌注损伤组的肾脏病理损伤更加严重,肾小管内出现大量蛋白管型、肾间质明显出血、肾小管细胞出现大面积死亡,镜下可见炎症细胞大量浸润。肾小管病理损伤评分结果[(3.59±0.41)vs(2.33±0.51),P < 0.05],与光镜观察结果一致,差异具有统计学意义,提示过表达GRK4可以促进缺血再灌注后肾脏病理结构的损伤,见图 3。
|
| 红色箭头示肾间质充血;白色箭头示蛋白管型;黑色箭头示死亡细胞;蓝色箭头示炎性细胞浸润 图 3 HE染色检测过表达GRK4对肾脏缺血再灌注损伤后小鼠肾脏病理结构的改变 |
2.4 过表达GRK4加重肾脏缺血再灌注后氧化应激和细胞凋亡
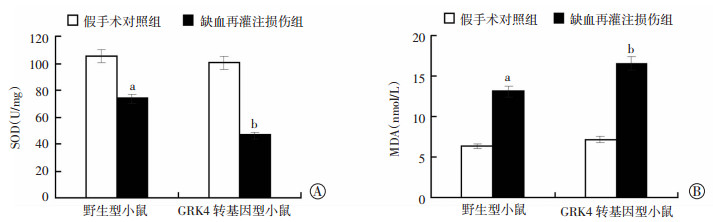
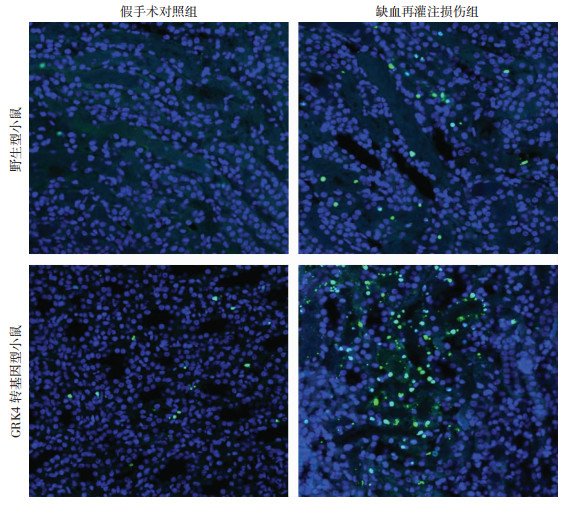
与野生型假手术对照组比较,野生型小鼠缺血再灌注损伤组的肾脏组织中,总SOD明显下降[(73.82± 5.47)vs(105.38±9.79)U/mg,P < 0.05]、MDA含量升高[(13.15±0.81)vs(6.37±0.54)nmol/mg,P < 0.05],差异有统计学意义,提示缺血再灌注损伤引起肾脏氧化应激水平升高。对比野生型小鼠缺血再灌注损伤组,GRK4转基因型小鼠缺血再灌注损伤组肾脏中总SOD降低[(46.42±5.23)vs(73.82±5.47)U/mg,P < 0.05]、MDA含量升高[(16.55±0.85)vs(13.15±0.81)nmol/mg,P < 0.05]更为明显,差异有统计学意义(图 4)。细胞凋亡发生与氧化应激水平的增高密切相关,进一步观察肾脏组织切片TUNEL染色发现,假手术对照组小鼠的肾脏组织内均未见明显细胞凋亡。但是,野生型小鼠缺血再灌注损伤组肾脏组织中,TUNEL阳性凋亡细胞数目增多;GRK4转基因型小鼠缺血再灌注损伤组的肾脏中,凋亡小管细胞数目增加更为明显,差异有统计学意义(P < 0.05),提示过表达GRK4增加了肾脏缺血再灌注损伤后肾脏氧化应激,促进细胞凋亡的发生,加重肾脏小管细胞的丢失,如图 5所示。
|
| A:SOD含量;B:MDA含量 a:P < 0.05,与假手术对照组比较;b:P < 0.05,与野生型缺血再灌注损伤组比较 图 4 过表达GRK4对肾脏缺血再灌注后小鼠肾脏氧化应激的影响(n=6,x±s) |
|
| 图 5 过表达GRK4对肾脏缺血再灌注后小鼠肾脏细胞凋亡的影响(TUNEL ×400) |
2.5 过表达GRK4促进肾脏AT1R蛋白表达、加重肾脏组织的氧化应激
组织细胞内RAS系统的激活与氧化应激、调控凋亡密切相关,检测肾脏组织RAS系统中关键蛋白AT1R的表达发现,与野生型小鼠假手术对照组相比,GRK4转基因型小鼠假手术对照组的肾脏AT1R蛋白表达量出现明显增高[(1.75±0.05)vs(0.89±0.04),P < 0.05],差异有统计学意义,提示过表达GRK4可以促进AT1R表达量增加。与假手术对照组对比,肾脏AT1R蛋白表达在缺血再灌注损伤后升高;与野生型小鼠缺血再灌注损伤组比较,过表达GRK4小鼠肾脏缺血再灌注损伤后,肾脏组织中AT1R蛋白表达量升高更加明显[(3.92±0.06)vs(2.31±0.09),P < 0.05],差异有统计学意义,提示肾脏缺血再灌注损伤后,过表达GRK4可以促进AT1R表达,增加肾脏组织内氧化应激水平,加重肾脏小管细胞凋亡、损伤发生,如图 6所示。
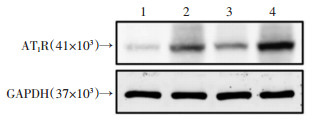
|
| 1:野生型假手术对照组;2:野生型缺血再灌注损伤组;3:GRK4转基因型假手术对照组;4:GRK4转基因型缺血再灌注损伤组 图 6 蛋白质免疫印迹检测过表达GRK4对缺血再灌注损伤后小鼠肾脏AT1R蛋白表达量的影响 |
3 讨论
肾脏缺血再灌注(ischemia-reperfusion,IR)损伤是临床心肌梗死、心力衰竭、休克后,以及围术期(如心脏手术、大血管手术、肾部分切除术和肾移植等)术后常见重要并发症[1-2],是急性缺血性肾功能衰竭的重要损伤环节,同时也是高血压肾病肾功能损伤的重要因素。既往研究表明GRK家族参与了多种慢性肾脏和心血管疾病的发生过程[9],但其是否调控急性肾脏缺血再灌注损伤,目前尚不清楚。
本课题建立C57BL/6小鼠肾脏缺血再灌注动物模型,采用ALC-HTP动物恒温系统控制实验小鼠体温于37 ℃,保证动物模型的稳定性。肾脏缺血再灌注损伤后,缺血再灌注组小鼠血肌酐和血尿素氮,均比假手术对照组明显升高;HE染色、TUNEL染色发现肾小管上皮细胞严重变性、炎细胞浸润和凋亡细胞增加;我们检测了缺血再灌注损伤后肾脏组织中GRK4的改变,发现其蛋白表达量出现明显升高。为了证明GRK4在缺血再灌注损伤中的作用,我们成功构建了GRK4转基因型小鼠。在过表达GRK4小鼠上,进一步证实其在肾脏缺血再灌注损伤中作用及机制。
GRK4是GRK激酶家族主要成员之一,GRK家族是体内一类重要的丝氨酸/苏氨酸激酶,该家族具有7个亚型。其中,GRK1和GRK7主要分布在视网膜;GRK2、GRK3、GRK5和GRK6在机体表达广泛;而GRK4则分布局限,主要在肾脏等器官中表达丰富,主要存在于皮质区的近曲小管细胞中[10]。在既往研究中发现,心脏中表达丰富的GRK2可以明显加重心肌梗死后细胞死亡,抑制GRK2可保护缺血后心肌细胞丢失[11]。本研究发现小鼠过表达GRK4后可明显加重肾脏I/R损伤。与野生型小鼠缺血再灌注损伤组相比,GRK4过表达小鼠再灌注24 h后,血清中肌酐和尿素氮明显升高;同时肾脏病理形态学损伤也更加严重,小管内出现了大量蛋白管型、肾间质明显出血、肾小管细胞出现大面积死亡、镜下可见炎症细胞大量浸润,肾小管病理损伤评分结果也与光镜观察结果一致。这些结果均证实,GRK4在肾脏I/R损伤中扮演了促进损伤的角色和作用。
肾脏缺血再灌注损伤发病机制复杂,目前认为多种分子及细胞内信号通路参与其中,主要包括再灌注诱发RAS系统激活,造成细胞内大量活性氧(ROS)爆发,导致细胞炎症、凋亡和坏死的增加[12-13]。有研究认为肾脏损伤时肾小管上皮细胞损伤有坏死和凋亡同时发生,二者在其中的作用取决于肾脏损伤的严重程度[14-15]。在本实验中,缺血再灌注损伤后小鼠肾脏组织内细胞凋亡指标明显升高,支持细胞凋亡在缺血再灌注损伤中的具有重要作用的观点。为研究GRK4的激活是否造成肾小管上皮细胞的凋亡,我们对GRK4转基因型小鼠肾脏缺血再灌注损伤后进行凋亡检测,发现过表达GRK4的肾脏组织,缺血再灌注损伤后TUNEL阳性凋亡数目明显增加,提示GRK4可以促进肾脏缺血再灌注损伤后肾脏组织中细胞凋亡的发生。
大量研究显示,细胞内氧化应激与凋亡发生密切相关,组织中RAS系统的激活可以明显加重氧化应激和凋亡的发生[16-17]。我们前期研究也发现,使用RAS系统抑制剂阿列吉伦,可以降低细胞内氧化应激和凋亡,缓解肾脏缺血再灌注损伤[18]。为研究GRK4是否促进肾脏缺血再灌注损伤后细胞氧化应激和RAS系统的激活,本研究发现对比野生型小鼠,GRK4转基因型小鼠肾脏缺血再灌注损伤后,抗氧化酶SOD的活力下降、脂质氧化产物MDA上升,氧化应激水平加重。我们进一步研究发现,GRK4转基因型小鼠可以促进AT1R含量增高;而肾脏缺血再灌注损伤后,肾脏AT1R含量进一步增加。提示肾脏缺血再灌注损伤后,GRK4可以通过上调肾脏AT1R表达,促进小管细胞氧化应激的加重、增加肾脏细胞凋亡的发生。
综合本文实验结果表明,GRK4可以明显加重肾脏缺血再灌注损伤,其机制可能与上调AT1R的表达、增加细胞氧化应激和凋亡有关。但是,GRK4在肾脏缺血再灌注损伤后是如何促进下游AT1R基因表达增加的调控机制,仍需要后续进一步研究。本研究首次发现,GRK4可能是参与肾脏缺血再灌注损伤的关键致病分子,为提高未来临床合并高血压病患者肾脏I/R损伤的预防和治疗,保护患者肾脏功能,提供了重要的分子靶点。
| [1] | BELLOMO R, KELLUM J A, RONCO C. Acute kidney injury:The Lancet[J]. Lancet, 2012, 380(9843): 756–766. DOI:10.1016/S0140-6736(11)61454-61462 |
| [2] | FORTRIE G, STADS S, AARNOUDSE A J, et al. Long-term sequelae of severe acute kidney injury in the critically ill patient without comorbidity: a retrospective cohort study[J]. PLoS One, 2015, 10(3): 121482–121494. DOI:10.1371/journal.pone.0121482 |
| [3] | MACEDO E, MEHTA R L. Renal recovery after acute kidney injury[J]. Contrib Nephrol, 2016, 187: 24–35. DOI:10.1159/000443289 |
| [4] | YATABE J, SANADA H, MIDORIKAWA S, et al. Effects of decreased renal cortical expression of G protein-coupled receptor kinase 4 and angiotensin type 1 receptors in rats[J]. Hypertens Res, 2008, 31(7): 1455–1464. DOI:10.1291/hypres.31.1455 |
| [5] | JOSE P A, SOARESDASILVA P, EISNER G M, et al. Dopamine and G protein-coupled receptor kinase 4 in the kidney: role in blood pressure regulation[J]. Biochim Biophys Acta, 2010, 1802(12): 1259–1267. DOI:10.1016/j.bbadis.2010.02.004 |
| [6] | YANG J, VILLAR V A, JONES J E, et al. G Protein-Coupled Receptor Kinase 4: Role in Hypertension[J]. Hypertension, 2015, 65(6): 1148–1155. DOI:10.1161/HYPERTENSIONAHA.115.05189 |
| [7] | HUMPHREYS B D, VALERIUS M T, KOBAYASHI A, et al. Intrinsic epithelial cells repair the kidney after injury[J]. Cell Stem Cell, 2008, 2(3): 284. DOI:10.1016/j.stem.2008.01.014 |
| [8] |
王永斌, 韩愈, 高照, 等. 白藜芦醇通过沉默信息调节因子1保护造影剂急性肾损伤[J].
中华高血压杂志, 2016(12): 1154–1160.
WNAG Y B, HAN Y, GAO Z, et al. Resveratrol protects against contrast-induced nephropathy in rats through silent information regulator1[J]. Chin J Hypertens, 2016(12): 1154–1160. DOI:10.16439/j.cnki.1673-7245.2016.12.017 |
| [9] | WANG Z, ZENG C, VILLAR V A, et al. Human GRK4γ142V variant promotes angiotensin Ⅱ type I receptor-mediated hypertension via renal histone deacetylase type 1 inhibition[J]. Hypertension, 2016, 67(2): 325–334. DOI:10.1161/HYPERTENSIONAHA.115.05962 |
| [10] | LINGYONG L, HOMAN K T, VISHNIVETSKIY S A, et al. G protein-coupled receptor kinases of the GRK4 protein subfamily phosphorylate inactive G protein-coupled receptors (GPCRs)[J]. J Biol Chem, 2015, 290(17): 10775–10790. DOI:10.1074/jbc.M115.644773 |
| [11] | POLHEMUS D J, GAO J, SCARBOROUGH A L, et al. Radiofrequency renal denervation protects the ischemic heart via inhibition of GRK2 and increased nitric oxide signaling[J]. Circ Res, 2016, 119(3): 470–480. DOI:10.1161/CIRCRESAHA.115.308278 |
| [12] | BAEK J H, ZENG R, WEINMANNMENKE J, et al. IL-34 mediates acute kidney injury and worsens subsequent chronic kidney disease[J]. J Clin Invest, 2015, 125(8): 3198–3214. DOI:10.1172/JCI81166 |
| [13] | ELTZSCHIG H K, ECKLE T. Ischemia and reperfusion-from mechanism to translation[J]. Nat Med, 2011, 17(11): 1391–1401. DOI:10.1038/nm.2507 |
| [14] | XU Y, MA H, SHAO J, et al. A role for tubular necroptosis in cisplatin-induced AKI[J]. J Am Soc Nephrol, 2015, 26(11): 2647–658. DOI:10.1681/ASN.2014080741 |
| [15] | CAO W, LI A, LI J, et al. Reno-cerebral reflex activates the renin-angiotensin system, promoting oxidative stress and renal damage after ischemia-reperfusion injury[J]. Antioxid Redox Signal, 2017, 27(7): 415–432. DOI:10.1089/ars.2016.6827 |
| [16] | FANG F, LIU G C, ZHOU X, et al. Loss of ACE2 exacerbates murine renal ischemia-reperfusion injury[J]. PLoS One, 2013, 8(8): e71433. DOI:10.1371/journal.pone.0071433 |
| [17] | CAO W, LI A, LI J, et al. Reno-cerebral reflex activates the renin-angiotensin system, promoting oxidative stress and renal damage after ischemia-reperfusion injury[J]. Antioxid Redox Signal, 2017, 27(7): 415–432. DOI:10.1089/ars.2016.6827 |
| [18] | WANG Z, LIU Y, HAN Y, et al. Protective effects of aliskiren on ischaemia-reperfusion-induced renal injury in rats[J]. Eur J Pharmacol, 2013, 718(1-3): 160–166. DOI:10.1016/j.ejphar.2013.08.038 |



