中耳炎(otitis media,OM)是儿童常见的感染性疾病之一,也是上呼吸道病毒感染的常见并发症之一[1]。若不及时进行有效治疗极易发展为慢性中耳炎,导致中耳组织不可逆损伤,引起患儿听力下降、后天性耳聋、语言发育障碍,严重影响患儿的生活质量,也为全社会带来极大的经济负担和社会负担[2]。肺炎链球菌(Streptococcus pneumoniae,Spn)是中耳炎主要的致病菌之一[3]。流行病学调查发现呼吸道病毒感染流行时往往伴随肺炎、中耳炎的高发病率,许多儿童在罹患中耳炎之前都有上呼吸道病毒感染病史[4-5]。MCCULLERS[6]研究表明甲型流感病毒(influenza A virus,IAV)感染促进鼻咽部定植的Spn上行至中耳腔引起中耳炎。对婴幼儿和儿童使用流感疫苗后能降低OM的发病率[7]。上述研究结果均表明IAV在Spn中耳炎的发生、发展中发挥了重要作用,但是具体机制仍不清楚。制约继发性肺炎链球菌感染性OM发病机制研究的瓶颈主要是继发Spn感染性中耳炎动物模型的构建。因此,建立流感病毒感染后继发性肺炎链球菌感染性OM中耳炎小鼠模型对深入研究中耳炎的发病机制具有重要的科学意义。
本研究给予C57BL/6小鼠滴鼻方式模拟IAV自然感染途径,并于感染后第5天经听泡穿刺[8]接种Spn建立继发感染模型,比较继发感染中耳炎与单纯Spn中耳炎的差异,为阐明IAV预感染后细菌性中耳炎迁延不愈、反复发作的机制奠定实验基础。
1 材料与方法 1.1 实验材料 1.1.1 实验动物SPF级6~8周龄健康C57BL/6小鼠,体质量18~22 g,由重庆医科大学动物实验中心提供。
1.1.2 菌株肺炎链球菌血清型19F(Spn 19F)由重庆医科大学附属儿童医院检验科提供。
1.1.3 流感病毒株H1N1流感病毒株PR8(A/PuertoRico/8/1934)购自美国模式培养物集存库(American type culture collection,ATCC)。
1.1.4 试剂与仪器肺炎链球菌半合成液体培养基C+Y (含酪蛋白、盐酸半胱氨酸、腺苷、谷氨酰胺、酵母提取物等),哥伦比亚血平板购自重庆庞通公司,磷酸盐缓冲液PBS(pH7.2~7.4),4%多聚甲醛,10%乙二胺四乙酸(EDTA),苏木精-伊红(HE)染色液(南京建成),肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和干扰素γ(IFN-γ)酶联免疫吸附检测(ELISA)试剂盒购自美国Biolengend公司。生物安全柜(Thermo,美国)、CO2孵箱(Thermo,美国)、细菌OD仪(BD,美国)、石蜡切片机(Leica RM2235,德国)病理组织摊烘仪(常州中威)、酶标仪(TECAN,美国)、正置显微镜(Nikon ECLIPSE 80i,日本)。
1.2 实验方法 1.2.1 细菌悬液制备将Spn 19F接种于哥伦比亚琼脂血平板,37 ℃、5% CO2孵箱培养12~16 h。挑取单个菌落接种于5 mL C+Y液体培养基中,孵箱培养至D(600)=0.4~0.5,4 ℃ 3 500×g离心5 min,弃上清集菌,PBS重悬细菌制备浓度约2×108 CFU(colony forming unit,CFU)/mL、2×109 CFU/mL菌液,置于冰上备用。
1.2.2 建模方法实验按随机数字表法将小鼠分为PR8+Spn感染组和单纯Spn感染组(n=4~6),PR8+Spn感染组先经滴鼻分别感染不同剂量PR8(20 μL/只),即44 800、5 600、1 400、550、140 TCID50,感染后第5天经听泡穿刺[8]接种Spn 19F(5 μL/耳)即107 CFU/耳或106 CFU/耳;单纯Spn感染组先用PBS(20 μL/只)滴鼻,在第5天时经听泡穿刺接种Spn 19F(5 μL/耳)。每日观察小鼠进食、运动等行为变化,记录小鼠体质量变化及生存情况。在确定PR8的合适剂量后研究PR8上呼吸道感染对继发Spn中耳炎的影响。按随机数字表法将96只小鼠分为4组:PR8+Spn感染组、单纯PR8感染组、单纯Spn感染组及PBS对照组(n=24),于建模后1、3、5、7 d分别收集中耳组织病理标本及中耳灌洗液(the middle ear lavage fluid,MELF)。
1.2.3 中耳组织切片HE染色建模后不同时间点麻醉处死小鼠,4%多聚甲醛心内灌注后,分离小鼠颅底组织(含双侧听泡),4%多聚甲醛固定过夜,10% EDTA脱钙3~4周,梯度脱水,石蜡包埋,水平位连续切片(厚6 μm),常规HE染色, 光镜观察中耳黏膜增生及炎症细胞浸润情况。
1.2.4 肺泡灌洗液(bronchoalveolar lavage fluid,BALF)获取及细胞计数暴露颈部气管进行插管,穿刺针插入气管上端,0.5 mL PBS反复冲洗,重复2遍,每遍冲洗次数根据需要决定,一般3~5次即可。回收的灌洗液4 ℃,500×g离心5 min,回收上清置于-80 ℃用于细胞因子检测。细胞沉淀用1 mL PBS重悬计数。
1.2.5 中耳灌洗液标本获取颈部正中纵向切口分离出小鼠两侧听泡,置于无菌石蜡膜上,手术显微镊将听泡纵向分开,无菌PBS浸润灌洗3次,每次40 μL,每只听泡收集120 μL左右MELF。吸取20 μL原液加入至80 μL无菌PBS中稀释后分别用于炎症细胞计数及细菌计数,剩余MELF标本4 ℃ 3 500×g离心5 min,吸取上清,-80 ℃冻存,用于细胞因子测定。
1.2.6 中耳灌洗液中细胞因子测定MELF上清经适当稀释后采用ELISA方法(双抗夹心法),按照Mouse Cytokines ELISA MAXTM Deluxe(Biolegend, 美国)试剂盒说明书操作,检测中耳灌洗液中TNF-α、IL-6、IFN-γ含量(pg/mL)。
1.3 统计学分析采用GraphPad Prism 5.0软件作图和统计分析,定量资料近似服从正态分布,采用非配对t检验,Log-rank检验比较生存率,P<0.05表示差异具有统计学意义。
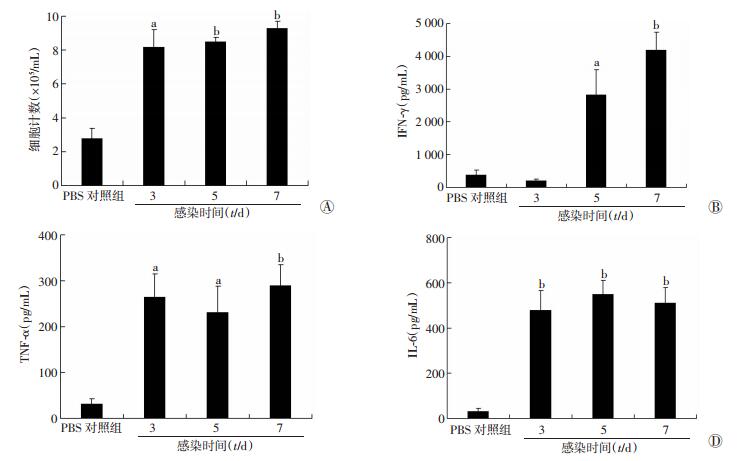
2 结果 2.1 流感病毒PR8感染后诱导肺部炎症通过给予C57BL/6小鼠滴鼻感染IAV模拟上呼吸道感染,建立IAV感染后继发性Spn感染性中耳炎模型,首先确定H1N1流感病毒株PR8(A/PuertoRico/8/1934)能够诱导肺部炎症,见图 1A,PR8感染后第3、5、7天肺泡灌洗液(BALF)中炎症细胞计数较PBS对照组明显增多(P<0.05)。此外BALF中细胞因子IFN-γ、TNF-α、IL-6水平明显升高(图 1B~D),IFN-γ于PR8感染后第5天开始升高明显(P<0.05)。结果表明流感病毒株PR8能够诱导肺部炎症,病毒感染后炎症细胞渗出和促炎细胞因子明显增加。
|
|
a:P<0.05, b:P<0.01, 与PBS对照组比较 A:肺泡灌洗液细胞计数;B:IFN-γ;C:TNF-α;D:IL-6 图 1 流感病毒(PR8)诱导小鼠肺部炎症细胞计数及炎症因子水平 |
2.2 不同剂量流感病毒对小鼠体质量及生存率的影响
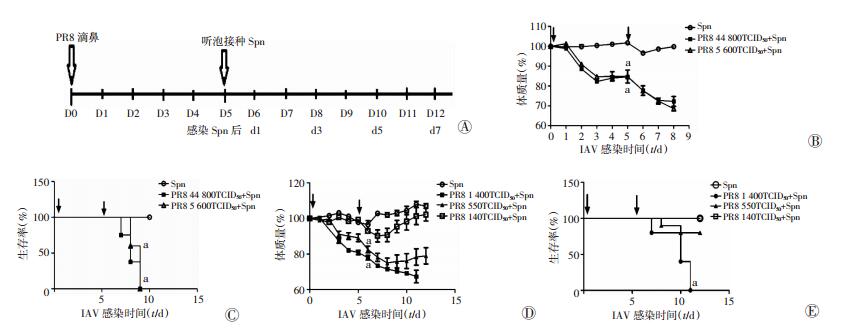
采用图 2A所示的模式建立共感染模型。不同剂量PR8与Spn共感染时小鼠体质量变化及生存率呈剂量依赖方式见图 2B、C。小鼠分别感染不同剂量PR8并继发感染高剂量Spn(107 CFU/耳)后体质量较单纯感染组明显下降(P<0.001),感染后第8天各组生存率分别为40%、66.67%,且感染后第9天全部死亡,而单纯Spn组无一例死亡。因高剂量PR8和Spn感染时小鼠死亡率太高,与实际临床资料不符,故降低PR8和Spn的剂量。结果如图 2D、E所示,小鼠分别感染1 400、550、140 TCID50流感后继发Spn(106 CFU/耳)感染,PR8为1 400 TCID50时第8天生存率为80%,但仍于感染后第11天全部死亡;PR8为550 TCID50时总死亡率为20%,与单纯Spn组差异无统计学意义(P= 0.30);PR8为140 TCID50时无一例死亡,与单纯感染组比较,体质量稍低,但差异无统计学意义(P>0.05)。因此,选择550 TCID50作为后续机制研究的合适剂量。
|
| A:流感感染后继发Sp感染性中耳炎模型建立的模式图;B、C:高剂量的病毒(44 800、5 600 TCID50)和Spn(107 CFU/耳)感染时小鼠体质量和生存率;D、E:病毒剂量1 400、550、140 TCID50继发感染Spn(106 CFU/耳)时小鼠体质量和生存率 a:P<0.01, 与Spn感染组比较 图 2 流感病毒PR8与Spn共感染中耳炎小鼠体质量变化及生存率 |
2.3 中耳腔炎症细胞募集过程
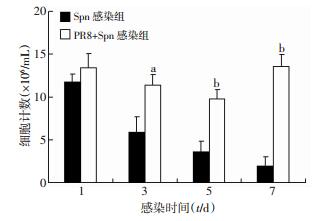
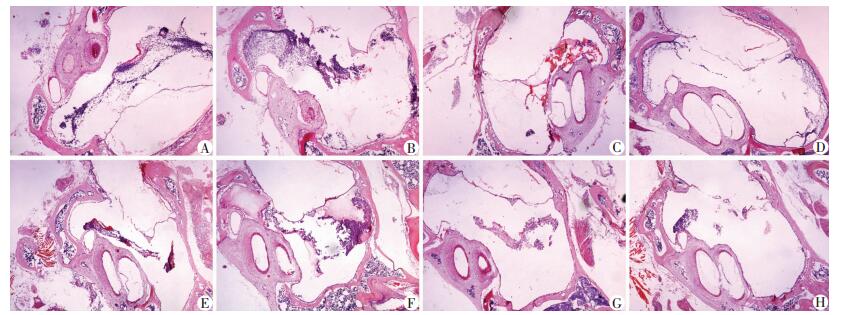
采用550 TCID50 PR8滴鼻感染C57BL/6小鼠建立IAV感染后继发Spn感染性中耳炎模型。于Spn感染后第1、3、5、7天计数中耳腔炎症细胞的数量,观察中耳病理改变。接种Spn后第1天,PR8+Spn感染组和单纯Spn感染组小鼠中耳腔中均有大量炎症细胞募集,并伴有大量渗出液,PR8+Spn小鼠第1天中耳腔炎症细胞计数较单纯Spn感染组差异无统计学意义(P= 0.40);随炎症进程,单纯Spn感染组小鼠3 d后中耳腔内炎症细胞逐渐消退,5 d后炎症细胞基本清除,而PR8+Spn感染组小鼠第3、5、7天后中耳腔炎症细胞持续存在且较单纯感染组明显增加(图 3、4)。这提示PR8预感染加重Spn中耳炎炎症细胞渗出及延迟中耳炎症细胞的消退,使炎症反应持续。
|
| a:P<0.05, b:P<0.01, 与Spn感染组比较 图 3 Spn感染后不同时间中耳腔炎症细胞计数的变化 |
|
| A~D:分别为Spn感染组第1、3、5、7天;E~H:分别为PR8+Spn感染组第1、3、5、7天 图 4 光镜观察Spn感染后中耳组织病理学改变 (HE ×400) |
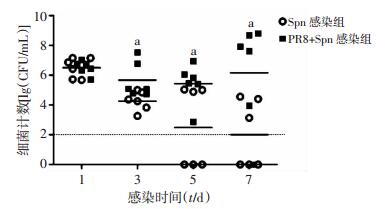
2.4 中耳灌洗液细菌计数
如图 5所示,PR8+Spn感染组第1天细菌计数与单纯Spn感染组差异无统计学意义(P>0.05),3 d后PR8+Spn感染组中耳灌洗液中细菌计数较单纯Spn感染组明显增多(P=0.03);单纯Spn感染组中耳灌洗液细菌于Spn感染后第5~7天基本清除;而PR8+Spn感染组大部分小鼠中耳灌洗液中细菌持续存在,仅少数完全清除(1/6只)。结果表明,流感预感染延迟中耳细菌清除。
|
| a:P<0.05, 与Spn感染组比较 图 5 Spn感染后中耳灌洗液细菌计数 |
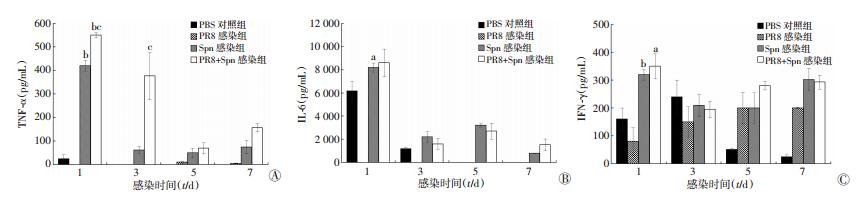
2.5 中耳灌洗液中细胞因子测定
小鼠听泡穿刺接种Spn后第1天,中耳灌洗液中TNF-α、IL-6、IFN-γ含量均显著升高,其中TNF-α和IL-6在感染后第3天时出现明显降低,这与之前观察到中耳腔内炎症变化过程相一致;而IFN-γ随时间进程变化不明显。与单纯Spn感染组相比,PR8+Spn感染组TNF-α在Spn感染后第1、3天显著增高(P<0.001);而IL-6、IFN-γ差异无统计学意义(P>0.05),提示TNF-α可能参与IAV感染后继发Spn感染性中耳炎的致病过程(图 6)。
|
| A:TNF-α;B:IL-6;C:IFN-γ a:P<0.05, b:P<0.01, 与PBS对照组比较;c:P<0.05, 与Spn感染组比较 图 6 各组小鼠中耳灌洗液中细胞因子水平 |
3 讨论
继发于上呼吸道病毒感染后的细菌性中耳炎是儿童最常见的感染性疾病之一[1, 5]。在过去的几十年里,经典的中耳炎动物模型对象是南美栗鼠。GIEBINK等[9]建立了流感感染后继发肺炎链球菌感染性中耳炎的南美栗鼠模型。但南美栗鼠存在价格昂贵,又无以其为遗传背景的基因缺陷动物限制了机制的深入研究。近年来,小鼠逐渐成为中耳炎机制研究时首选的实验动物模型。本课题组前期已分别采用鼓膜穿刺法[10]和听泡穿刺法[8]成功建立单纯细菌性中耳炎的C57BL/6小鼠模型。本研究拟在此基础上建立流感感染后继发肺炎链球菌感染性中耳炎的C57BL/6小鼠模型。
GIEBINK等[9]以先滴鼻感染Spn再滴鼻感染IAV的方式建立南美栗鼠继发感染Spn中耳炎模型;WREN等[11]以先滴鼻感染IAV再滴鼻感染Spn建立小鼠继发感染中耳炎模型。上述研究者虽模拟了经鼻咽部的自然感染途径,但中耳炎的发生率均较低,且进入中耳腔的细菌数量也不能保持均一,难以进行后续机制研究,目前上述方法已很少采用。TONG等[12]以先滴鼻感染IAV再鼓膜穿刺接种Spn建立了继发感染中耳炎小鼠模型,大大提高了中耳炎的发生率。但由于小鼠外耳道窄且曲折,不能应用普通规格的光纤电耳镜监测整个注射过程;另外在小鼠生长环境不够洁净时,建模后小鼠鼓膜上遗留的穿刺口可能成为外耳道中其他杂菌进入中耳腔增殖污染的通道。因此,本研究采用C57BL/6小鼠经鼻感染IAV模拟自然感染途径,再经听泡穿刺接种Spn建立继发感染中耳炎模型。本方法建模成功率100%,接种量准确,保持了听泡结构完整性,有效防止了杂菌污染及中耳渗液流失。
研究表明流感病毒滴度达峰或流感感染后3~6 d增加了中耳炎的发生率[13]。本研究结果也表明在IAV感染后第5天炎症细胞渗出和促炎细胞因子TNF-α、IL-6和IFN-γ均明显增加,故选择IAV预感染后第5天继发感染Spn建立IAV感染后继发Spn感染性中耳炎模型。结果发现,不同剂量流感病毒PR8预感染后继发Spn感染的小鼠体质量变化及生存率呈剂量依赖方式,继发Spn感染组体质量下降明显且死亡率增加,而单纯Spn感染组无一例死亡。当病毒剂量为550 TCID50时,虽然继发Spn感染组仍有死亡,但与单纯Spn感染组相比无显著差异,表明该病毒剂量可作为后续机制研究的合适剂量。在不同时间点,中耳灌洗液中炎症细胞的数量、细菌的载量与中耳腔内炎症反应变化基本一致,且继发Spn感染组较单纯感染组明显加重。表明成功建立了流感感染后继发性肺炎链球菌感染性中耳炎小鼠模型。此外,还观察到继发Spn感染组中耳灌洗液中TNF-α水平明显高于单纯感染组,提示TNF-α可能参与IAV感染后继发Spn感染性中耳炎的致病过程。
总之,本研究采用IAV滴鼻-Spn听泡穿刺注射方法成功建立了IAV感染后继发性Spn感染性中耳炎C57BL/6小鼠模型,为后续研究继发于上呼吸道病毒感染后的细菌性中耳炎致病机制奠定了实验基础。
| [1] | CHONMAITREE T, TRUJILLO R, JENNINGS K, et al. Acute otitis media and other complications of viral respiratory infection[J]. Pediatrics, 2016, 137(4): e20153555–e20153555. DOI:10.1542/peds.2015-3555 |
| [2] | SNOW J B, WACKYM P A, BALLENGER J J. Ballenger's otorhinolaryngology head and neck surgery[M]. BC Decker, 2008. |
| [3] | YATSYSHINA S, MAYANSKIY N, SHIPULINA O, et al. Detection of respiratory pathogens in pediatric acute otitis media by PCR and comparison of findings in the middle ear and nasopharynx[J]. Diagn Microbiol Infect Dis, 2016, 85(1): 125–130. DOI:10.1016/j.diagmicrobio.2016.02.010 |
| [4] | RUOHOLA A, MEURMAN O, NIKKARI S, et al. Microbiology of acute otitis media in children with tympanostomy tubes: prevalences of bacteria and viruses[J]. Clin Infect Dis, 2006, 43(11): 1417–1422. DOI:10.1086/509332 |
| [5] | NOKSO-KOIVISTO J, MAROM T, CHONMAITREE T. Importance of viruses in acute otitis media[J]. Curr Opin Pediatr, 2015, 27(1): 110–115. DOI:10.1097/MOP.0000000000000184 |
| [6] | MCCULLERS J A. Insights into the interaction between influenza virus and pneumococcus[J]. Clin Microbiol Rev, 2006, 19(3): 571–582. DOI:10.1128/CMR.00058-05 |
| [7] | HEIKKINEN T, BLOCK S L, TOBACK S L, et al. Effectiveness of intranasal live attenuated influenza vaccine against all-cause acute otitis media in children[J]. Pediatr Infect Dis J, 2013, 32(6): 669–674. DOI:10.1097/INF.0b013e3182840fe7 |
| [8] |
黄益飞, 金春芳, 项云, 等. 听泡穿刺注射法构建C57BL/6小鼠急性中耳炎模型[J].
中华耳鼻咽喉头颈外科杂志, 2015, 50(4): 318–323.
HUANG Y F, JIN C F, XIANG Y, et al. A mouse model for acute otitis media via transbullar injection[J]. Chin J Otorhinolaryngol Head Neck Surg, 2015, 50(4): 318–323. DOI:10.3760/cma.j.issn.1673-0860.2015.04.011 |
| [9] | GIEBINK G S, BERZINS I K, Marker S C, et al. Experimental otitis media after nasal inoculation of Streptococcus pneumoniae and influenza A virus in chinchillas[J]. Infect Immun, 1980, 30(2): 445–450. |
| [10] |
周爱娥, 王维, 项云, 等. 小鼠急性中耳炎模型的建立[J].
激光杂志, 2013, 34(4): 105–106, 109.
ZHOU A E, WANG W, XIANG Y, et al. A mouse model of acute otitis media[J]. Laser J, 2013, 34(4): 105–106, 109. DOI:10.3969/j.issn.0253-2743.2013.04.048 |
| [11] | WREN J T, BLEVINS L K, PANG B, et al. Influenza a virus alters pneumococcal nasal colonization and middle ear infection independently of phase variation[J]. Infect Immun, 2014, 82(11): 4802–4812. DOI:10.1128/iai.01856-14 |
| [12] | TONG H H, LAMBERT G, LI Y X, et al. Deletion of the complement C5a receptor alleviates the severity of acute pneumococcal otitis media following influenza a virus infection in mice[J]. PLoS ONE, 2014, 9(4): e95160. DOI:10.1371/journal.pone.0095160 |
| [13] | MINA M J, KLUGMAN K P. The role of influenza in the severity and transmission of respiratory bacterial disease[J]. Lancet Respir Med, 2014, 2(9): 750–763. DOI:10.1016/S2213-2600(14)70131-6.-6 |



