胃癌(gastric cancer, GC)是常见的消化系统肿瘤,在我国发病率接近30%[1-2]。由于胃癌早期发病症状不太明显,确诊时已发展为晚期,细胞的侵袭和转移能力明显,预后差,5年生存率不足20%[3-4]。近年来,随着分子生物学的不断发展,虽然胃癌的发病率和病死率显著降低,但仍然是癌症死亡的第三大原因[5]。手术结合药物化疗是目前临床上治疗胃癌的主要手段,但是复发率较高,药物治疗的并发症较多。双氢青蒿素(dihydroartemisinin, DHA)是一种半合成的青蒿素衍生物,具有抗肿瘤的作用[6-7]。有研究发现,DHA能抑制卵巢癌SKOV3细胞的增殖,诱导细胞凋亡[8]。最新研究表明,DHA能够通过激活JNK1/2和p38 MAPK通路促进胃癌细胞的凋亡,提示DHA对胃癌具有一定的抗癌活性[9]。本实验采用不同浓度的DHA作用于BGC-823和SGC-7901细胞,观察DHA对胃癌细胞BGC-823和SGC-7901增殖、侵袭、迁移和凋亡能力及Wnt/β-catenin通路的影响,进一步探讨DHA可能的作用机制,旨在为临床上DHA抗肿瘤治疗提供一定的实验依据。
1 材料与方法 1.1 主要试剂与材料人胃癌BGC-823和SGC-7901细胞(中国科学院上海细胞生物研究所),胎牛血清、新生小牛血清和胰蛋白酶(美国HyClone公司),青霉素/链霉素(北京鼎国昌盛生物技术公司),DMEM培养基和RPMI1640培养基(美国Gibco-BRL公司),BCA法蛋白浓度测定试剂盒(碧云天公司),AV939、兔抗人Dvl2、GSK-3β、p-GSK-3β、β-catenin和Cyclin D1抗体(美国Sigma公司),鼠抗人GAPDH单克隆抗体(武汉博士德生物工程有限公司),SKL2001(Millipore公司),HRP标记的羊抗兔IgG和羊抗鼠IgG(美国CST公司),DHA(奥伦生物公司)。
1.2 细胞培养与分组常规使用含10%胎牛血清和双抗(青霉素100 U/L,链霉素100 mg/L)的DMEM培养液(胃癌BGC-823细胞)和RPMI1640培养液(胃癌SGC-7901细胞),在37 ℃,5%CO2的饱和湿度恒温培养箱中培养,隔天换液。用无血清的DMEM/RPMI1640培养基将DHA稀释成不同的浓度:10 μmol/L(低浓度)、20 μmol/L(中浓度)及40 μmol/L(高浓度)。将BGC-823和SGC-7901细胞分为低剂量组、中剂量组、高剂量组和空白对照组,将对数生长期的细胞接种至6孔板,1×105/孔,当细胞汇合度达70%~80%,实验组加入3种浓度的DHA溶液,空白对照组加入等量无血清的DMEM/RPMI1640培养基,Wnt抑制剂组加入高浓度DHA和XAV939(1 μmol/L),Wnt激动剂组加入高浓度DHA和SKL2001(20 μmol/L),每组重复设置5个孔。
1.3 MTT法检测细胞增殖活力取对数生长期的BGC-823和SGC-7901细胞,以5×103/孔接种到96孔板中,细胞贴壁后,加入不同浓度的DHA(10、20、40 μmol/L)分别孵育24、48、72 h后,移去含DHA的培养基,加入10 μL/孔MTT(5 mg/mL)于37 ℃孵育4 h,弃去上清,每孔加入150 μL DMSO,用酶标仪测定各孔在570 nm波长的光密度值[D(570)],每个样本设置3个复孔。
1.4 划痕实验检测细胞迁移将对数生长期的胃癌细胞以2×105/孔接种到提前在底部画好刻度的6孔板,当细胞汇合度达到95%时,移去培养基,用已消毒的10 μL枪头垂直划一条泳道,用PBS洗涤2次后,在显微镜下拍照,记录0 h细胞泳道的距离。然后加入不同浓度的含无血清培养基DHA,培养48 h后,在显微镜下观察细胞迁移情况,拍照,每组细胞随机选取5处划痕位置测量宽度。细胞相对迁移能力=(0 h划痕距离-48 h划痕距离)/0 h划痕距离×40%。
1.5 Transwell实验检测细胞侵袭用Matrigel包被Transwell小室基底膜上室面,室温过夜。取在对数生长期的胃癌细胞,经胰酶消化后,1×105/孔于24孔板Transwell中,Transwell小室的上室加入200 μL含不同DHA浓度的无血清培养基,在Transwell下室加入600 μL 15%胎牛血清的DEMR/RPMI1640培养基。常规培养48 h后,4%多聚甲醛固定10 min,用PBS清洗2次,甲醇透化5 min,加入1%结晶紫染色液染色5 min,PBS洗涤2遍,在显微镜下观察细胞并计数。
1.6 流式细胞仪检测细胞周期取对数生长期的胃癌细胞,以3×105/孔接种于6孔板,用不同浓度的DHA作用于胃癌细胞48 h,胰酶消化收集细胞,PBS洗涤后制备成细胞悬液,加入预冷的70%乙醇,4 ℃固定过夜。加入PBS洗涤2次后弃上清,加入PI工作液,室温下避光孵育30 min后,流式细胞仪检测细胞周期。
1.7 流式细胞仪检测细胞凋亡不同浓度的DHA孵育胃癌细胞(3×105/孔)48 h后,用预冷的PBS洗涤2次,加入10 μL Annexin V-FITC和5 μL碘化丙啶染色液(0.25 mg/mL),轻轻混匀,室温避光孵育20 min,流式细胞仪检测细胞凋亡。
1.8 RT-PCR检测Wnt/β-catenin相关蛋白的表达不同浓度的DHA溶液处理胃癌细胞48 h后,常规收集胃癌细胞,并按照TRIzol试剂盒步骤提取细胞中总RNA,以β-actin为内参,qRT-PCR按照SYBR Green试剂盒说明书进行反应体系的配制,检测Dvl2、GSK-3β、β-catenin和Cyclin D1在细胞中的表达水平。PCR引物均采用Primer5软件设计,并由宝生物工程(大连)有限公司合成。Dvl2引物序列为5′-AGGATACCACCCTTCCGTTG-3′(正义链)和5′-GGCGCCAAGTACTTTTTCAA-3′(反义链),扩增片段大小为109 bp;GSK-3β引物序列为5′-GACGCTCCCTGTGATTTATGTC-3′(正义链)和5′-GTTAGTCGGGCAGTTGGTGTAT-3′(反义链),扩增片段大小为537 bp;β-catenin引物序列为5′-CGGTACATGCATGACTGAGAC-3′(正义链)和5′-GTCACGTGGTACGACGTCAGAT-3′(反义链),扩增片段大小为310 bp;Cyclin D1引物序列为5′-GAGTAGTGCGAAGCATAGGTCT-3′(正义链)和5′-CTAGCACGAGTAGTCGAGCGC-3′(反义链),扩增片段大小为455 bp。β-actin引物序列为5′-ACGAGACCIACCTTCAACTCCATC-3′(正义链)和5′-TAGAAGCATTTGCGGTGGACGA-3′(反义链),扩增片段大小为304 bp。
1.9 Western blot检测Wnt/β-catenin相关蛋白的表达不同浓度的DHA溶液处理胃癌细胞48 h后,常规收集胃癌细胞,用RIPA裂解液裂解细胞后离心,取上清液,用BCA试剂盒测定蛋白浓度。在SDS-PAGE凝胶中,每个泳道加入40 μg的蛋白样品,110 V电泳分离蛋白,电转至PVDF膜,5%脱脂奶粉室温封闭1 h,然后将条带分别加入Dvl2、GSK-3β、p-GSK-3β、β-catenin和Cyclin D1一抗液中,4 ℃孵育过夜,TBST洗膜3×10 min,二抗37 ℃孵育2 h,TBST洗膜3×30 min,ECL显影。运用Quantity One软件分析目的蛋白条带与β-actin灰度比值,计算相对表达量。
1.10 统计学分析计量资料以x±s表示,采用SPSS 21.0统计软件进行组间单因素方差分析,检验水准α=0.05。
2 结果 2.1 DHA抑制胃癌细胞的增殖用不同浓度的DHA刺激BGC-823和SGC-7901细胞24、48、72 h,细胞增殖活性明显下降,与空白对照组比较,DHA可显著抑制胃癌细胞的增殖,且随着作用时间和作用浓度的增加,细胞增殖抑制率逐渐增加(P<0.05),见图 1。
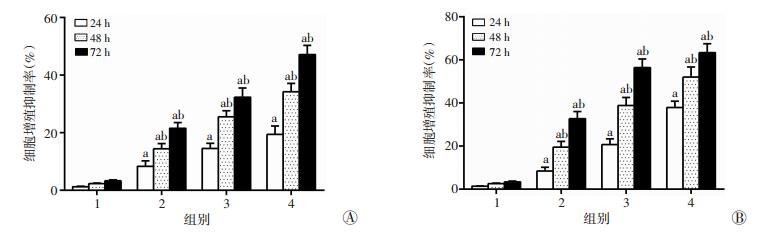
|
| 1:空白对照组;2:DHA低剂量组;3:DHA中剂量组;4:DHA高剂量组;a:P<0.05,与空白对照组比较;b:P<0.05,与24 h比较 图 1 DHA作用不同时间对BGC-823(A)和SGC-7901(B)细胞增殖的影响 |
2.2 DHA对胃癌细胞周期的影响
DHA对胃癌细胞周期的影响见图 2。与空白对照组比较,DHA能够增加S期细胞比例,减少G2/M期细胞比例(P<0.05)。这提示DHA可将BGC-823和SGC-7901细胞阻滞在S期。

|
| A:流式细胞术检测DHA对BGC-823和SGC-7901细胞周期的影响;B、C:分别为DHA对BGC-823(B)和SGC-7901(C)细胞周期的影响 1:空白对照组;2:DHA低剂量组;3:DHA中剂量组;4:DHA高剂量组;a:P<0.05,与空白对照组比较 图 2 DHA对BGC-823和SGC-7901细胞周期的影响 |
2.3 DHA诱导胃癌细胞凋亡
流式细胞术检测细胞凋亡情况见图 3。不同剂量的DHA能明显促进人胃癌BGC-823和SGC-7901细胞的凋亡,随着DHA剂量的增加,细胞凋亡率明显增加,与空白对照组比较,差异有统计学意义(P<0.05)。
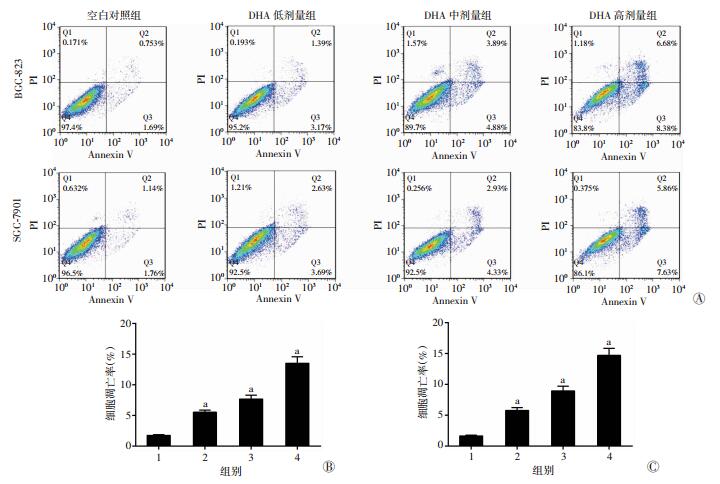
|
| A:流式细胞术检测DHA对BGC-823和SGC-7901细胞凋亡的影响;B、C:分别为DHA对BGC-823(B)和SGC-7901(C)细胞凋亡率的影响 1:空白对照组;2:DHA低剂量组;3:DHA中剂量组;4:DHA高剂量组;a:P<0.05,与空白对照组比较 图 3 DHA对BGC-823和SGC-7901细胞凋亡的影响 |
2.4 DHA抑制胃癌细胞的侵袭和迁移
Transwell侵袭实验结果显示,低、中、高3个不同浓度的DHA作用于胃癌细胞48 h后,显著降低了胃癌细胞侵袭的数量(P<0.05,图 4A),且DHA抑制胃癌细胞的侵袭能力呈一定的浓度依赖性。划痕实验结果显示,在细胞划痕48 h后,与空白对照组比较,DHA组细胞的划痕愈合速度显著变慢(P<0.05,图 4B)。提示DHA可以抑制BGC-823和SGC-7901细胞的侵袭和迁移能力。
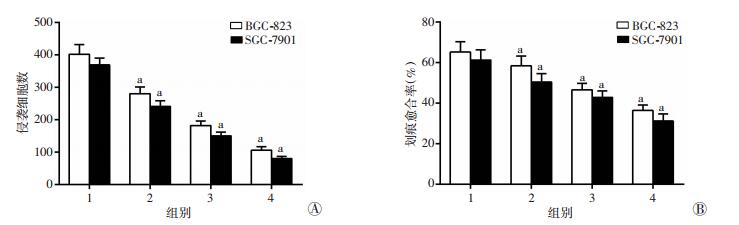
|
| 1:空白对照组;2:DHA低剂量组;3:DHA中剂量组;4:DHA高剂量组;a:P<0.05,与空白对照组比较 图 4 DHA对BGC-823和SGC-7901细胞侵袭(A)和迁移(B)的影响 |
2.5 DHA对胃癌细胞Dvl2、GSK-3β、β-catenin和Cyclin D1 mRNA表达量的影响
低、中、高3个不同浓度的DHA作用于胃癌细胞48 h后,采用RT-PCR检测Dvl2、GSK-3β、β-catenin和Cyclin D1 mRNA的表达量,结果见图 5。与空白对照组比较,DHA组BGC-823和SGC-7901细胞Dvl2、β-catenin和Cyclin D1 mRNA的表达量明显降低(P<0.05),同时GSK-3β mRNA的表达量较空白对照组升高(P<0.05)。

|
| 1:空白对照组;2:DHA低剂量组;3:DHA中剂量组;4:DHA高剂量组;a:P<0.05,与空白对照组比较 图 5 RT-PCR检测各组BGC-823(A)和SGC-7901(B)细胞中Wnt/β-catenin相关蛋白的表达 |
2.6 DHA对胃癌细胞Dvl2、GSK-3β、p-GSK-3β、β-catenin和Cyclin D1蛋白表达量的影响
低、中、高3个不同浓度的DHA作用于胃癌细胞48 h后,采用Western blot进一步检测Dvl2、GSK-3β、p-GSK-3β、β-catenin和Cyclin D1蛋白的表达量,结果见图 6。与空白对照组比较,DHA组BGC-823和SGC-7901细胞Dvl2、p-GSK-3β、β-catenin和Cyclin D1蛋白的表达量明显降低(P<0.05),同时GSK-3β蛋白的表达量较空白对照组升高(P<0.05),进一步说明DHA作用于胃癌细胞后导致GSK-3β的磷酸化水平降低。
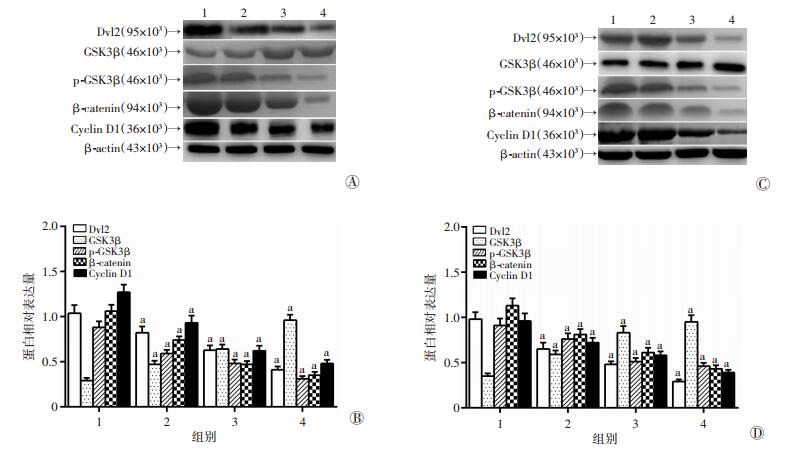
|
| 1:空白对照组;2:DHA低剂量组;3:DHA中剂量组;4:DHA高剂量组;a:P<0.05,与空白对照组比较; A、B: BGC-823细胞Western blot检测蛋白表达及半定量分析结果;C、D: SGC-7901细胞Western blot检测蛋白表达及半定量分析结果 图 6 Western blot检测各组BGC-823和SGC-7901细胞中Wnt/β-catenin相关蛋白的表达 |
2.7 阻断或激活Wnt/β-catenin信号通路后DHA对胃癌细胞侵袭和迁移的影响
进一步研究DHA通过抑制Wnt/β-catenin信号通路激活参与胃癌细胞的侵袭和迁移,采用XAV939抑制和SKL2001激活Wnt/β-catenin信号通路。Transwell侵袭实验结果(图 7A)显示,SKL2001激活Wnt/β-catenin信号通路后,高浓度DHA作用于胃癌细胞,胃癌细胞侵袭的数量与空白对照组比较未见明显差异(P>0.05),而XAV939抑制Wnt/β-catenin信号通路后,DHA对胃癌细胞侵袭的数量进一步增加。划痕实验结果(图 7B)显示,SKL2001激活Wnt/β-catenin信号通路后,能够明显抑制DHA对划痕愈合速度减慢的影响(P<0.05),而XAV939抑制Wnt/β-catenin信号通路后,进一步减慢了划痕愈合速度。提示DHA可能是通过调节相应靶蛋白的表达抑制Wnt/β-catenin信号通路的激活,从而抑制胃癌BGC-823和SGC-7901细胞的侵袭和迁移。

|
| 1:空白对照组;2:DHA+SKL2001组;3:DHA+XAV939组;4:DHA高剂量组;a:P<0.05,与空白对照组比较 图 7 阻断或激活Wnt/β-catenin信号通路后DHA对各组胃癌细胞侵袭(A)和迁移(B)的影响 |
3 讨论
越来越多的研究表明,青蒿素(artemisinin,ART)通过诱导细胞凋亡、抗血管生成、氧化应激等途径发挥抗肿瘤的作用[10-11]。YAMACHIKA等[12]研究发现ART通过诱导肿瘤细胞凋亡抑制肿瘤,与常规的药物相比,具有一定的选择性。双氢青蒿素(DHA)是从中草药青蒿素中分离出来的衍生物和活性代谢物,可以与亚铁原子发生反应,引起DHA过氧桥断裂而生成细胞内活性氧代谢产物,诱导肿瘤细胞发生氧化损伤[13-14]。最新研究表明,DHA也可能是一个潜在的化学预防药物,在多种人类肿瘤细胞,通过抑制细胞增殖、阻滞细胞周期、诱导细胞凋亡、抑制血管生成和转移等途径发挥抗肿瘤的作用[15-17]。
Wnt/β-catenin信号通路在进化上高度保守,参与调节细胞增殖、细胞极性和细胞黏附等多种细胞活动[18]。大量的研究发现,Wnt/β-catenin信号通路对结直肠癌、乳腺癌、肝癌等恶性肿瘤细胞的发生、发展起着关键性的作用[19-21]。癌症细胞中Wnt/β-catenin信号通路的异常激活与Wnt蛋白的异常表达、β-catenin蛋白的核转移等有关。在细胞核中,β-catenin蛋白与T细胞因子结合,促进靶基因的转录,激活下游基因,促进肿瘤细胞的增殖,抑制细胞凋亡。王文娟等[22]研究发现,DHA可以通过阻断Wnt/β-catenin信号通路抑制骨肉瘤细胞的增殖和侵袭。HUI等[23]的研究结果显示,DHA通过靶向作用Wnt/β-catenin信号通路抑制皮肤癌鳞状A431细胞的生长,促进Caspase-3蛋白的表达水平,降低Survivin蛋白的表达水平。同时多项研究表明Wnt/β-catenin信号通路在胃癌的发生、发展中发挥着重要作用[24-25]。Wnt蛋白是一种细胞生长的信号因子,可以作用于Frz蛋白,在LRP蛋白的作用下,激活细胞内的Dvl蛋白,诱导细胞内的信号转导,使GSK-3β发生磷酸化并抑制其活性,进而抑制β-catenin的降解,使得β-catenin蓄积。β-catenin蛋白在细胞连接处与E-cadherin形成黏附复合物,增加细胞间的黏附作用。胞质中游离的β-catenin转入细胞核,进一步激活下游Cyclin D1等靶基因的转录,使细胞的增殖和迁移能力增加。这些靶基因参与调控肿瘤的发生、发展和转移等过程。有研究表明,肺癌患者的β-catenin表达量越高,肿瘤的恶性程度和侵袭能力越高强,预后越差[26]。
BGC-823为一种低分化的胃腺癌细胞系,SGC-7901为一种中分化胃癌细胞系,在本研究中采用不同浓度的DHA处理BGC-823和SGC-7901细胞发现,DHA可以抑制胃癌细胞的增殖抑制率、侵袭细胞数、迁移愈合率,S期细胞比例呈浓度依赖性增加。在其他研究中也显示DHA对胃癌细胞增殖和侵袭的抑制作用,与本研究具有相近结果[9, 27]。在进一步机制性研究中,RT-PCR结果显示DHA能够抑制Dvl2、β-catenin和Cyclin D1 mRNA的表达,同时促进GSK-3β mRNA的表达量。Western blot结果显示DHA下调Dvl2、p-GSK-3β、β-catenin和Cyclin D1蛋白的表达,上调GSK-3β蛋白的表达。在Wnt/β-catenin信号通路中,GSK-3β可以抑制β-catenin蛋白而抑制细胞的增殖,而p-GSK-3β可以抑制GSK-3β的活性促进增殖。因此,DHA可能通过抑制Dvl2而减少GSK-3β磷酸化,进而抑制β-catenin和Cyclin D1来减少胃癌细胞增殖、侵袭和迁移。为进一步验证DHA通过Wnt/β-catenin信号通路发挥作用,采用XAV939和SKL2001抑制和激活Wnt/β-catenin信号通路,结果显示SKL2001激活Wnt/β-catenin信号通路可以逆转DHA对胃癌细胞迁移和侵袭的抑制作用,XAV939抑制Wnt/β-catenin信号通路可以进一步加强DHA对胃癌细胞迁移和侵袭的抑制作用。这说明DHA可能是通过调节相应靶蛋白的表达抑制Wnt/β-catenin信号通路的激活,从而抑制胃癌BGC-823和SGC-7901细胞的增殖、侵袭和迁移。
总之,DHA可以通过调节相应靶蛋白的表达抑制Wnt/β-catenin信号通路的激活,从而抑制胃癌BGC-823和SGC-7901细胞的增殖、侵袭和迁移。DHA具有广泛的抗肿瘤作用,毒副作用小,可能是胃癌临床治疗的潜在替代药物,为胃癌的药物治疗开辟新的途径。
| [1] | LYU Z K, LI C L, JIN Y, et al. Paeonol exerts potential activities to inhibit the growth, migration and invasion of human gastric cancer BGC823 cells via downregulating MMP-2 and MMP-9[J]. Mol Med Rep, 2017, 16(5): 7513–7519. DOI:10.3892/mmr.2017.7576 |
| [2] | FITZMAURICE C, DICKER D, PAIN A, et al. The global burden of cancer 2013[J]. JAMA Oncol, 2015, 1(4): 505–527. DOI:10.1001/jamaoncol.2015.0735 |
| [3] | FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [4] | NAGINI S. Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention[J]. World J Gastrointest Oncol, 2012, 4(7): 156–169. DOI:10.4251/wjgo.v4.i7.156 |
| [5] | HSU K W, FANG W L, HUANG K H, et al. Notch1 pathway-mediated microRNA-151-5p promotes gastric cancer progression[J]. Oncotarget, 2016, 7(25): 38036–38051. DOI:10.18632/oncotarget.9342 |
| [6] | JIN H, JIANG A Y, WANG H, et al. Dihydroartemisinin and gefitinib synergistically inhibit NSCLC cell growth and promote apoptosis via the Akt/mTOR/STAT3 pathway[J]. Mol Med Rep, 2017, 16(3): 3475–3481. DOI:10.3892/mmr.2017.6989 |
| [7] | ZHANG T, HU Y, WANG T, et al. Dihydroartemisinin inhibits the viability of cervical cancer cells by upregulating caveolin 1 and mitochondrial carrier homolog 2: Involvement of p53 activation and NAD(P)H:quinone oxidoreductase 1 downregulation[J]. Int J Mol Med, 2017, 40(1): 21–30. DOI:10.3892/ijmm.2017.2980 |
| [8] | ZHAO J, PAN Y, LI X, et al. Dihydroartemisinin and curcumin synergistically induce apoptosis in SKOV3 cells via upregulation of MiR-124 targeting midkine[J]. Cell Physiol Biochem, 2017, 43(2): 589–601. DOI:10.1159/000480531 |
| [9] | ZHANG S, SHI L, MA H, et al. Dihydroartemisinin induces apoptosis in human gastric cancer cell line BGC-823 through activation of JNK1/2 and p38 MAPK signaling pathways[J]. J Recept Signal Transduct Res, 2017, 37(2): 174–180. DOI:10.1080/10799893.2016.1203942 |
| [10] | DAS A K. Anticancer effect of antimalarial artemisinin compounds[J]. Ann Med Health Sci Res, 2015, 5(2): 93–102. DOI:10.4103/2141-9248.153609 |
| [11] | CRESPO-ORTIZ M P, WEI M Q. Antitumor activity of artemisinin and its derivatives: from a well-known antimalarial agent to a potential anticancer drug[J]. J Biomed Biotechnol, 2012, 2012: 247597. DOI:10.1155/2012/247597 |
| [12] | YAMACHIKA E, HABTE T, ODA D. Artemisinin: an alternative treatment for oral squamous cell carcinoma[J]. Anticancer Res, 2004, 24(4): 2153–2160. |
| [13] | ZHANG X G, LI G X, ZHAO S S, et al. A review of dihydroartemisinin as another gift from traditional Chinese medicine not only for malaria control but also for schistosomiasis control[J]. Parasitol Res, 2014, 113(5): 1769–1773. DOI:10.1007/s00436-014-3822-z |
| [14] | ZHANG Z, GUO M, ZHAO S, et al. ROS-JNK1/2-dependent activation of autophagy is required for the induction of anti-inflammatory effect of dihydroartemisinin in liver fibrosis[J]. Free Radic Biol Med, 2016, 101: 272–283. DOI:10.1016/j.freeradbiomed.2016.10.498 |
| [15] | ZHANG C Z, ZHANG H, YUN J, et al. Dihydroartemisinin exhibits antitumor activity toward hepatocellular carcinoma in vitro and in vivo[J]. Biochem Pharmacol, 2012, 83(9): 1278–1289. DOI:10.1016/j.bcp.2012.02.002 |
| [16] | LIN R, ZHANG Z, CHEN L, et al. Dihydroartemisinin (DHA) induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells[J]. Cancer Lett, 2016, 381(1): 165–175. DOI:10.1016/j.canlet.2016.07.033 |
| [17] | LIU Y, WANG W, XU J, et al. Dihydroartemisinin inhibits tumor growth of human osteosarcoma cells by suppressing Wnt/beta-catenin signaling[J]. Oncol Rep, 2013, 30(4): 1723–1730. DOI:10.3892/or.2013.2658 |
| [18] | MOHAMMED M K, SHAO C, WANG J, et al. Wnt/β-catenin signaling plays an ever-expanding role in stem cell self-renewal, tumorigenesis and cancer chemoresistance[J]. Genes Dis, 2016, 3(1): 11–40. DOI:10.1016/j.gendis.2015.12.004 |
| [19] | CAO J, YAN X R, LIU T, et al. MicroRNA-552 promotes tumor cell proliferation and migration by directly targeting DACH1 via the Wnt/beta-catenin signaling pathway in colo-rectal cancer[J]. Oncol Lett, 2017, 14(3): 3795–3802. DOI:10.3892/ol.2017.6600 |
| [20] | ZHENG Y, TRIVEDI T, LIN R C, et al. Loss of the vitamin D receptor in human breast and prostate cancers strongly induces cell apoptosis through downregulation of Wnt/beta-catenin signaling[J]. Bone Res, 2017, 5: 17023. DOI:10.1038/boneres.2017.23 |
| [21] | TAN Z, ZHENG H, LIU X, et al. MicroRNA-1229 over-expression promotes cell proliferation and tumorigenicity and activates Wnt/beta-catenin signaling in breast cancer[J]. Oncotarget, 2016, 7(17): 24076–24087. DOI:10.18632/oncotarget.8119 |
| [22] |
王文娟, 赵丹, 徐静, 等. 双氢青蒿素通过阻断Wnt/β-catenin信号抑制骨肉瘤细胞系体外增殖和侵袭[J].
基础医学与临床, 2014, 34(8): 1017–1022.
WANG W J, ZHAO D, XU J, et al. Dihydroartemisinin(DHA) inhibits proliferation and invasion of osteosarcoma cell line in vitro by suppressing Wnt/β-catenin signaling[J]. Basic Clin Med, 2014, 34(8): 1017–1022. DOI:10.3969/j.issn.1001-6325.2014.08.001 |
| [23] | HUI H Y, WU N, WU M, et al. Dihydroartemisinin suppresses growth of squamous cell carcinoma A431 cells by targeting the Wnt/beta-catenin pathway[J]. Anticancer Drugs, 2016, 27(2): 99–105. DOI:10.1097/CAD.0000000000000307 |
| [24] | YUE H, TANG B, ZHAO Y, et al. MIR-519d suppresses the gastric cancer epithelial-mesenchymal transition via Twist1 and inhibits Wnt/beta-catenin signaling pathway[J]. Am J Transl Res, 2017, 9(8): 3654–3664. |
| [25] | MAO J, LIANG Z, ZHANG B, et al. UBR2 enriched in p53 deficient mouse bone marrow mesenchymal stem cell-exosome promoted gastric cancer progression via Wnt/beta-catenin pathway[J]. Stem Cells, 2017, 35(11): 2267–2279. DOI:10.1002/stem.2702 |
| [26] | JIN J, ZHAN P, KATOH M, et al. Prognostic significance of β-catenin expression in patients with non-small cell lung cancer: a meta-analysis[J]. Transl Lung Cancer Res, 2017, 6(1): 97–108. DOI:10.21037/tlcr.2017.02.07 |
| [27] | SUN H, MENG X, HAN J, et al. Anti-cancer activity of DHA on gastric cancer-an in vitro and in vivo study[J]. Tumour Biol, 2013, 34(6): 3791–3800. DOI:10.1007/s13277-013-0963-0 |



