原发性肝癌(hepatocellularmcarcinoma, HCC)死亡率较高,每年死亡约100万人[1],归因于早期诊断失败、缺乏有效的治疗和复发[2-3]。慢性乙型肝炎病毒(hepatitis B Virus, HBV)感染是HCC发展的重要原因之一。研究数据表明,乙肝病毒X(hepatitis B virus X,HBx)可以诱导肿瘤抑制基因和致癌基因的遗传改变从而促进肝癌发生,然而其作用机制尚不清楚[4-5]。肝前体细胞(hepatic progenitor cells, HPCs)是一类具有干细胞特性的细胞,具有多向分化的潜能,也可以分化为肝癌的起始细胞即肝癌干细胞。这提示HBx导致肝癌发生的起源细胞可能是HPCs,为研究HBx提供了新的思路。课题组前期相关研究显示,HBx能够在体外抑制小鼠肝前体细胞的分化,延长细胞周期的S期,降低HPCs的凋亡率[6-7]。因此,本研究在前期课题组的基础上[8-9],利用慢病毒为载体,构建稳定表达HBx基因与空载体的肝前体细胞株,通过小鼠肝门静脉注射细胞株,绿色荧光蛋白作为追踪剂,观察目的基因HBx在小鼠肝脏体内的表达和对肝前体细胞凋亡与分化的影响,研究HBx基因干预肝癌发生的早期事件,以期为研究治疗肝癌早期作用靶点的生物制剂奠定实验基础。
1 材料与方法 1.1 材料 1.1.1 细胞及小鼠小鼠肝前体细胞株14-19由美国芝加哥分子肿瘤研究中心馈赠,空载体14-19(negative control-14-19, NC-14-19)稳定感染慢病毒细胞株,HBx-14-19稳定感染慢病毒细胞株由课题组构建并保存,无特殊病原体(specific pathogen free, SPF)级昆明小鼠由重庆医科大学动物中心提供。
1.1.2 主要试剂DMEM培养基(HyClone),FBS胎牛血清(CELL BOX),免疫组化SP试剂盒及DAB显色液试剂盒(北京中杉金桥生物技术有限公司),兔抗小鼠HBx抗体、兔抗小鼠β-actin抗体、兔抗小鼠Bcl2抗体、兔抗小鼠Bax抗体、兔抗小鼠mcl-1抗体、兔抗小鼠caspase-3抗体(北京博奥森生物技术有限公司),超纯总RNA提取试剂盒(北京康为世纪生物科技有限公司),RT-PCR试剂盒、SYBR® Premix Ex TaqTM实时荧光定量试剂盒(大连宝生物公司),TUNEL-FITC绿色荧光标记原位凋亡检测试剂盒(Roche)。
1.2 方法 1.2.1 细胞的培养及稳定感染细胞株的构建细胞接种于含15%的胎牛血清,1%双抗的DMEM培养基中,于培养箱中培养(37 ℃,5%CO2),待细胞汇合达80%以上,进行常规的传代、冻存及后续实验。构建稳定感染慢病毒的细胞株方法如下:将14-19细胞接种于12孔板中,待细胞贴壁后,分别加入梯度的慢病毒载体,设置梯度为1、2、3、4、5、6、7、8 μL, 分别于24、48、72 h在荧光显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP)的表达量,当GFP表达量达到90%以上时,将细胞转入培养瓶中,加入嘌呤霉素(2 μg/mL)筛选稳定表达的细胞株。1周后,当GFP表达量达到99%以上后,嘌呤霉素筛选浓度减半,继续培养细胞,2周不加嘌呤霉素,进行细胞常规培养,传3代后进行目的基因的检测。
1.2.2 动物模型构建及分组选取6~8周龄雄性昆明小鼠36只,体质量(20±2)g,按随机数字表法分为3组:生理盐水组(NS组)、NC-14-19组和HBx-14-19组,每组12只。分别从肝门静脉注射生理盐水200 μL及NC-14-19、HBx-14-19细胞(注射量为5×105个,溶于200 μL PBS中)。小鼠术前禁食,称量,腹腔注射4%水合氯醛(10 g/0.1 mL), 小鼠麻醉后,剑突下行2 cm纵向切口,暴露肝脏后,轻柔挑起肝门静脉,用血管夹轻夹门静脉远端,于近端缓慢注射,完毕后,用干棉球按压止血,待确认无出血后关闭腹腔,最后缝合。术后观察生命现象,每组分别于30、60、90、120 d取3只小鼠新鲜肝前体细胞,剪取一部分新鲜肝组织浸泡于4%多聚甲醛中,用于石蜡包埋,部分储存于液氮中,用于后续实验。
1.2.3 免疫组化法取3组小鼠新鲜肝组织(1.0 cm×1.0 cm×1.0 cm),浸泡于4%多聚甲醛48 h后,行常规石蜡包埋, 烘片后,采用S-P法检测,按照供应商提供的说明书进行实验。一抗HBx工作浓度为1:200,显微镜下观察切片的染色情况。
1.2.4 荧光TUNEL实验分别取术后第120天3组小鼠的肝组织进行石蜡包埋,切片后按照罗氏公司TUNEL试剂盒操作说明书,进行脱蜡、水合、细胞通透后加适量试剂1 (TdT)和试剂2(dUTP)按1:9混合,DAPI复染细胞核,加入抗荧光淬灭剂封片,于200倍光镜下观察并采集图像。每张切片随机选择5个视野,计算每个视野中凋亡细胞核数和总细胞核数,计算肝脏细胞凋亡指数。
凋亡指数=凋亡细胞核数/总细胞核数×100%
1.2.5 RT-PCR检测提取3组实验小鼠肝脏的总RNA, 按照TaKaRa逆转录试剂盒说明书反转录为cDNA, 稀释10倍,采用10 μL体系:模板cDNA 2 μL, 上下引物各0.4 μL,SYBR Premix Ex TaqTM Ⅱ 5 μL, 灭菌双蒸水补齐至10 μL,置于实时荧光定量PCR仪中进行反应。参照LIVAK等[10]的PCR相对基因表达量的计算方法,采用2-ΔΔCt法进行相对基因表达分析。RQ处理组=2-ΔΔCt, RQ对照组=1,ΔΔCt=(Ct目的基因-Ct内参)实验组-(Ct目的基因-Ct内参)对照组。每个样本设置3个复孔,实验重复3次。RT-PCR引物序列如下,HBx上游引物:5′-CCCAACTCCTCGTTCACGGTGGTCTC-3′,下游引物:5′-GAGACCACCGTGAACGAGGAGTTGGG-3′;Bcl2上游引物:5′-ATCTCCCTGTTGACGCTCT-3′,下游引物:5′-CATCTTCTCCTTCCAGCCT-3′;Bax上游引物:5′-AGCCACAA-AGATGGTCACT-3′,下游引物:5′-GGAGATGAACTGGATAGCAA-3′;Mcl-1上游引物:5′-GTCCCGTTTCGTCCTTACAA-3′,下游引物:5′-GCTCCGGAAACTGGACATTA-3′;GAPDH上游引物:5′-ACCACAGTCCATGCCATCAC-3′,下游引物:5′-GCTCCGGAAACTGGACATTA-3′;CK19上游引物:5′-GCCCTAGAGCAGGCCAAT-3′,下游引物:5′-ATCTTGTCGCGCAAGTCC-3′;CK18上游引物:5′-CTGGGCTCTGTGCGAACT-3′,下游引物:5′-ACAGAGCCACCCAGACA-3′。
1.2.6 Western blot检测取小鼠肝组织,液氮研磨法粉碎组织,加入预先配好的混合液(裂解液:PMSF=100:1)500 μL,冰上裂解30 min,每隔10 min振摇1次,结束后于离心(4 ℃,12 000 r/min)10 min,小心吸取上清转移至另一做好标记的EP管中,用BCA比色法测蛋白浓度,加入蛋白上样缓冲液煮沸10 min,配12% SDS-PAGE胶进行电泳,恒流电转(250 mA)后用5%的脱脂奶粉封闭2 h,转移到装有一抗的孵育盒中,4 ℃摇床过夜,TBST洗涤后加入二抗室温反应2 h。采用ECL试剂盒显影,Image Lab软件测量各目的条带的灰度值。
蛋白相对表达量=目的蛋白灰度值/内参灰度值
1.3 统计学分析采用SPSS 21.0统计软件,数据以x±s表示,采用单因素方差分析,2组间比较采用t检验,P<0.05表示差异有统计学意义。
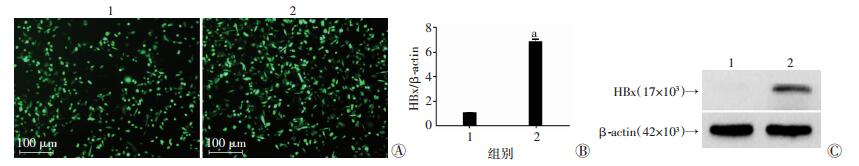
2 结果 2.1 携带HBx基因与携带空载体的肝前体细胞株的鉴定通过荧光显微镜观察到HBx-14-19组与NC-14-19组细胞均有绿色荧光蛋白的表达,表达量达90%以上(图 1A),表明绿色荧光蛋白在两组细胞中高表达。RT-PCR和Western blot检测结果显示,与NC-14-19组相比,HBx-14-19组肝前体细胞中有特异性的HBx表达(P<0.05,图 1B、C),说明外源性HBx基因成功在14-19细胞中表达。
|
|
1:NC-14-19组;2:HBx-14-19组 A:GFP表达;B:RT-PCR检测HBx mRNA表达 a:P<0.05,与NC-14-19组比较;C: Western blot检测HBx蛋白表达 图 1 构建稳定感染慢病毒细胞株的鉴定及HBx在14-19细胞中的表达 |
2.2 GFP在小鼠肝组织中的表达
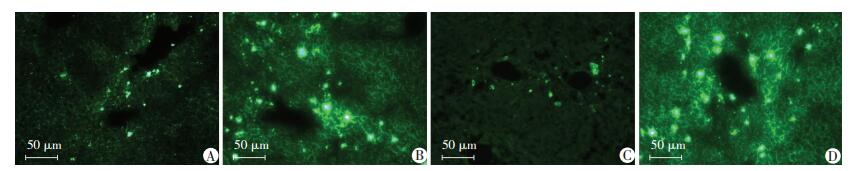
分别取HBx-14-19组、NC-14-19组术后30、120 d小鼠豌豆大小的新鲜肝组织,荧光显微镜观察结果见图 2。术后30 d两组小鼠肝组织荧光均比较微弱,术后120 d,HBx-14-19组与NC-14-19组的小鼠肝组织均有大量的荧光,表明14-19细胞经小鼠肝门静脉注射后,成功到达小鼠肝脏内。
|
| A:NC-14-19组30 d;B:NC-14-19组120 d;C:HBx-14-19组30 d;D:HBx-14-19组120 d 图 2 荧光显微镜观察各组小鼠肝组织术后不同时间GFP的表达 |
2.3 免疫组化法检测小鼠肝前体细胞中HBx蛋白表达
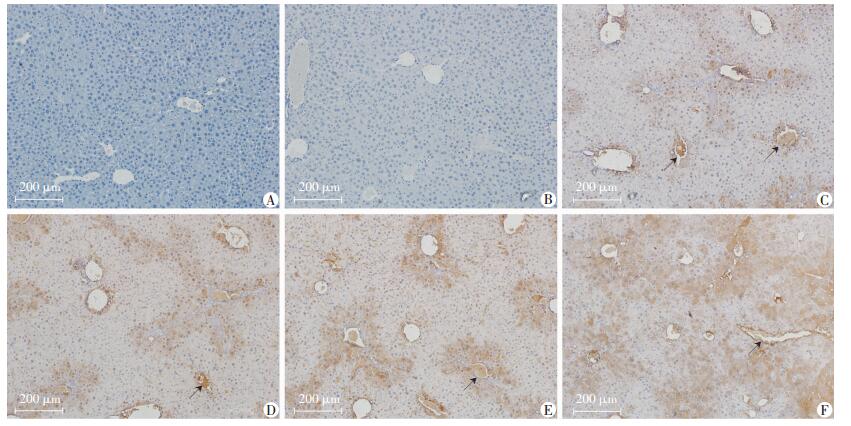
结果显示,HBx-14-19组小鼠肝门静脉周围均有团状分布的点状细胞(图 3箭头示)。随着术后时间的增加,HBx-14-19组细胞开始向肝门静脉远处呈弥散性分布,细胞数量逐渐增多,且细胞质内及细胞膜中均能观察到棕黄色染色。这表明携带HBx的肝前体细胞在小鼠肝脏中存活。NC-14-19组与生理盐水组未见阳性染色。
|
| A:NS组术后120 d;B:NC-14-19组术后120 d;C~F:HBx-14-19组术后30、60、90、120 d ↑:示HBx的表达 图 3 免疫组化检测HBx在小鼠肝前体细胞中的表达 (S-P) |
2.4 HBx对小鼠肝细胞凋亡的影响
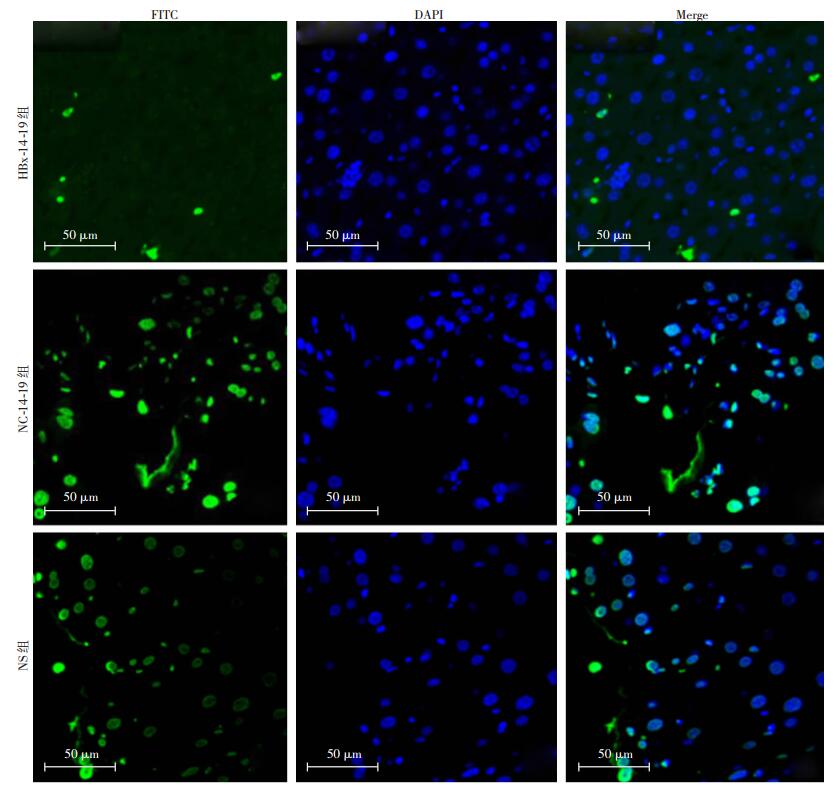
分别取术后120 d的小鼠肝组织,TUNEL染色后荧光显微镜观察结果(图 4)显示,HBx-14-19组的TUNEL-FITC染色阳性细胞数较NC-14-19组、NS组明显减少,凋亡率显著降低[(10±2)% vs (35±3)%、(30±1)%,P<0.05]。
|
| 图 4 TUNEL检测HBx对各组术后120 d小鼠肝前体细胞凋亡的影响 |
2.5 小鼠肝前体细胞HBx及凋亡相关蛋白mRNA的表达
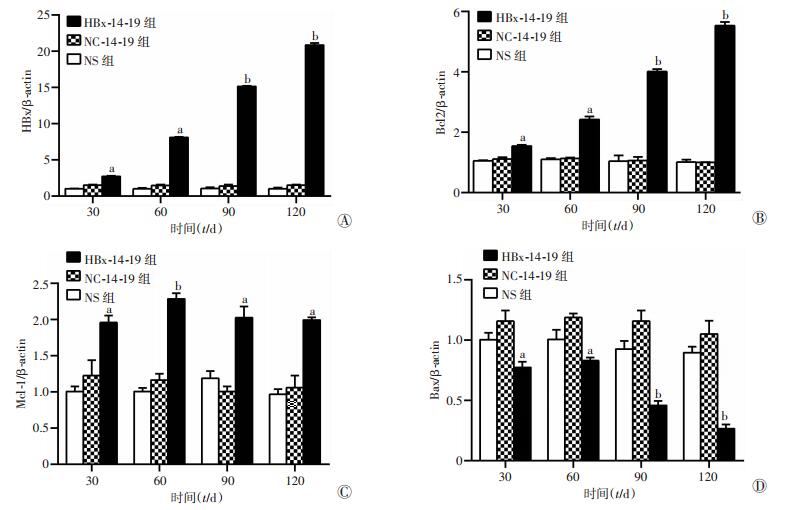
RT-PCR结果显示,术后30、60、90、120 d均有HBx的表达,并且随着时间的延长,HBx表达呈上升趋势(图 5A),表明HBx基因成功到达小鼠肝脏,并且能够稳定复制,小鼠肝脏模型构建成功。荧光定量PCR检测结果显示,HBx-14-19组较NS组、NC-14-19组Bcl2和Mcl-1的表达均上调,而Bax的表达下调,差异具有统计学意义(P<0.05,图 5B~D)。NS组与NC-14-19组比较,差异无统计学意义(P>0.05)。
|
| A~D:分别为HBx、Bcl2、Mcl-1、Bax表达 a:P<0.05, b:P<0.01, 与NC-14-19组、NS组比较 图 5 RT-PCR检测HBx对小鼠肝前体细胞凋亡的影响 |
2.6 小鼠肝前体细胞凋亡相关蛋白的表达
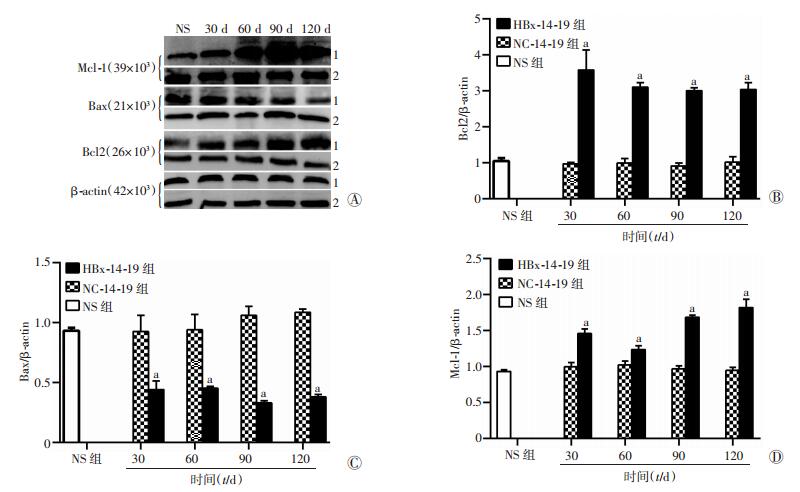
Western blot检测各组小鼠术后30、60、90、120 d肝前体细胞凋亡相关标志物,即Bcl2、Bax及Mcl-1的蛋白表达水平。结果与mRNA的检测结果一致,HBx-14-19组较NS组、NC-14-19组Bcl2和Mcl-1的表达呈上升趋势,在90 d和120 d上升趋势最为明显(P<0.05),而Bax的表达下降,在术后90 d和120 d的下降趋势最为明显(P<0.05);而NS-14-19组与NS组比较,差异无统计学意义(P>0.05),见图 6。
|
| A: Western blot检测结果 1:HBx-14-19组;2:NC-14-19组;B~D:分别为Bcl2、Bax、Mcl-1蛋白的相对表达量a:P<0.05,与NC-14-19组、NS组比较 图 6 Western blot检测HBx对小鼠肝前体细胞凋亡相关蛋白的影响 |
2.7 RT-PCR和Western blot检测CK19、CK18的变化
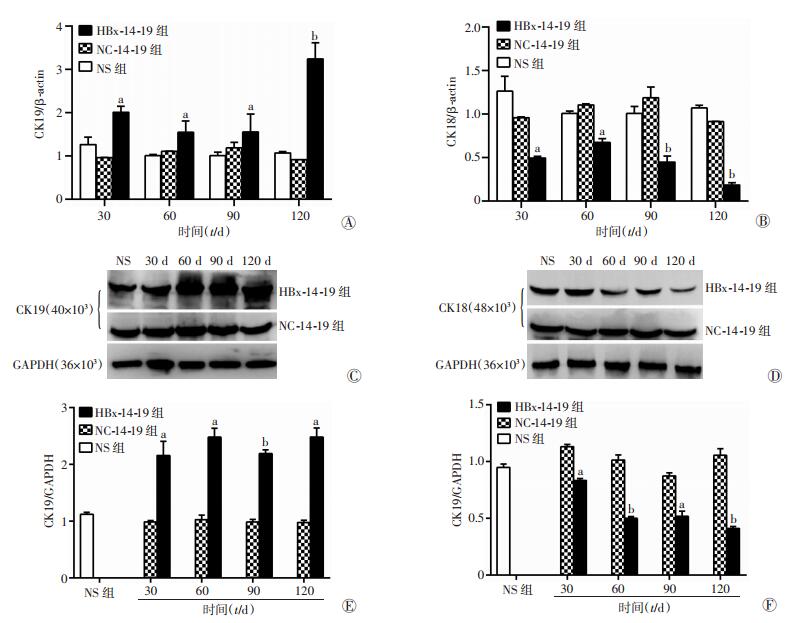
结果显示,与NC-14-19组和NS组相比,HBx-14-19组肝前体细胞的分化早期指标CK19的mRNA和蛋白的相对表达量均升高,而分化晚期指标CK18的mRNA和蛋白的相对表达量均下降,差异均有统计学意义(P<0.05)。而NS组与NC-14-19组之间相比较,差异无统计学意义(P>0.05),见图 7。
|
|
a:P<0.05, b:P<0.01, 与NC-14-19组、NS组比较 A、B:分别为RT-PCR检测CK19、CK18 mRNA表达;C、D:分别为Western blot检测CK19、CK18蛋白表达;E、F:分别为CK19、CK18蛋白的相对表达量 图 7 RT-PCR和Western blot检测HBx对小鼠肝前体细胞早期与晚期分化的影响 |
3 讨论
HBx蛋白是一种多功能蛋白,广泛参与宿主细胞的基因调控与表达[11],是恶性原发性肝癌中唯一表达的HBV病毒蛋白,已被证明是HCC致癌过程中的关键分子[4]。细胞凋亡的主要途径主要由外源性途径(死亡受体途径)和内在途径(线粒体途径)组成[12]。HCC细胞内源性凋亡缺陷是导致化疗失败的原因之一,其中Bcl2家族是细胞内调节凋亡与存活的最重要的一类蛋白家族,由抗凋亡分子(如Bcl2、Mcl-1)与促凋亡分子(如Bax)组成。目前关于HBx与肝细胞凋亡的关系得到深入研究,呈现出促凋亡[13]与抗凋亡[14-15]两种截然不同的结果。本研究结果显示HBx在小鼠体内对肝前体细胞发挥抗凋亡的作用,HBx-14-19组较NS组、NC-14-19组小鼠肝前体细胞的凋亡显著减少,说明HBx可明显抑制小鼠肝前体细胞的凋亡,同时RT-PCR与Western blot检测结果表明,Bcl2、Mcl-1的mRNA与蛋白表达上调,Bax的表达下调,差异有统计学意义(P<0.05)。这说明在体内,HBx蛋白能够破坏Bcl2家族中抗凋亡和促凋亡因子的平衡来抑制小鼠肝前体细胞的凋亡,与课题组前期体外实验结果一致[6-7]。这表明在体内、体外实验中HBx蛋白能够通过抑制肝前体细胞凋亡使肝脏组织发生恶变。由于细胞凋亡与HCC进展高度相关,了解HBx蛋白如何干扰凋亡过程可能会揭示HCC形成的机制,并促进抗肿瘤治疗的发展。我们推测可能的作用机制是,在HBx的刺激下Mcl-1能够快速应答,与Bcl2发生协同作用,加强了Bcl2对Bax的监护,增强了线粒体外膜的稳定性,阻止细胞色素C释放到细胞质中,抑制了凋亡的最终启动者——半胱氨酸蛋白水解酶的活化与凋亡信号的传导,最终使肝前体细胞发生增殖和恶性转化。因此,HBx可能是通过抑制线粒体凋亡信号通路抑制了小鼠肝前体细胞的凋亡[16-18]。
肿瘤干细胞对肿瘤发生和疾病发展具有一定的驱动作用,传统的疗法可杀死非干细胞的癌细胞,但不能消除肿瘤干细胞。当剩余的肿瘤干细胞增殖和分化时肿瘤通常会复发[19]。因此,如果能解决肿瘤干细胞来源的问题,也可以解决临床问题(如肿瘤耐药性和复发)。目前肿瘤干细胞的来源有两种途径,来源于正常干细胞的分化受阻和来源于成熟细胞的去分化[20]。肝癌干细胞可能来源于正常肝干细胞的分化受阻,也可能是由成熟肝细胞的去分化。本课题组前期做了大量的关于HBx对成熟肝细胞的作用研究,但未得出结果,我们猜测HBx可能是通过抑制肝干细胞的分化,使其分化受阻,最终导致其恶性转化。因此,本研究采用RT-PCR与Western blot检测小鼠肝前体细胞分化早期指标CK19和晚期指标CK18 mRNA和蛋白的表达,结果表明,HBx-14-19组CK19 mRNA和蛋白表达升高,CK18 mRNA和蛋白表达下降(P<0.05),生理盐水组与空载体组的表达差异无统计学意义(P>0.05)。而在正常肝干细胞的诱导分化进程中,早期分化指标的表达是逐渐减少的,而晚期指标的表达是逐渐增加的[21],说明在体内HBx能够抑制小鼠肝前体细胞的分化,使小鼠的肝前体细胞发生恶性转变,并且这与体外实验结果一致[7]。
综上所述,本研究利用成功构建慢病毒感染的HBx-14-19细胞株与NC-14-19细胞株,通过小鼠肝门静脉注射后,外源性HBx基因在小鼠肝脏内成功表达并且能够稳定复制,RT-PCR和Western blot证实了在小鼠体内HBx能够抑制肝前体细胞凋亡的发生,并且能够抑制小鼠肝前体细胞的分化成熟,使小鼠的肝前体细胞发生恶性转化,预示着HCC的前期事件的发生。本实验建立的模型能较好地阐明HBx与细胞凋亡、分化之间的相互作用机制,下一步我们将研究HBx是如何介导肝前体细胞的凋亡受到抑制和分化成熟受到干扰的作用机制,希望能为找到HCC的作用机制奠定良好的实验基础,为寻找治疗原发性肝癌潜在的药物治疗靶点提供理论依据。
| [1] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | ZHU G Q, SHI K Q, YU H J, et al. Optimal adjuvant therapy for resected hepatocellular carcinoma: a systematic review with network meta-analysis[J]. Oncotarget, 2015, 6(20): 18151–18161. DOI:10.18632/oncotarget.4098 |
| [3] | FENG X, XU R, DU X, et al. Combination therapy with sora-fenib and radiofrequency ablation for BCLC stage 0-B1 hepatocellular carcinoma: a multicenter retrospective cohort study[J]. Am J Gastroenterol, 2014, 109(12): 1891–1899. DOI:10.1038/ajg.2014.343 |
| [4] | GENG M, XIN X, BI LQ, et al. Molecular mechanism of hepatitis B virus X protein function in hepatocar cinogenesis[J]. World J Gastroenterol, 2015, 21(38): 10732–10738. DOI:10.3748/wjg.v21.i38.10732 |
| [5] | ZHANG X D, WANG Y, YE L H. Hepatitis B virus X protein accelerates the development of hepatoma[J]. Cancer Biol Med, 2014, 11(3): 182–190. DOI:10.7497/j.issn.2095-3941.2014.03.004 |
| [6] |
芦永良, 申利红, 李红丽, 等. 稳定表达HBx的肝前体细胞株的构建及其对增殖的影响[J].
细胞与分子免疫学杂志, 2013, 29(3): 256–260.
LU Y L, SHEN L H, LI H L, et al. Establishment of hepatic stem cell line stably expressing HBx protein and the effect of HBx on cell proliferation[J]. Chin J Cell Mol Immunol, 2013, 29(3): 256–260. DOI:10.13423/j.cnki.cjcmi.006733.cjcmi.006733 |
| [7] |
白光文, 申利红, 卢永良, 等. 乙肝病毒X蛋白对肝前体细胞分化的影响[J].
重庆医科大学学报, 2012, 37(10): 846–849.
BAI G W, SHEN L H, LU Y L, et al. Effect of hepatitis B virus X protein mediated by adenovirus on the differentiation of hepatic progenitor cells[J]. J Chongqing Med Univ, 2012, 37(10): 846–849. DOI:10.3969/j.issn.0253-3626.2012.10.002 |
| [8] |
刘梦楠, 张婷, 刘洁, 等. 感染HBVx的肝前体细胞的小鼠体内稳定表达模型构建[J].
基因组学与应用生物学, 2017, 36(4): 1318–1324.
LIU M N, ZHANG T, LIU J, et al. Construction of stable expression model for hepatic progenitor cells infected with HBVx in mice[J]. Genom Appl Biol, 2017, 36(4): 1318–1324. DOI:10.13417/j.gab.036.001318 |
| [9] |
钟沁, 张超, 何雪梅, 等. 表达HBx的肝前体细胞的小鼠肝内移植模型的构建[J].
第三军医大学学报, 2014, 36(24): 2451–2454.
ZHONG Q, ZHANG C, HE X M, et al. Construction of intrahepatic transplantation model of hepatic progenitors cells expressing hepatitis B virus X in mice[J]. J Third Mil Med Univ, 2014, 36(24): 2451–2454. DOI:10.16016/j.1000-5404.2014.24.007 |
| [10] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [11] | RAWAT S, CLIPPINGER A J, BOUCHARD M J. Modulation of apoptotic signaling by the hepatitis B virus X protein[J]. Viruses, 2012, 4(11): 2945–2972. DOI:10.3390/v4112945 |
| [12] | LIN S, ZHANG Y J. Interference of apoptosis by hepatitis B virus[J]. Viruses, 2017, 9(8): 230. DOI:10.3390/v9080230 |
| [13] | KONG F Y, YOU H J, ZHAO J J, et al. The enhanced expression of death receptor 5 (DR5) mediated by HBV X pr otein through NF-kappaB pathway is associated with cell apoptosis induced by (TNF-alpha related apoptosis inducing ligand) TRAIL in hepatoma cells[J]. Virol J, 2015, 12: 192. DOI:10.1186/s12985-015-0416-z |
| [14] | SHI Y, WANG J, WANG Y, et al. A novel mutant 10Ala/Arg together with mutant 144Ser/Arg of hepatitis B virus X protein involved in hepatitis B virus-related hepatocarcinogenesis in HepG2 cell lines[J]. Cancer Lett, 2016, 371(2): 285–291. DOI:10.1016/j.canlet.2015.12.008 |
| [15] | CHAO C C. Inhibition of apoptosis by oncogenic hepatitis B virus X protein: Implications for the treatment of hepato-cellular carcinoma[J]. World J Hepatol, 2016, 8(25): 1061–1066. DOI:10.4254/wjh.v8.i25.1061 |
| [16] | CZABOTAR P E, LESSENE G, STRASSER A, et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy[J]. Nat Rev Mol Cell Biol, 2014, 15(1): 49–63. DOI:10.1038/nrm3722 |
| [17] | PAUL I, JONES J M. Apoptosis block as a barrier to effective therapy in non small cell lung cancer[J]. World J Clin Oncol, 2014, 5(4): 588–594. DOI:10.5306/wjco.v5.i4.588 |
| [18] | SMITH C C, GUéVREMONT D, WILLIAMS J M, et al. Apoptotic cell death and temporal expression of apoptotic proteins Bcl-2 and Bax in the hippocampus, following binge ethanol in the neonatal rat model[J]. Alcohol Clin Exp Res, 2015, 39(1): 36–44. DOI:10.1111/acer.12606 |
| [19] | XIAO J, MU J, LIU T, et al. Dig the root of cancer: targeting cancer stem cells therapy[J]. J Med Discov, 2017, 2(2): jmd 17003. DOI:10.24262/jmd.2.2.17003 |
| [20] | WEI W, LEWIS M T. Identifying and targeting tumor-initiating cells in the treatment of breast cancer[J]. Endocr Relat Cancer, 2015, 22(3): R135–R155. DOI:10.1530/ERC-14-0447 |
| [21] | VOUGIOUKLAKIS T, NAKAMURA Y, SALOURA V. Criti-cal roles of protein methyltransferases and demethylases in the regulation of embryonic stem cell fate[J]. Epigenetics, 2017, 3: 1–39. DOI:10.1080/15592294.2017.1391430 |



