2. 671000 云南 大理,大理大学药学与化学学院;
3. 646000 四川 泸州,西南医科大学药学院;
4. 404000 重庆,重庆三峡中心医院药学部
2. College of Pharmacy and Chemistry, Dali University, Dali, Yunnan Province, 671000;
3. School of Pharmacy, Southwest Medical University, Luzhou, Sichuan Province, 646000;
4. Department of Pharmacy, Chongqing Three Gorges Central Hospital, Chongqing, 404000, China
类风湿性关节炎(rheumatoid arthritis, RA)是以关节滑膜慢性炎症为主的自身免疫性疾病[1]。主要临床表现为晨僵、关节肿痛、软骨破坏、关节间隙变窄等,通常会导致关节破坏和畸形甚至不同程度的残疾,给社会带来巨大的经济负担[1-2]。RA好发于青壮年及少儿,女性发病率高于男性,是临床上常见的疾病[2]。全世界不同地区人群中RA的发病率为0.18%~1.07%,中国大陆RA患病率为0.20%~0.37%[3]。
临床上常用的RA治疗药物有改善病情的抗风湿药(disease-modifying anti-rheumatic drugs,DMARDs)、非甾体类抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)、糖皮质激素、生物制剂以及靶向小分子药物等[4]。非甾体类抗炎药和糖皮质激素是治疗RA的一线用药。糖皮质激素具有强大的抗炎作用,但不良反应较多,耐受性差。非甾体类抗炎药具有止痛和抗炎的特性,可减轻关节疼痛和肿胀,但不能改变疾病进程或阻止关节破坏,因此不能单独应用[5]。近20多年来,靶向小分子药物的研发成为创新药的热门。枸橼酸托法替布(tofacitinib)是酪氨酸激酶JAK1和JAK3的抑制剂,通过抑制或阻断细胞内的信号通路,减少细胞因子和各种炎症因子的产生,于2012年被美国食品药品管理局批准用于RA的治疗[6],于2017年3月被国家食品药品监督管理总局正式批准用于对甲氨蝶呤疗效不足或对其无法耐受的中度至重度活动性RA成年患者的治疗,可与甲氨蝶呤或其他DMARDs联合使用。
目前JAK-3抑制剂主要用于中重度RA患者的治疗,托法替布使用剂量和疗程与疗效之间的关系尚存在临床争议。本文采用meta分析的研究方法,对托法替布剂量和疗程进行全面的系统评价,为该药在临床合理使用提供循证药学参考。
1 资料与方法 1.1 纳入与排除标准 1.1.1 研究类型随机对照试验(RCT)。
1.1.2 研究对象纳入符合美国风湿病学会(American College of Rheumatology,ACR)1987年修订标准被诊断为RA的患者,其种族、国籍、病程不限。
1.1.3 干预措施研究组采用托法替布治疗,剂量为5 mg或者10 mg,2次/d,疗程为3个月,联合或者不联合甲氨蝶呤;对照组采用安慰剂治疗。
1.1.4 结局指标ACR20,按照ACR分类标准,即为肿胀及触痛的个数有20%的改善以及下列5项参数中至少3项有20%的改善:患者对疼痛的自我评价;患者对目前疾病总体状况的自我评价;医师对患者疾病总体状况的评分;健康评估问卷;急性期反应物。ACR 50、ACR70采用同样的标准分别定义为50%及70%的提高;严重不良事件发生率(serious adverse events,SAE);除SAE外的其他不良事件(adverse events,AE)。
1.1.5 排除标准① 非中、英文文献;②重复发表、数据相同的文献;③疗程低于3个月的文献;④数据无法提取结局指标的文献。
1.2 检索策略计算机检索PubMed、EMbase、The Cochrane Library(2017年8期)、Web of Science、CBM、万方数据库和CNKI数据库,搜集关于托法替布治疗类风湿性关节炎的临床研究,检索时限均从建库至2017年6月1日。检索采取主题词和自由词相结合的方式。英文检索词包括Janus kinase (JAK) inhibitor、tofacitinib、CP-690 550、Rheumatoid arthritis等;中文检索词包括JAK抑制剂、托法替布、托法替尼、类风湿性关节炎等。
1.3 文献筛选及资料提取由2位研究员按照纳入、排除标准独立筛选临床研究、提取文献资料并交叉核对。如遇分歧,则咨询第3位研究员协助判断,文献无法提取数据资料可与作者联系。资料提取内容主要包括:纳入研究的基本信息(包括研究作者及发表时间)和研究对象的基线特征[包括各组的样本数、干预措施的具体细节(干预药物及其剂量)、随访时间、重要的结局指标]。
1.4 纳入研究的偏倚风险评价由2名研究员按照Cochrane协作网推荐的手册,针对RCT偏倚风险评价工具的具体内容评价纳入研究的偏倚风险程度。
1.5 统计学分析采用RevMan 5.3软件对各效应指标进行Meta分析。计数资料采用比值比(OR)为效应指标,计量资料采用均数差(MD)为效应指标,各效应量均给出其点估计值和95%的置信区间。纳入研究结果间的异质性采用χ2检验进行分析, 检验水准为α=0.1,同时结合I2定量判断异质性的大小。若各研究结果间无统计学异质性(I2≤50%,P>0.1),则采用固定效应模型进行Meta分析;若各研究结果间存在统计学异质性(I2>50%,P<0.1),则进一步分析异质性来源。在排除明显临床异质性的影响后,采用随机效应模型进行Meta分析。明显的临床异质性采用亚组分析或敏感性分析等方法进行处理,或只行描述性分析。
2 结果 2.1 文献检索结果初检出相关文献210篇,通过阅读文题和摘要进行初筛,排除不相关文献、综述或者系统评价;仔细阅读全文,排除无可用数据文献、同一研究多次发表文献、动物实验文献等。经逐层筛选后,最终纳入9个RCT[7-15],合计3 742例患者。托法替布5 mg组1 419例,托法替布10 mg组1 434例,安慰剂组889例。文献筛选流程及结果见图 1。
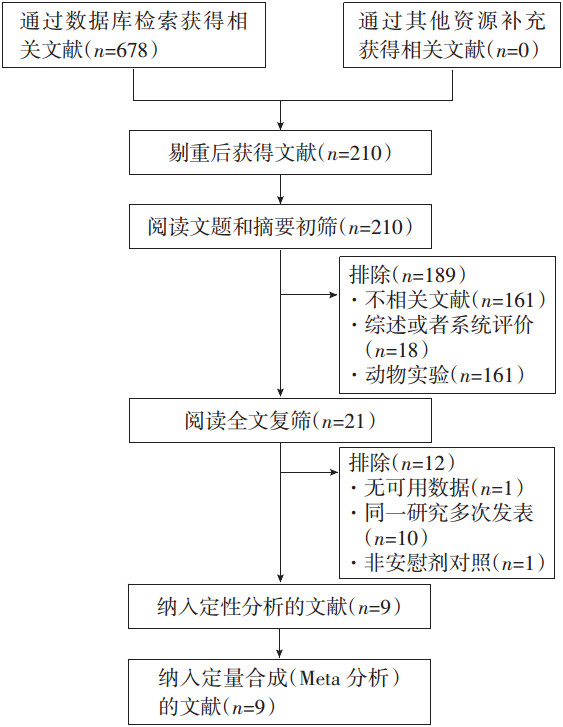
|
| 图 1 文献筛选流程及结果 |
2.2 纳入研究的基本特征与偏倚风险评价结果
纳入文献均为多国对中心研究,样本具有代表性,随访时间和结局指标多为相同,比较可靠性强,干预措施主要为托法替布单药或者联合用药对比安慰剂。对文献进行系统的质量评估,可见随机方法主要包括交互式语音应答系统[7, 13]、网络或电话[8, 14]、随机数字表[12];盲法均为双盲[7-15];分配隐藏采用中心分配[7, 13],总体研究质量较高,可靠性强。纳入研究的基本特征见表 1,偏倚风险评价结果见表 2。
| 纳入研究 | 国家/地区(多中心) | 例数(研究组/对照组) | 干预措施 | 随访时间(月) | 结局指标 | |
| 研究组 | 对照组 | |||||
| VAN DER HEIJDE D 2013[7] | 111 | 640/160 | 托法替布5 mg/10 mg, 2次/d+甲氨蝶呤 | 安慰剂+甲氨蝶呤 | 6 | ①②③④⑤ |
| FLEISCHMANN R 2012[8] | 94 | 488/122 | 托法替布5 mg/10 mg, 2次/d | 安慰剂 | 6 | ①②③④⑤ |
| KREMER J 2013 [9] | 114 | 636/159 | 托法替布5 mg/10 mg, 2次/d+nonbiologic DMARD | 安慰剂+nonbiologic DMARD | 6 | ①②③④⑤ |
| KREMER J 2012 [10] | 72 | 146/69 | 托法替布5 mg/10 mg, 2次/d+甲氨蝶呤 | 安慰剂+甲氨蝶呤 | 6 | ①②③④⑤ |
| FLEISCHMANN R 2012 [11] | 63 | 110/59 | 托法替布5 mg/10 mg, 2次/d | 安慰剂 | 6 | ①②③④⑤ |
| TANAKA Y 2015 [12] | 47 | 105/52 | 托法替布5 mg/10 mg, 2次/d | 安慰剂 | 3 | ①②③④⑤ |
| VAN VOLLENHOVEN RF 2012 [13] | 115 | 405/108 | 托法替布5 mg/10 mg, 2次/d+甲氨蝶呤 | 安慰剂+甲氨蝶呤 | 6 | ①②③④⑤ |
| BURMESTER GR 2013 [14] | 82 | 267/132 | 托法替布5 mg/10 mg, 2次/d+甲氨蝶呤 | 安慰剂+甲氨蝶呤 | 6 | ①②③④⑤ |
| TANAKA Y 2011 [15] | 19 | 56/28 | 托法替布5 mg/10 mg, 2次/d+甲氨蝶呤 | 安慰剂+甲氨蝶呤 | 3 | ①②③④⑤ |
| ① ACR20;② ACR50;③ ACR70;④ SAE;⑤ AE | ||||||
| 纳入研究 | 随机方法 | 盲法 | 分配隐藏 | 结果数据的完整性 | 选择性报告研究结果 | 其他偏倚来源 |
| VAN DER HEIJDE D 2013[7] | 交互式语音应答系统 | 双盲 | 中心分配 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
| FLEISCHMANN R 2012[8] | 网络或电话 | 双盲 | 不清楚 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
| KREMER J 2013 [9] | 不清楚 | 双盲 | 不清楚 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
| KREMER J 2012 [10] | 不清楚 | 双盲 | 不清楚 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
| FLEISCHMANN R 2012 [11] | 不清楚 | 双盲 | 不清楚 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
| TANAKA Y 2015 [12] | 随机数字表 | 双盲 | 不清楚 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
| VAN VOLLENHOVEN RF 2012 [13] | 交互式语音应答系统 | 双盲 | 中心分配 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
| BURMESTER GR 2013 [14] | 网络或电话 | 双盲 | 不清楚 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
| TANAKA Y 2011 [15] | 不清楚 | 双盲 | 不清楚 | 有失访或退出,ITT分析 | 低风险 | 低风险 |
2.3 Meta分析结果 2.3.1 有效性指标ACR20 2.3.1.1 托法替布5 mg组与安慰剂组比较
共纳入9个RCT[7-15],包含2 308例。随机效应模型Meta分析结果显示:托法替布5 mg组与安慰剂组之间差异有统计学意义。对疗程进行亚组分析结果提示:托法替布5 mg组疗程为3个月或者6个月的ACR20达标率,与安慰剂组相比差异有统计学意义,依次分别为OR=3.77,95%CI:2.74~5.18,P<0.000 01;OR=2.48,95% CI:1.87~3.29,P<0.000 01(图 2)。

|
| 图 2 托法替布5 mg组与安慰剂组ACR20比较的Meta分析 |
2.3.1.2 托法替布10 mg组与安慰剂组比较
共纳入9个RCT[7-15],包含2 323例。固定效应模型Meta分析结果显示:托法替布10 mg组与安慰剂组之间差异有统计学意义。对疗程进行亚组分析结果提示:托法替布10 mg组疗程为3个月或者6个月的ACR20达标率,与安慰剂组相比,差异有统计学意义,依次分别为OR=4.52,95%CI:3.75~5.44,P<0.000 01;OR=3.34,95% CI:2.67~4.18,P<0.000 01(图 3)。
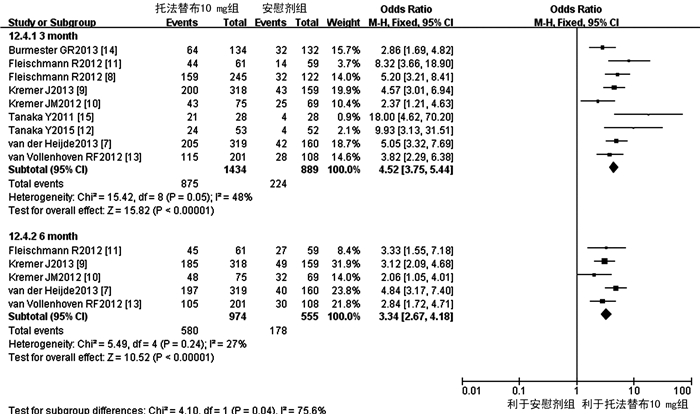
|
| 图 3 托法替布10 mg组与安慰剂组ACR20比较的Meta分析 |
2.3.1.3 托法替布10 mg组与托法替布5 mg组比较
共纳入9个RCT[5-8],包含2 853例。固定效应模型Meta分析结果显示:托法替布不同剂量组之间差异有统计学意义。对疗程进行亚组分析结果提示:疗程为3个月或者6个月的ACR20达标率,托法替布10 mg组与5 mg组相比差异有统计学意义,依次分别为OR=1.27,95%CI:1.10~1.48,P=0.002;OR=1.26,95%CI:1.07~1.49,P=0.007。
2.3.2 其他疗效指标ACR50、ACR70也对托法替布的剂量和疗程进行亚组分析,研究结果提示:托法替布剂量为5 mg或者10 mg疗效均优于安慰剂组,差异有统计学意义。托法替布10 mg组对比5 mg组在ACR50指标方面差异无统计学意义,在ACR70方面,增加剂量则疗效有所提高,差异具有统计学意义(表 3)。
| 指标 | 疗程(月) | 研究数 | 例数 | 固定效应模型 | 随机效应模型 | |||||
| OR | 95%CI | P | OR | 95%CI | P | |||||
| ACR50 | ||||||||||
| 托法替布5 mg vs安慰剂 | 3 | 9 | 2 308 | 3.89 | 3.06~4.95 | < 0.000 01 | 4.15 | 2.90~5.94 | < 0.000 01 | |
| 6 | 5 | 1 518 | 3.44 | 2.59~4.56 | < 0.000 01 | 3.20 | 2.06~4.98 | < 0.000 01 | ||
| 托法替布10 mg vs安慰剂 | 3 | 9 | 2 323 | 4.90 | 3.81~6.32 | < 0.000 01 | 4.82 | 3.57~6.50 | < 0.000 01 | |
| 6 | 5 | 1 529 | 4.16 | 3.15~5.50 | < 0.000 01 | 3.80 | 2.17~6.66 | < 0.000 01 | ||
| 托法替布10 mg vs托法替布5 mg | 3 | 9 | 2 853 | 1.16 | 0.99~1.36 | 0.07 | 1.11 | 0.87~1.41 | 0.39 | |
| 6 | 6 | 2 196 | 1.15 | 0.97~1.37 | 0.12 | 1.11 | 0.85~1.45 | 0.44 | ||
| ACR70 | ||||||||||
| 托法替布5 mg vs安慰剂 | 3 | 9 | 2 308 | 4.87 | 3.18~7.46 | < 0.000 01 | 4.68 | 3.05~7.18 | < 0.000 01 | |
| 6 | 5 | 1 518 | 5.47 | 3.35~8.95 | < 0.000 01 | 4.80 | 2.35~9.78 | < 0.000 01 | ||
| 托法替布10 mg vs安慰剂 | 3 | 9 | 2 323 | 6.62 | 4.36~10.06 | < 0.000 01 | 6.18 | 4.04~9.43 | < 0.0001 | |
| 6 | 5 | 1 529 | 7.58 | 4.68~12.27 | < 0.000 01 | 6.69 | 3.14~14.25 | < 0.000 01 | ||
| 托法替布10 mg vs托法替布5 mg | 3 | 9 | 2 853 | 1.41 | 1.14~1.74 | 0.002 | 1.39 | 1.09~1.76 | 0.008 | |
| 6 | 6 | 2 196 | 1.35 | 1.08~1.68 | 0.008 | 1.34 | 1.08~1.67 | 0.009 | ||
2.3.3 安全性
根据研究结果提示,托法替布对比安慰剂组,增加除严重不良反应外的不良事件的发生率和腹泻发生率,在严重不良反应、恶心、鼻咽炎、上呼吸道感染、尿路感染、支气管炎、带状疱疹、关节痛发生率方面,两组之间差异无统计学意义(表 4)。
| 结局指标 | 研究数 | 例数 | 模型 | 效应估计值 | ||
| OR | 95%CI | P | ||||
| 严重不良反应发生率 | 9 | 2 308 | 固定 | 0.94 | 0.58~1.51 | 0.79 |
| 不良事件发生率 | 9 | 2 308 | 随机 | 1.43 | 1.02~2.01 | 0.04 |
| 恶心发生率 | 6 | 1 836 | 固定 | 1.18 | 0.16~2.09 | 0.58 |
| 腹泻发生率 | 9 | 2 308 | 固定 | 1.90 | 1.15~3.12 | 0.01 |
| 鼻咽炎发生率 | 9 | 2 308 | 固定 | 1.25 | 0.80~1.94 | 0.32 |
| 上呼吸道感染发生率 | 9 | 2 308 | 固定 | 1.41 | 0.89~2.24 | 0.14 |
| 尿路感染发生率 | 6 | 1 671 | 固定 | 1.88 | 0.99~3.59 | 0.05 |
| 支气管炎发生率 | 5 | 1 093 | 固定 | 1.24 | 0.49~3.09 | 0.65 |
| 带状疱疹发生率 | 2 | 248 | 固定 | 1.08 | 0.15~7.81 | 0.94 |
| 关节痛发生率 | 5 | 1 563 | 固定 | 0.48 | 0.22~1.06 | 0.07 |
2.4 敏感性分析
对疗效及安全性的各项重要结局指标进行敏感性分析。通过改变效应模型(固定或者随机)和去除权重比例较大或较小的研究后,Meta分析后得出的结果与之前分析结果进行比较,未发生较大的变化,提示敏感性低,结果的稳定性高。如ACR20指标,托法替布剂量为5 mg或者10 mg均优于安慰剂,托法替布剂量10 mg优于5 mg,结果稳健可信(表 5)。
| 指标 | 疗程(月) | 研究数 | 例数 | 固定效应模型 | 随机效应模型 | |||||
| OR | 95%CI | P | OR | 95%CI | P | |||||
| ACR20 | ||||||||||
| 托法替布5 mg vs安慰剂 | 3 | 9 | 2 308 | 3.58 | 2.97~4.31 | <0.000 01 | 3.77 | 2.74~5.18 | <0.000 01 | |
| 6 | 5 | 1 518 | 2.57 | 2.05~3.21 | <0.000 01 | 2.48 | 1.87~3.29 | <0.000 01 | ||
| 托法替布10 mg vs安慰剂 | 3 | 9 | 2 323 | 4.52 | 3.75~5.44 | <0.000 01 | 4.63 | 3.51~6.13 | <0.000 01 | |
| 6 | 5 | 1 529 | 3.34 | 2.67~4.18 | <0.000 01 | 3.27 | 2.49~4.30 | <0.000 01 | ||
| 托法替布10 mg vs托法替布5 mg | 3 | 9 | 2 853 | 1.27 | 1.10~1.48 | 0.002 | 1.28 | 1.09~1.49 | 0.002 | |
| 6 | 5 | 2 204 | 1.26 | 1.07~1.49 | 0.007 | 1.26 | 1.07~1.49 | 0.007 | ||
| 指标 | 疗程(月) | 排除权重大的RCT | 排除权重小的RCT | |||||||
| OR | 95%CI | P | OR | 95%CI | P | |||||
| ACR20 | ||||||||||
| 托法替布5 mg vs安慰剂 | 3 | 3.96 | 2.69~5.81 | <0.000 01 | 3.39 | 2.77~4.14 | <0.000 01 | |||
| 6 | 2.40 | 1.61~3.57 | <0.000 01 | 2.68 | 2.06~3.48 | <0.000 01 | ||||
| 托法替布10 mg vs安慰剂 | 3 | 4.72 | 3.37~6.61 | <0.000 01 | 4.38 | 3.41~5.64 | <0.000 01 | |||
| 6 | 3.27 | 2.24~4.78 | <0.000 01 | 3.23 | 2.33~4.48 | <0.000 01 | ||||
| 托法替布10 mg vs托法替布5 mg | 3 | 1.24 | 1.03~1.50 | 0.03 | 1.30 | 1.11~1.51 | 0.008 | |||
| 6 | 1.26 | 1.03~1.54 | 0.02 | 1.23 | 0.03~1.46 | 0.02 | ||||
2.5 发表偏倚分析
对研究数目不少于5个的重要指标绘制倒置漏斗图,观察散点对称性。以结局指标ACR20为例,效应量估计值的精度随着样本量的增加而提高,宽度随精度的增加而逐渐变窄,最后趋于点状。且散点围绕中心线呈左右对称排列,说明没有或者发表偏倚较小(图 4)。
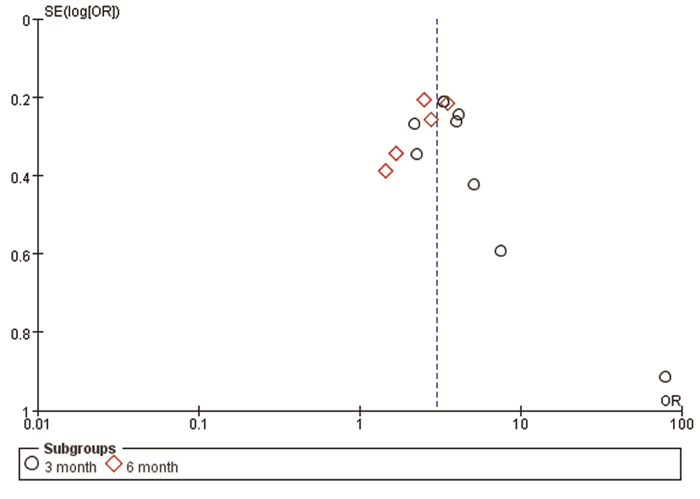
|
| 图 4 疗效指标ACR20的Meta分析漏斗图 |
3 讨论
JAK激酶和其下游的效应器、信号转导及转录激活蛋白(signal transducers and activators of transcription proteins,STATs)形成了重要的细胞因子信号传导途径[16]。研究发现JAK-STAT通路是一条由细胞因子刺激的信号转导通路,可由多种细胞因子、生长因子以及受体激活, 参与细胞增殖、分化、凋亡、血管生成以及免疫调节等过程[17]。Janus激酶(JAK)信号通路涉及自身免疫性疾病炎症的发病机制,对RA相关细胞的促炎活性有调控作用,其中JAK是炎症细胞因子信号传导中枢蛋白,RA患者关节滑膜组织中JAK水平显著增高[18]。托法替布为JAK抑制剂,以细胞信号转导通路为靶点,作用于细胞因子网络的核心部分,通过干扰JAK-STAT信号通路而影响DNA的转录过程从而治疗RA[19]。
目前依据发展的时间及原理,治疗RA的药物依次为五代:非甾体类抗炎药物、糖皮质激素、改变病情药(慢作用抗风湿药)、以TNF-α抑制剂为主的早期生物制剂、直接针对T细胞发生作用的新型生物制剂[20]。欧洲风湿病学会联合会推荐指出:对两种改善病情的抗风湿药反应不佳时,可以添加生物制剂或者Janus激酶抑制剂[6]。国外研究主要为托法替布与其他生物制剂比较疗效,而针对托法替布剂量和疗程的meta分析尚未见具体报道。
本研究对托法替布治疗RA进行系统评价,探讨其单用或者联用改善病情的抗风湿药的疗效和安全性,主要结局采用ACR标准判断[21]。Meta分析结果显示:托法替布治疗RA在ACR20、ACR50、ACR70反应率方面均优于安慰剂组,差异具有统计学意义。对疗程进行亚组分析发现:疗程为3个月或者6个月,托法替布单用或联用甲氨蝶呤及其他传统的抗风湿病药,与安慰剂组相比,在ACR20、ACR50、ACR70均优于安慰剂组,差异均有统计学意义。对剂量进行亚组分析结果提示:托法替布剂量为10 mg组单用或联用甲氨蝶呤及其他传统的抗风湿病药,在ACR20、ACR70反应率方面优于托法替布5 mg组,差异均有统计学意义,在ACR50反应率方面两组差异无统计学意义。结果提示托法替布单用或者联用甲氨蝶呤,剂量为5 mg或者10 mg,疗效均优于安慰剂组,但会增加轻微不良反应的发生。已有meta分析表明托法替布单用时在疗效ACR20、ACR50、ACR70反应率方面优于安慰剂,与其他阳性药物单用表现出相似的效果;联用传统抗风湿药优于安慰剂联用传统抗风湿药组;与其他阳性药物(主要为生物制剂)联用传统抗风湿药表现相似的效果。联用DMARDs治疗RA时,托法替布在ACR20反应率优于依那西普、阿巴西普、英夫利昔单抗;在ACR50反应率优于巴瑞克替尼;在ACR70反应率优于赛妥珠单抗[22]。本研究对比阳性药物阿达木单抗仅1篇文献[13],数据做描述性分析,疗效与托法替布相似,与研究结果相符[22]。
在严重不良反应方面,托法替布组与安慰剂组之间差异无统计学意义。但除严重不良反应外的不良事件发生率和腹泻发生率方面,安慰剂组优于托法替布组,且托法替布组剂量为5 mg或10 mg时,结果并不发生较大改变,较为稳健。这说明托法替布治疗效果虽然优于安慰剂组,但会增加轻微不良反应的发生,但并不增加严重不良反应的发生。
本系统评价存在一定的局限性:①对某些结局指标进行合并分析时,纳入研究间异质性较大,可能原因是纳入二期研究样本量较小,或者是基础用药不同,也可能是患者耐药情况不同。②部分研究未采用正确的随机分配和隐藏方法,可能造成选择性偏倚。③患者参与评估问卷调查主观因素的影响较大,难免存在其他偏倚。④受原始资料的限制,无法对托法替布与除甲氨喋呤外的其他DMARDs或者生物制剂进行单用或者联用方面的Meta分析。⑤由于纳入文献对比阳性药物的仅有1篇,故要想比较托法替布对比其他生物制剂的疗效,尚需要开展更多临床研究并长期随访。
综上所述,托法替布治疗RA能取得较好的疗效,不足之处为可增加轻微不良反应的发生。
声明 本研究参与人数为6人,作者之间分工明确,署名单位均为参与研究者。张春燕负责临床指标的数据分析,撰写文章初稿,校对文章终稿。范小冬负责数据提取,拟定正确统计方法,校对文章。秦元和孔文强负责筛选符合纳入排除标准的临床研究,校对文章。周春阳和杜彪是硕士研究生导师,负责斟酌、筛选课题,校对文章
| [1] |
梁燕, 邹豪. 类风湿性关节炎药物治疗研究进展[J].
海军医学杂志, 2014, 35(4): 332–333.
LIANG Y, ZOU H. Research progress for rheumatoid arthritis drugs[J]. J Navy Med, 2014, 35(4): 332–333. DOI:10.3969/j.issn.1009-0754.2014.04.041 |
| [2] |
李瑞, 孟庆刚. 类风湿性关节炎的临床治疗研究[J].
中华中医药学刊, 2007, 25(7): 1348–1352.
LI R, MENG Q G. Clinic treating discussion of rheumatoid arthritis[J]. Chin Arch Tradit Chin Med, 2007, 25(7): 1348–1352. DOI:10.13193/j.archtcm.2007.07.38.lir.018 |
| [3] |
胡晓敏, 宗英, 余珊珊, 等. 类风湿关节炎治疗药物的研发进展及趋势[J].
中国新药杂志, 2017, 26(1): 36–43.
HU X M, ZONG Y, YU S S, et al. Research progress and trends in rheumatoid arthritis therapeutic drugs[J]. Chin J New Drug, 2017, 26(1): 36–43. |
| [4] | SMOLEN J S, LANDEWÉ R, BREEDVELD F C, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update[J]. Ann Rheum Dis, 2014, 73(3): 492–509. DOI:10.1136/annrheumdis-2013-204573 |
| [5] |
池里群, 周彬, 高文远, 等. 治疗类风湿性关节炎常用药物的研究进展[J].
中国中药杂志, 2014, 39(15): 2851–2858.
CHI L Q, ZHOU B, GAO W Y, et al. Research progress of drugs commonly used to anti-rheumatoid arthritis[J]. China J Chin Materia Med, 2014, 39(15): 2851–2858. DOI:10.4268/cjcmm20141512 |
| [6] | BANERJEE S, BIEHL A, GADINA M, et al. JAK-STAT signaling as a target for inflammatory and autoimmune diseases: Current and future prospects[J]. Drugs, 2017, 77(5): 521–546. DOI:10.1007/s40265-017-0701-9 |
| [7] | VAN DER HEIJDE D1, TANAKA Y, FLEISCHMANN R, et al. Tofacitinib (CP-690, 550) in patients with rheumatoid arthritis receiving methotrexate: Twelve-month data from a twenty-four-month phase Ⅲ randomized radiographic study[J]. Arthritis Rheum, 2013, 65(3): 559–570. DOI:10.1002/art.37816 |
| [8] | FLEISCHMANN R, KREMER J, CUSH J, et al. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis[J]. N Engl J Med, 2012, 367(6): 495–507. DOI:10.1056/NEJMoa1109071 |
| [9] | KREMER J, LI Z G, HALL S, et al. Tofacitinib in combination with nonbiologic disease-modifying antirheumatic drugs in patients with active rheumatoid arthritis: a randomized trial[J]. Ann Intern Med, 2013, 159(4): 253–261. DOI:10.7326/0003-4819-159-4-201308200-00006 |
| [10] | KREMER J M, COHEN S, WILKINSON B E, et al. A phase Ⅱb dose-ranging study of the oral JAK inhibitor tofacitinib (CP-690, 550) versus placebo in combination with background methotrexate in patients with active rheumatoid arthritis and an inadequate response to methotrexate alone[J]. Arthritis Rheum, 2012, 64(4): 970–981. DOI:10.1002/art.33419 |
| [11] | FLEISCHMANN R, CUTOLO M, GENOVESE M C, et al. Phase Ⅱb dose-ranging study of the oral JAK inhibitor tofacitinib (CP-690, 550) or adalimumab monotherapy versus placebo in patients with active rheumatoid arthritis with an inadequate response to disease-modifying antirheumatic drugs[J]. Arthritis Rheum, 2012, 64(3): 617–629. DOI:10.1002/art.33383 |
| [12] | TANAKA Y, TAKEUCHI T, YAMANAKA H, et al. Efficacy and safety of tofacitinib as monotherapy in Japanese patients with active rheumatoid arthritis: a 12-week, randomized, phase 2 study[J]. Mod Rheumatol, 2015, 25(4): 514–521. DOI:10.3109/14397595.2014.995875 |
| [13] | VAN VOLLENHOVEN R F, FLEISCHMANN R, COHEN S, et al. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis[J]. N Engl J Med, 2012, 367(6): 508–519. DOI:10.1056/NEJMoa1112072 |
| [14] | BURMESTER G R, BLANCO R, CHARLES-SCHOEMAN C, et al. Tofacitinib (CP-690, 550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial[J]. Lancet, 2013, 381(9865): 451–460. DOI:10.1016/S0140-6736(12)61424-X |
| [15] | TANAKA Y, SUZUKI M, NAKAMURA H, et al. Phase Ⅱ study of tofacitinib (CP-690, 550) combined with methotrexate in patients with rheumatoid arthritis and an inadequate response to methotrexate[J]. Arthritis Care Res (Hoboken), 2011, 63(8): 1150–1158. DOI:10.1002/acr.20494 |
| [16] | DARNELL J E JR, KERR I M, STARK G R, et al. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins[J]. Science, 1994, 264(5164): 1415–1421. DOI:10.1126/science.8197455 |
| [17] | O'SHEA J J, PLENGE R. JAK and STAT signaling molecules in immunoregulation and immune-mediated disease[J]. Immunity, 2012, 36(4): 542–550. DOI:10.1016/j.immuni.2012.03.014 |
| [18] |
杨智, 张先龙. JAK3抑制剂托法替布治疗类风湿关节炎研究进展[J].
国际骨科学杂志, 2013, 34(5): 326–328.
YANG Z, ZHANG X L. Research progress of JAK3 inhibitor tofacitinib on rheumatoid arthritis[J]. Int J Orthop, 2013, 34(5): 326–328. DOI:10.3969/j.issn.1673-7083.2013.05.006 |
| [19] |
王士伟, 谭初兵, 徐为人. 新型类风湿关节炎治疗药物托法替尼[J].
中国新药杂志, 2013(14): 1607–1609.
WANG S W, TAN C B, XU W R. Tofacitinib, a new drug for the treatment of rheumatoid arthritis[J]. Chin J New Drug, 2013(14): 1607–1609. |
| [20] |
刘雪涛, 李庆. 类风湿性关节炎治疗药物进展[J].
现代生物医学进展, 2015, 15(6): 1171–1173.
LIU X T, LI Q. Research Progress for Rheumatoid Arthritis Drugs[J]. Prog Mod Biomed, 2015, 15(6): 1171–1173. DOI:10.13241/j.cnki.pmb.2015.06.043 |
| [21] |
中华医学会风湿病学分会. 类风湿关节炎诊断及治疗指南[J].
中华风湿病学杂志, 2010, 14(4): 265–270.
Chinese Rheumatology Branch of Chinese Medical Association. Rheumatoid arthritis diagnosis and treatment guidelines[J]. Chin J Rheumatol, 2010, 14(4): 265–270. DOI:10.3760/cma.j.issn.1007-7480.2010.04.014 |
| [22] | BERGRATH E, GERBER R A, GRUBEN D, et al. Tofacitinib versus biologic treatments in moderate-to-severe rheumatoid arthritis patients who have had an inadequate response to nonbiologic DMARDs: systematic literature review and network meta-analysis[J]. Int J Rheumatol, 2017, 2017: 8417249. DOI:10.1155/2017/8417249 |



