2. 610500 成都,成都医学院:发育与再生四川省重点实验室
2. Sichuan Provincial Key Laboratory of Development and Regeneration, Chengdu Medical College, Chengdu, Sichuan Province, 610500, China
帕金森病(Parkison’s disease,PD)开始阶段就会出现突触退行性改变,投射到纹状体的突触比黑质神经元减少更严重。多巴胺神经元由突触开始的逆行性死亡被认为在PD初期起了决定性的作用,才会导致之后PD进程的推进。Dynactin是轴突逆行轴浆运输关键蛋白,通过对家族性PD患者的基因分析,发现杂合变异体dynactin与该疾病发生的相关性高。敲除dynactin可造成小鼠胚胎期死亡。敲低dynactin后,会减少逆向运输,dynactin突变体可以造成严重的PD症状。更重要的是dynactin的表达量会随着年龄增长而增长,但在PD患者大脑中的dynactin表达却会出现显著降低[1]。所以,从降低大脑中dynactin的表达量入手,建立模拟衰老PD模型是一个很好的研究方向。mycalolide B(MB)是一种特异性抑制剂,能有效地抑制逆行运输的关键因子dynactin的产生[2]。而斑马鱼作为很好的神经科学模式动物,有易于繁殖、生长周期短、与脊椎动物包括人类相似的神经发育等特点。目前,已在斑马鱼中鉴定出PD相关的基因(如DJ-1、LRRK2、PARKIN和PINK1)。1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(1-Methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine,MPTP)能诱导PD模型多巴胺水平下降以及行为上的缺陷。早期的研究表明用MPTP处理幼鱼可以导致vDC区域的多巴胺神经元明显减少[3]。MPTP模型的缺点是不能造成一个路易士小体累积[4],该模型在一定程度上并不能类比真实的PD患者。所以,学者们一直尝试构建一个更接近人群发病特点的动物模型。MB造成的PD模型相比MPTP可能的优点为:①更能结合机体衰老过程;②MPTP不能造成路易小体的形成,而dynactin突变可以造成路易小体形成;③MPTP造成线粒体紊乱,而通过影响dynactin敲低形成的PD模型,可能和线粒体无关[5]。所以,本研究尝试使用动物模型构建的常规手段,从生存率、致死浓度、有效浓度、形态学和行为学等不同方面对可能产生适宜模型的各浓度梯度MB组样本进行系统评估,旨在为PD疾病研究奠定模型基础。
1 材料与方法 1.1 动物模型的制备所用斑马鱼为Vmat2-GFP转基因斑马鱼(中科院上海神经科学研究所杜久林教授赠予),于28 ℃下在北京爱森公司净水系统中培养1个月以上,光照:黑夜比例为14 :10,雌雄分别饲养5~7 d,交配前1 d以1 :1的雌雄性成熟斑马鱼配对,交配当日清晨光亮10 min内推出隔板,交配。受精1 h内收集胚胎,剔除死胚。同亲代斑马鱼单次产卵200~300枚,简单随机化分为7组:①对照组:0.2%DMSO处理;②MB10组:10 μg/L MB处理;③MB20组:20 μg/L MB处理; ④MB40组:40 μg/L MB处理;⑤MB80组:80 μg/L MB处理;⑥MB160组:160 μg/L MB处理;⑦MPT P组:200 μmol/L MPTP处理,每组30枚卵。培养在28 ℃培养箱中用于后续实验。
1.2 主要试剂及仪器Mycalolide B(日本Wako公司),MPTP(美国Sigma公司),抗体synuclein (德国SYSY公司,128 002),抗体Dynactin(美国OriGene公司,TA340044),抗体GAPDH(英国Abcam公司,ab181602)。使用仪器包括Olympus FV1000激光共聚焦显微镜和Olympus SZX16体视荧光显微镜。
1.3 斑马鱼发育形态观察在受精后24、48、72、96、120 h观察各组胚胎,用解剖显微镜观察胚胎固缩、心包水肿、卵黄吸收时间及脊椎、短尾畸形等[6]。计算生存率和孵化率。用0.003% (200 μmol/L)褪黑素(propylthiouracil,PTU)处理受精24 h胚胎,抑制黑色素生成。采用激光共聚焦显微镜观察间脑Vmat2-GFP斑马鱼神经元生长。采用synuclein抗体免疫荧光染色观察每组收集的15~40枚胚胎,其中一抗按1 :200稀释,荧光二抗按1 :600稀释。
1.4 斑马鱼行为学实验 1.4.1 运动速率实验把对照组、MB10组、MB20组、MB40组及MPTP组斑马鱼(n=30)放入90 mm方格垫底的透明培养皿中,适应环境5 min后,测量机械刺激(受精后4 d)或自由活动5 min的运动距离(受精后5、6 d),整个过程使用顶置摄像机拍摄5 min,分析斑马鱼游泳样式、距离,统计描点,并计算时间速率。
1.4.2 明暗室实验将受精后5~7 d的对照组、MB40组、MPTP组斑马鱼(n=30)置于明暗室各半的培养皿中(可在明暗室间自由活动),适应20 min,用顶置摄像头拍摄8 min,分析各组斑马鱼在明暗室停留时间,计算各组斑马鱼在明室所待的百分比(明室时长/总时长)。
1.5 荧光定量PCR(quantitative real-time PCR, qRT-PCR)检测采用TRNzol试剂提取对照组、MB40组、MPTP组斑马鱼(n=80)总RNA,通过NanoDrop2000检测RNA浓度后,取1 μg mRNA反转录成cDNA。PCR反应程序:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸15 s,循环数40。qRT-PCR引物及其序列见表 1。各组实验最少重复3次。mRNA的相对表达量使用△△Ct法计算。
| 引物 | 序列 | 产物大小(bp) |
| DJ-1 | 上游:5′-CCTGCTGTGAAAGAGGTGTTG-3′ | |
| 下游:5′-ACTGTGCTGCCATATGCAATAC-3′ | 223 | |
| PARKIN | 上游:5′-GAGGAGTTTCACGAGGGTCC-3′ | |
| 下游:5′-TGAGTGGTTTTGGTGATGGTC-3′ | 243 | |
| LRRK2 | 上游:5′-GGATCTGTCACAGATTGGTG-3′ | |
| 下游:5′-CTAGTGGAATATCTGCGGAC-3′ | 261 | |
| PINK1 | 上游:5′-GGCAATGAAGATGATGTGGAAC-3′ | |
| 下游:5′-TTGTGGGCATGAAGGAACTAAC-3′ | 251 | |
| β-actin | 上游:5′-TGGCAAAGGGAGGTAGTTG-3′ | |
| 下游:5′-GTGAGGAGGGCAAAGTGG-3′ | 232 |
1.6 Western blot检测
使用裂解液于冰上裂解对照组、MB40组、MPTP组(n=80)斑马鱼。采用BCA法测定蛋白浓度,按体积加入5×上样缓冲液,95 ℃水浴加热5 min。Western blot检测具体操作如下:将提取蛋白进行聚丙烯酰胺凝胶电泳(100 V)后,转移至PVDF膜上,封闭,加一抗(1 :500~1 :1 000) 4 ℃孵育过夜,加二抗(1 :3 000)37 ℃孵育2 h,显色检测并使用化学发光成像采集图片。各组实验最少重复3次。使用Image J软件测定、分析各条带灰度值,其与内参的灰度值比值表示蛋白含量。
1.7 统计学分析采用Sigma Stat 3.5标准化计算指南,50%有效作用浓度(50% effective concentration,EC50)和50%致死浓度(50% lethal concentration,LC50)为统计曲线图50%取点位置值(Origin8)。采用Graphpad 5统计软件,采用双因素方差分析时间、浓度影响,组间比较采用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 MB与MPTP致斑马鱼胚胎(幼鱼)存活率及孵化效率下降存活率统计结果显示:与对照组相比,在受精后24 h内,MB160组达到全数致死量,对照组在24 h内自然死亡率<10%(表 2)。MB80组死亡率与时间成正比,72 h后畸形严重,游泳运动障碍明显;孵化期即受精后72~96 h未有幼鱼死亡;96 h后逐渐死亡,并在120 H死亡率最高。对照组胚胎受精后48 h开始孵化,72 h完成。MB10、MB20、MB40、MB80组均有不同程度孵化困难,72 h大量胚胎未孵化,MB10组孵化率为(11.1±5.4)%、MB20组为(27.2±3.4)%、MB40组为(34.8±9.1)%、MB80组为(58.3±7.2)%;96 h各组胚胎孵化均完成,MB造成胚胎卵化延迟但不造成死亡样本产生的情况,可能与胚胎畸形、出膜动力降低有关(图 1)。另一方面,由于持续性运动缓慢,导致MB80组120 h出现幼鱼死亡。与MPTP组相比,MB20、MB40组存活率及孵化效率均较为相似(表 2)。
| 组别 | 受精后24 h | 受精后48 h | 受精后72 h | 受精后96 h | 受精后120 h |
| 对照组 | 90.9±1.3 | 90.9±1.3 | 90.9±1.3 | 90.9±1.3 | 90.9±1.3 |
| MB10组 | 88.6±1.5 | 78.6±1.9d | 78.6±1.9a | 78.6±1.9a | 78.6±1.9a |
| MB20组 | 83.5±1.1a | 71.6±1.5ad | 71.6±1.5a | 64.2±2.5ac | 64.2±2.5a |
| MB40组 | 66.1±4.5b | 66.1±4.5b | 66.1±4.5b | 66.1±4.5b | 56.8±6.1bc |
| MB80组 | 74.2±9.5b | 58.7±5.3bd | 58.7±5.3b | 58.3±4.9b | 7.6±7.2bd |
| MB160组 | 8.1±5.1b | 0bc | 0b | 0b | 0b |
| MPTP组 | 87.9±3.8 | 86.4±3.6 | 83.9±4.7a | 80.9±5.3a | 64.8±18.6ad |
| a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,d:P<0.01,与受精后24 h比较 | |||||
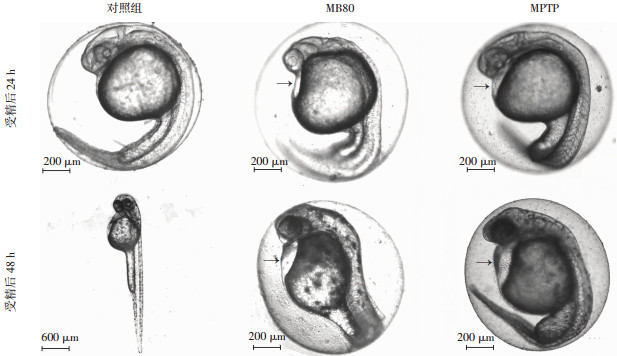
|
| 图 1 各组斑马鱼发育变化的大体形态学观察 |
2.2 MB与MPTP致斑马鱼发育异常
在斑马鱼发育过程中,与对照组相比,MB40、MB80、MB160组在受精后24 h出现明显的发育迟缓及畸形,统计EC50半数致发育迟缓的MB浓度为33.4 μg/L。72 h统计MB10、MB20、MB40和MB80浓度梯度下心包水肿情况,EC50半数致心包水肿浓度为40.0 μg/L,MPTP组(81.0±5.6)%出现心包水肿、尾部畸形。96 h统计幼鱼畸形率,计算得到MB处理EC50半数致畸形浓度为50.3 μg/L,MPTP组尾部畸形率达到(64.3±2.6)%。其中MB80组相对于对照组几乎全部发育迟缓2 h左右,且胚胎内出现尾部弯曲畸形、脊柱僵直畸形(图 1)。MPTP组和MB处理组斑马鱼都出现游泳姿态异常,特征性表现为平衡失态、震颤,可能由脊椎畸形、肌张力增高、心包水肿造成,且MB处理浓度在26.9 μg/L即有半数出现。MB处理组的LC50逐日降低,分别为108.2(受精后1 d)、80.0(受精后2 d)、80.0(受精后3 d)、26.2 μg/L(受精后4 d)。
2.3 MB与MPTP致斑马鱼运动能力减弱MB各组和MPTP组孵出卵壳困难,孵出后再次出现死亡峰。机械刺激后,幼鱼游泳速率降低,自由活动速率降低(图 2A)。胚胎发育到受精后4 d不会自由活动,对机械刺激和光刺激都有良好反应。对照组机械刺激后在水上层游动,但MB20及以上浓度组、MPTP组均对机械刺激反应迟钝,表现为不正常的游泳姿态、平衡欠失、靠近器皿底部游动。机械刺激实验统计结果可见:对照组运动速度与MB10组前30 s比较,差异无统计学意义(P>0.05);而60 s后,与对照组相比,其他组斑马鱼出现有不同程度的运动速率下降(P<0.05,图 2B),提示斑马鱼运动耐力减弱。
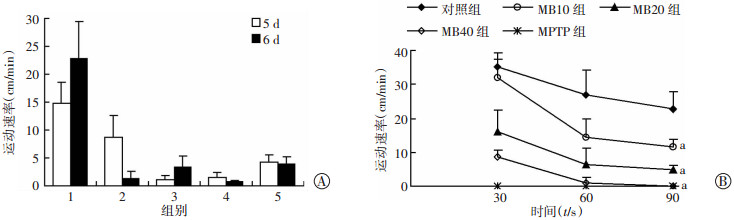
|
|
1:对照组;2:MB10组;3:MB20组;4:MB40组;5:MPTP组;a:P<0.01,与对照组比较 A:各组自由运动速度;B:各组受机械刺激后运动速率 图 2 各组斑马鱼行为学变化 |
使用双因素方差分析各组自由运动的速度数据发现:MB各处理组自由运动速度受药物影响显著(P<0.01),不受时间单因素影响(P=0.797 9),受时间与药物双因素影响(P<0.01),证明时间上有累积;其中MB10组不受时间影响,MB20组和MB40组都受到时间和浓度双因素影响,表现为自由活动速率明显减少;MPTP组受MPTP影响(P<0.01),表现为自由活动速率显著降低,不受单因素时间(P=0.080 4)或药物、时间双因素影响(P=0.259 7)。
斑马鱼受精后5 d进行明暗室实验,连续观察3 d,发现相对于对照组,MB40组在明室所待时间百分比差异无统计学意义(P>0.05),说明MB40组并未造成斑马鱼焦虑或抑郁。而MPTP组相对于对照组、MB40组,在明室所待时间百分比明显减少[(49.8± 8.9) % vs (98.0±2.1)%、(96.2±4.7)%,P<0.01]。
2.4 MB导致Vmat2阳性神经元减少及synuclein沉积Vmat2-GFP转基因斑马鱼标记包括多巴胺神经元在内的单胺类神经元,在斑马鱼腹侧间脑,GFP标记Vmat2神经元类似人类的“黑质区”,可在活体下观察多巴胺神经元状态。使用激光共聚焦显微镜观察受精后3 d胚胎,MB40组间脑Vmat2荧光统计量相当于对照组的(46.7±0.2)%,MPTP组相当于对照组的(38.8±0.1)%,说明MB40组和MPTP组较对照组幼鱼多巴胺神经元数量明显减少(P<0.01,图 3A)。
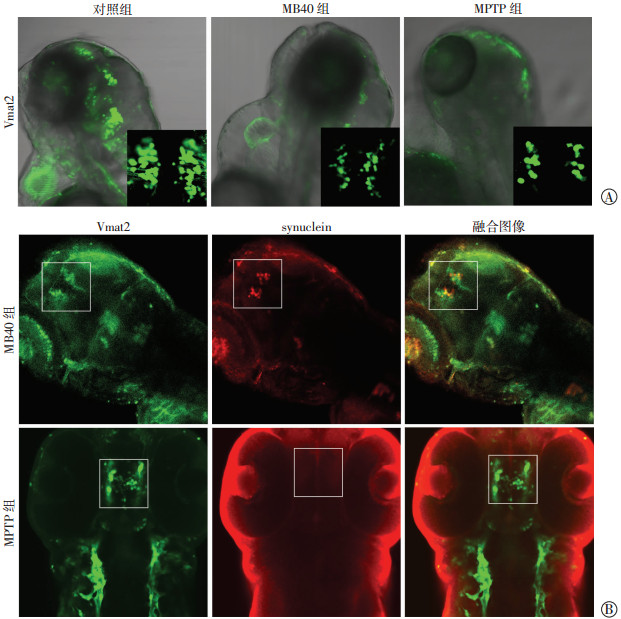
|
| A:受精后3 d各组Vmat2表达;B:免疫荧光检测受精后3 d各组synuclein蛋白表达方框显示间脑观察区;激光共聚焦显微镜×20,右下角框×60 图 3 激光共聚焦显微镜观察Vmat2-GFP转基因斑马鱼间脑神经元 |
为了观察synuclein是否在模型中聚集,使用synuclein抗体进行免疫荧光染色,发现MB40组斑马鱼中有synuclein的沉积,其中明显沉积的占(20.2±4.1)%,并在间脑区域与GFP标记的Vmat2神经元重合。而MPTP组并未找到synuclein阳性标记物(图 3B)。qRT-PCR检测PD相关基因表达量(图 4A),与对照组比较,MB40组DJ-1和PARKIN表达差异明显(P<0.05),MPTP组DJ-1、LRRK2、PINK1表达差异明显(P<0.05)。Western blot检测结果显示MB40组dynactin较对照组和MPTP组明显减少[(0.4±0.1) vs (1.1±0.2)、(1.4±0.2),P<0.05,图 4B]。
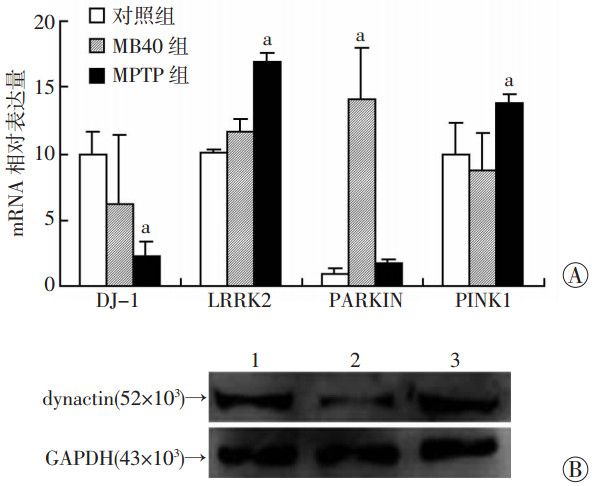
|
| 1:对照组;2:MB40组;3:MPTP组;a:P<0.05,与对照组、MPTP组比较 图 4 PD相关基因DJ-1、LRRK2、PARKIN、PINK1 mRNA(A)和dynactin蛋白(B)的表达 |
3 讨论
20世纪80年代在松鼠猴注射MPTP获得PD模型,陆续应用到其他生物模式动物,现成为PD的主流建模药物。因为流行病学调查中发现PD患者反复摄入或接触MPTP物质的概率极低,以及利用MPTP建模具有不能造成synuclein沉积等缺点[6],所以迫使我们需要找到另一种建模方式进行PD机制的研究。使用MB建模不但对多巴胺能神经元有影响,也会产生synuclein聚集。这些有利的证据提示采用MB建模可能更有利于研究PD的发病机制。
本研究结果显示:在形态学和行为学方面,MB各处理组和MPTP组都有相似症状,表现为脊柱畸形、心脏水肿、平衡失态等症[7];斑马鱼的形态学改变可能和MB的致突变性和细胞毒性有关,其平衡失态和神经毒性有关[8]。行为学上异常,如游泳平衡失态、震颤、僵直、运动速率减慢和PD症状相似[9-11]。在其他方面,本研究中MB处理组表现为孵化推迟和出生后再次出现死亡高峰,综合其他运动症状分析,其可能由幼鱼运动能力减弱造成。明暗室实验中没有找到MB与焦虑、抑郁的证据,这可能提示与PD临床上晚期才会出现情志障碍的症状有关[12]。在病理学方面结果显示:与对照组相比,MB40组与MPTP组间脑神经元数量都有明显减少,且MB40组表现为synuclein沉积。因为多巴胺神经元减少被认为是PD最重要的病理依据[13],而在Vmat2-GFP转基因斑马鱼腹侧间脑,GFP标记Vmat2神经元类似人类的“黑质区”,所以间脑神经元的减少提示:MB能造成PD相似病理改变;有别于MPTP建模不能造成synuclein沉积的缺点[6],使用MB建模的斑马鱼能产生synuclein的沉积。
与其他模型相比,MB建模的优势是其能够运用于PD的机制研究,特别是与dynactin有关的机制研究。因为MB作为dynactin的特异性抑制剂[2],能模拟生理状态下dynactin的变化,即dynactin在老年人大脑中表达增加[14],而在PD患者脑部却降低这一变化[1]。其造成PD症状机制可能和dynactin受到抑制、细胞逆行轴浆运输受到阻止、产生多巴胺神经元功能代谢紊乱最终造成神经元死亡有关[2]。也有可能是dynactin受抑制后影响了其在有丝分裂中的作用,造成神经元的寿命减短[15]。通过对家族性PD患者的基因分析,发现杂合变异体dyncatin与疾病发生有高相关性[16]。dynactin全敲小鼠会在胚胎期死亡,敲降dynactin会造成逆向运输障碍[17],从而导致细胞产生caspase-8相关自噬,最终走向死亡[5]。dynactin突变体可以造成严重的PD症状[18],甚至纹状体胶质细胞变性[19]。以上dynactin与PD的高相关性提示应用MB建立PD模型的必要性。
综上所述,本研究利用MB成功构建了斑马鱼PD模型。推荐MB效应浓度在33.4~50.3 μg/L可得到较好的建模样本,所建模型很好地表现PD症状和病理改变。该模型的局限在于MB效应浓度区间较小,作为新药的运用时间较短,有待于在相关领域的应用研究进一步验证模型的可靠性。
| [1] | GUSTAVSSON E K, TRINH J, GUELLA I, et al. DCTN1 p.K56R in progressive supranuclear palsy[J]. Parkinsonism Relat Disord, 2016, 28: 56–61. DOI:10.1016/j.parkreldis.2016.04.025 |
| [2] | CAVOLO S L, ZHOU C, KETCHAM S A, et al. Mycalolide B dissociates dynactin and abolishes retrograde axonal transport of dense-core vesicles[J]. Mol Biol Cell, 2015, 26(14): 2664–2672. DOI:10.1091/mbc.e14-11-1564 |
| [3] | ANICHTCHIK O V, KASLIN J, PEITSARO N, et al. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine[J]. J Neurochem, 2004, 88(2): 443–453. DOI:10.1111/j.1471-4159.2004.02190.x |
| [4] | KIM E K, CHOI E J. Pathological roles of MAPK signaling pathways in human diseases[J]. Biochim Biophys Acta, 2010, 1802(4): 396–405. DOI:10.1016/j.bbadis.2009.12.009 |
| [5] | ISHIKAWA K, SAIKI S, FURUYA N, et al. P150glued-associated disorders are caused by activation of intrinsicapoptotic pathway[J]. PLoS ONE, 2014, 9(4): e94645. DOI:10.1371/journal.pone.0094645 |
| [6] | BEAL M F. Experimental models of Parkinson's disease[J]. Nat Rev Neurosci, 2001, 2(5): 325–334. DOI:10.1038/35072550 |
| [7] | SALLINEN V, TORKKO V, SUNDVIK M, et al. MPTP and MPP+ target specific aminergic cell populations in larval zebrafish[J]. J Neurochem, 2009, 108(3): 719–731. DOI:10.1111/j.1471-4159.2008.05793.x |
| [8] | CHADDERTON L, KELLEHER S, BROW A, et al. Testing the efficacy of rotenone as a piscicide for New Zealand pest fish species[C]// Managing Invasive Freshwater Fish in New Zealand. Proceedings of a Workshop Hosted by Department of Conservation, Hamilton, New Zealand, May 10-12, 2001. |
| [9] | LAM C S, KORZH V, STRAHLE U. Zebrafish embryos are susceptible to the dopaminergic neurotoxin MPTP[J]. Eur J Neurosci, 2005, 21(6): 1758–1762. DOI:10.1111/j.1460-9568.2005.03988.x |
| [10] | BRETAUD S, LEE S, GUO S. Sensitivity of zebrafish to environmental toxins implicated in Parkinson's disease[J]. Neurotoxicol Teratol, 2004, 26(6): 857–864. DOI:10.1016/j.ntt.2004.06.014 |
| [11] | MCKINLEY E T, BARANOWSKI T C, BLAVO D O, et al. Neuroprotection of MPTP-induced toxicity in zebrafish dopaminergic neurons[J]. Brain Res Mol Brain Res, 2005, 141(2): 128–137. DOI:10.1016/j.molbrainres.2005.08.014 |
| [12] | TAGLIAFERRO P, BURKE R E. Retrograde axonal degeneration in parkinson disease[J]. J Parkinsons Dis, 2016, 6(1): 1–15. DOI:10.3233/JPD-150769 |
| [13] | POEWE W, SEPPI K, TANNER C M, et al. Parkinson disease[J]. Nat Rev Dis Primers, 2017, 3: 17013. DOI:10.1038/nrdp.2017.13 |
| [14] | ABOUD O, PARCON P A, DEWALL K M, et al. Aging, Alzheimer's, and APOE genotype influence the expression and neuronal distribution patterns of microtubule motor protein dynactin-P50[J]. Front Cell Neurosci, 2015, 9: 103. DOI:10.3389/fncel.2015.00103 |
| [15] | DEWEY E B, JOHNSTON C A. Diverse mitotic functions of the cytoskeletal? cross-linking protein Shortstop suggest a role in Dynein/Dynactin activity[J]. Mol Biol Cell, 2017, 28(19): 2555–2568. DOI:10.1091/mbc.E17-04-0219 |
| [16] | GIRI A, GUVEN G, HANAGASI H, et al. PLA2G6 mutations related to distinct phenotypes: A new case with early-onset parkinsonism[J]. Tremor Other Hyperkinet Mov(NY), 2016, 6: 363. DOI:10.7916/D81G0M12 |
| [17] | CRONIN M A, SCHWARZ T L. The CAP-Gly of p150: one domain, two diseases, and a function at the end[J]. Neuron, 2012, 74(2): 211–213. DOI:10.1016/j.neuron.2012.04.003 |
| [18] | LAZARUS J E, MOUGHAMIAN A J, TOKITO M K, et al. Dynactin subunit p150(Glued) is a neuron-specific anti-catastrophe factor[J]. PLoS Biol, 2013, 11(7): e1001611. DOI:10.1371/journal.pbio.1001611 |
| [19] | BRAUNSTEIN K E, ESCHBACH J, R NA-V R S K, et al. A point mutation in the dynein heavy chain gene leads to striatal atrophy and compromises neurite outgrowth of striatal neurons[J]. Hum Mol Genet, 2010, 19(22): 4385–4398. DOI:10.1093/hmg/ddq361 |



