2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院中西医结合科
2. Department of Integrated Chinese and Western Medicine, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
类风湿关节炎(rheumatoid arthritis,RA)是一种病因未明的,以侵犯小关节为主要特征的慢性、多系统性自身免疫疾病,在全球发病率0.5%~1%,女性发病率为男性的2~4倍[1]。因类风湿关节炎患者头颅常规磁共振(magnetic resonance imaging,MRI)扫描多为阴性,少有研究者关注类风湿关节炎的神经损害。近期一篇Meta分析揭示RA患者较其他人群更易罹患痴呆[2],有研究证明RA患者认知功能有明显的下降,甚至会影响RA患者的日常功能[3]。这提示RA患者可能存在有大脑微结构的改变,同时这些改变可能与患者的日常功能及认知状态存在一定相关。本研究利用Freesurfer软件,基于表面形态学分析方法(surface-based morphometry,SBM)探讨RA患者脑皮层厚度及表面积的改变,采用回归分析与脑区改变相关的认知因素。
1 资料与方法 1.1 研究对象收集2016年10月至2017年5月本院中西医结合科确诊为RA的患者50例作为RA组。入组标准:①符合2010年美国风湿病学会及欧洲抗风湿病联盟(EULAR/ACR)类风湿关节炎的分类标准[4];②年龄20~55岁;③右利手;④能配合认知功能测试;⑤知情同意。排除标准:①合并其他免疫系统疾病;②常规MRI扫描提示脑器质性损伤、患有感染性疾病、其他慢性躯体疾病(糖尿病、心血管疾病等);③有精神药物使用、药物依赖、酗酒、明显的药物不良反应等病史者;④MRI扫描禁忌,如幽闭恐惧症、有义齿等金属异物干扰图像质量者。
招募同期年龄、性别、受教育程度相匹配的健康志愿者40例作为对照组。纳入者本人同意且自愿参与本试验。
本研究经陆军军医大学(第三军医大学)第一附属医院伦理委员会审批通过(2013年3月)。
1.2 方法 1.2.1 临床资料采集收集研究对象的姓名、性别、年龄、受教育程度、患病时长、职业、既往史等,用疾病活动性评分(disease activity score, DAS28),健康评定问卷(health assessment questionnaire, HAQ)对患者的病情进行评价。
1.2.2 认知功能评价采用中文版的蒙特利尔认知评价量表(Montreal cognitive assessment,MoCA)及简易精神状态评价量表(mini-mental state examination,MMSE),由于MoCA较MMSE具有更高的敏感性,因此将MoCA包含的8个认知子项目单独记分,共30分,得分越高认知功能越好。
1.2.3 MRI数据采集采用西门子3.0T磁共振(Tim Trio,Siemens),在头颅12通道标准线圈内完成扫描。扫描时受试者仰卧,安静闭眼,使用橡皮塞降低噪声。采用常规T1WI、T2WI及Flair扫描,排除患者大脑中存在的器质性病变。所有受试者采用三维磁化准备梯度回波序列行高分辨率3D-T1WI结构相扫描, 扫描参数:TR=1 900 ms,TE=2.52 ms,翻转角90°,层厚1 mm,FOV=256 mm×256 mm,大小为1 mm3,每位受试者共扫描图像176层。
1.2.4 图像数据处理采用哈佛大学麻省总医院开发的Freesurfer软件[5](version 5.3.0,https://surfer.nmr.mgh.harvard.edu/)进行图像后处理。经过自动化标准处理流程后,得到每个受试者各个脑区的皮层形态学特征性数据。
1.3 统计学分析采用SPSS 23.0统计软件,数据以x±s表示,两组年龄、受教育程度比较采用t检验;认知得分比较用Mann-Whitney U检验;性别采用卡方检验,检验水准:α=0.05。图像分析采用Freesurfer软件,利用一般线性模型(general linear model, GLM)评估全脑皮质表面各点皮层厚度及表面积差异,通过Monte Carto Null-Z Simulation(蒙特卡洛模拟)对为未校正P<0.01的点进行多重比较校正,计算校正后的P值(cluster-wise P value, CWP),CWP<0.05即为两组间差异有统计学意义,提取受检者有差异的皮层厚度或表面积数值,采用回归模型方法,控制患者年龄、性别、受教育程度及病程,评估认知功能与皮层形态学改变间存在的联系,探索与皮层形态学改变相关的因素。
2 结果 2.1 两组一般情况及认知功能的评估两组性别、年龄、受教育程度等一般资料比较差异无统计学意义(P>0.05,表 1),具有可比性。评价RA组认知情况的MMSE评分、MoCA总分均低于对照组,同时MoCA子项显示患者在视空间执行能力、注意、语言、延迟回忆及定向功能评分均低于对照组(P<0.05,表 2)。
| 组别 | n | 年龄(岁) | 性别(男/女) | 受教育年限(年) | DAS28 | HAQ | 病程(年) |
| RA组 | 50 | 44.82±6.35 | 6/44 | 9.86±3.13 | 5.43±1.45 | 17.30±5.54 | 6.61±6.05 |
| 对照组 | 40 | 44.85±6.28 | 6/34 | 9.75±3.36 | - | - | - |
| t/χ2值 | 0.022 | 0.173 | 0.160 | ||||
| P值 | 0.98 | 0.68 | 0.87 |
| 组别 | n | MMSE | MoCA总分 | 视空间与执行能力 | 命名能力 | 注意 | 语言 | 抽象思维 | 延迟回忆 | 空间定向 |
| RA组 | 50 | 27.68±1.98 | 19.39±5.81 | 2.26 ±1.70 | 2.38±0.75 | 4.52±1.82 | 1.76 ±0.98 | 0.64 ±0.72 | 2.10 ±1.62 | 5.56 ±0.79 |
| 对照组 | 40 | 29.03±1.19 | 24.80±3.80 | 4.07±1.23 | 2.42±0.90 | 5.80±0.52 | 2.55±0.55 | 0.92±0.83 | 3.15±1.25 | 5.88±0.40 |
| Z值 | -3.19 | -3.73 | -5.04 | -0.78 | -3.83 | -3.99 | -1.64 | -3.19 | -2.32 | |
| P值 | 0.001 | <0.001 | <0.001 | 0.433 | <0.001 | <0.001 | 0.101 | 0.001 | 0.020 |
2.2 RA组与对照组形态学有差异的脑区 2.2.1 RA组与对照组大脑皮层厚度比较
采用一般线性模型,经Monte Carto多重比较校正后,RA组在多个脑区均表现为皮层厚度减低,在左侧的额下回岛盖、额上回、额中回下部,以及右侧的中央前回和海马旁回,差异有统计学意义(CWP<0.05,图 1、表 3)。
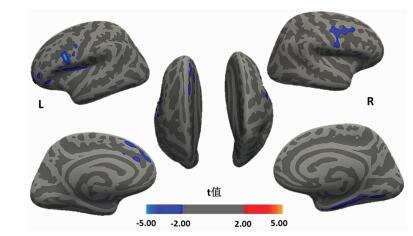
|
| 蓝色:皮层厚度减低区;L:左侧大脑半球;R:右侧大脑半球 图 1 RA组患者大脑皮层厚度改变区域 |
| 解剖结构(L/R) | MNI坐标 | 体素 (mm) |
CWP | ||
| X轴 | Y轴 | Z轴 | |||
| 皮层厚度减低脑区 | |||||
| 额下回岛盖(L) | -40.7 | 5.4 | 20.4 | 1 678.14 | <0.001 |
| 额上回(L) | -9.1 | 33.5 | 40.2 | 1 009.81 | 0.006 |
| 额中回下部(L) | -27.3 | 56.8 | -8.4 | 1 291.51 | 0.001 |
| 海马旁回(R) | 34.8 | -42.8 | -8.4 | 1 125.00 | 0.008 |
| 中央前回(R) | 53.9 | -2.8 | 42.7 | 1 208.36 | 0.004 |
| 皮层表面积减低脑区 | |||||
| 中央后回(L) | -53.1 | -22.8 | 49.9 | 1210.74 | 0.034 |
| L:左侧大脑半球;R:右侧大脑半球;经Monte Carto Null-Z Simulation多重比较校正,CWP:校正后P值 | |||||
2.2.2 RA组与对照组大脑皮层表面积比较
采用一般线性模型,经过Monte Carto多重比较校正后,RA组在中央后回的表面积较对照组缩小,差异有统计学意义(CWP<0.05,表 3)。
2.3 相关及回归分析Spearman相关性分析结果显示,HAQ评分、DAS28评分与中央前回皮层厚度相关(r=-0.366、0.43,P=0.009、0.002);左侧额上回、右侧海马旁回、右侧中央前回皮层厚度与多个认知功能评分相关(P<0.05,表 4);左侧额下回岛盖、左侧额中回下部的皮层厚度、左侧中央后回表面积与认识功能评分间无明显相关性。控制年龄、性别、受教育程度以及病程后采用多元逐步回归法分析,得到右侧海马旁回皮层厚度与延迟回忆功能呈正相关(r=0.600,β=0.097,P<0.001);中央前回皮层厚度与语言功能得分(r=0.735,β=0.101,P<0.001)及视空间执行功能得分(r=0.797,β=0.033,P=0.001)呈正相关。
| 皮层 | MMSE | MoCA总分 | 视空间执行功能 | 注意 | 语言 | 延迟回忆功能 | 定向 |
| 额上回(L) | |||||||
| r值 | 0.122 | 0.225 | 0.268 | -0.014 | 0.262 | 0.399 | 0.063 |
| P值 | 0.398 | 0.120 | 0.060 | 0.923 | 0.066 | 0.004 | 0.663 |
| 海马旁回(R) | |||||||
| r值 | 0.227 | 0.451 | 0.450 | 0.192 | 0.224 | 0.521 | 0.396 |
| P值 | 0.112 | 0.001 | 0.001 | 0.181 | 0.117 | 0.000 | 0.004 |
| 中央前回(R) | |||||||
| r值 | 0.531 | 0.651 | 0.520 | 0.380 | 0.715 | 0.428 | 0.406 |
| P值 | <0.001 | <0.001 | <0.001 | 0.006 | <0.001 | 0.002 | 0.003 |
| L:左侧大脑半球;R:右侧大脑半球 | |||||||
3 讨论
本研究测量了RA患者与健康志愿者的大脑皮层厚度及表面积,结果显示,RA组患者左侧大脑半球的额下回岛盖、额上回、额中回下部、右侧的海马旁回及中央前回皮层厚度减低,左侧中央后回的皮层表面积较正常对照组也明显减少。利用MoCA量表及MMSE量表对RA患者进行认知功能筛查,发现RA组患者在视空间执行功能、注意力、语言、延迟回忆功能均有不同程度受损。控制年龄、性别及受教育程度后,右侧海马旁回皮层厚度与延迟记忆能力呈显著相关;右侧中央后回皮层厚度与语言功能及视空间执行功能得分显著相关。
既往研究发现慢性风湿性疾病如系统性红斑狼疮患者存在有大脑不同区域的皮层厚度及体积的减少[6]或脑白质纤维束的异常萎缩[7]。而对于RA患者大脑结构改变的研究结果少且不一致,有研究认为RA患者大脑灰质改变主要在基底节区核团,推测可能与中枢对疼痛的调控有密切关系,而皮层厚度并未见明显改变[8];也有研究发现RA患者额叶灌注异常减低,额叶脑白质纤维束明显减少[9],推测与全身系统性炎症反应引起微小血管病变有关。
额上回、额中回下部、额下回岛盖、中央前回均属与额叶一部分,参与多种心理活动,记忆、注意、执行功能受损者往往会出现额叶形态学的改变[7-8]。额上回及额中回下部均属于背外侧前额叶皮层(dorsolateral prefrontal cortex, DLPFC),参与记忆的处理,尤其在工作记忆及情景记忆处理方面发挥重要作用[9],同时也参与较高级的认知功能,包括归纳、推理、信息整合、注意、执行及情绪调控等一系列活动[10-11]。既往研究发现在慢性腰背痛的疼痛过程中DLPFC灰质的体积或密度明显减少,推测脑区可能发生了神经元或者胶质细胞的凋亡,使得其对疼痛的认知调节作用得不到发挥[12]。本研究中RA患者的左侧DLPFC皮层厚度明显变薄,一方面,RA患者存在慢性的炎性改变,会引起持续的疼痛,另一方面患者长期使用治疗RA的一线药物甲氨蝶呤以及小剂量的糖皮质激素可引起轻度脑损害[13]。这些都可能导致RA患者的记忆功能及相关认知功能的损害,从而引起DLPFC脑区结构的改变。RA组延迟记忆功能、执行功能均下降,左侧额上回的皮层厚度更是与延迟记忆功能呈明显的正相关关系,从功能及大脑形态学上相互印证了RA患者存在的脑损害。额下回岛盖部及中央前回也属于额叶,额下回岛盖,属于Broca运动语言功能区的一部分,主要参与语言处理功能,包括句子加工、句子的理解及言语性工作记忆等[14]。本研究中RA患者较健康受试者在语言功能方面出现明显的功能受损,但其机制尚不清楚。中央前回支配躯体随意运动,RA患者长期的活动受限导致躯体运动神经元功能减退,是中央前回皮层变薄的主要原因,同时HAQ评分、DAS28得分均与中央前回皮层厚度有明显相关,提示中央前回皮层厚度可能反映患者功能残疾程度和疾病状态;在控制了年龄、性别、受教育程度及病程后中央前回仍与评价认知的多项得分相关。这提示中央前回不仅反映RA患者疾病症状,也是反映患者认知情况的关键脑区。中央后回属于躯体感觉皮层,持续的疼痛会引起运动行为发生改变,使躯体感觉皮层的功能链接异常,进而躯体感觉皮层的重塑,在对慢性疼痛的研究中可以看到中央后回皮层的改变[15],本研究中在RA患者身上同样发现了这一改变。
海马旁回属于边缘系统的一部分,既往研究表明海马旁回参与视空间功能及记忆功能[16],对于场景的视空间分析多是由海马旁回后部完成,海马旁回前部提供时间、空间等各种背景,将信息传入海马,与广泛的记忆网络联系,在情境记忆中尤为重要。本研究显示,额上回、海马旁回、中央前回与记忆功能得分均有明显相关,推测记忆的调节可能是通过“海马-前额叶神经回路”共同作用[17],而患者记忆功能的损害影响了回路的完整性,从而引起皮层形态学改变。对于视空间执行功能的异常,AFSHARI等[18]发现,RA、系统性红斑狼疮等多种系统性疾病大多伴随有眼部的炎症,甚至眼部的症状可能早于系统性症状的出现,对于疾病早期诊断有帮助。
综上所述,本研究结果显示,RA患者存在认知损害及广泛的皮层改变,包括皮层厚度变薄及表面积的减小,为进一步研究RA认知功能损害的神经病理提供依据。但本研究指标较为单一,并未从纤维束结构完整性及功能成像等进行分析。后续研究将从结构网络及功能网络等方面进行系统性阐述,探索RA患者中枢神经系统的改变及其可能存在的机制。
| [1] | JEFFERY R C. Clinical features of rheumatoid arthritis[J]. Medicine, 2010, 38(4): 167–171. DOI:10.1016/j.mpmed.2009.12.004 |
| [2] | Ungprasert P, Wijarnpreecha K, Thongprayoon C. Rheumatoid arthritis and the risk of dementia: A systematic review and meta-analysis[J]. Neurol India, 2016, 64(1): 56–61. DOI:10.4103/0028-3886.173623 |
| [3] | JULIAN L J, YAZDANY J, TRUPIN L, et al. Validity of brief screening tools for cognitive impairment in rheumatoid arthritis and systemic lupus erythematosus[J]. Arthritis CareRes, 2012, 64(3): 448–454. DOI:10.1002/acr.21566 |
| [4] | ALETAHA D, NEOGI T, SILMAN A J, et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J]. Arthritis Rheum, 2010, 62(9): 2569–2581. DOI:10.1002/art.27584 |
| [5] | FISCHL B. FreeSurfer[J]. Neuro Image, 2012, 62(2): 774–781. DOI:10.1016/j.neuroimage.2012.01.021 |
| [6] | BIZZO B C, SANCHEZ T A, TUKAMOTO G, et al. Cortical thickness and episodic memory impairment in systemic lupus erythematosus[J]. J Neuroimaging, 2017, 27(1): 122–127. DOI:10.1111/jon.12394 |
| [7] | ZHAO L, TAN X, WANG J, et al. Brain white matter structural networks in patients with non-neuropsychiatric systemic lupus erythematosus[J]. Brain Imaging Behav, 2017. DOI:10.1007/s11682-017-9681-3 |
| [8] | WARTOLOWSKA K, HOUGH MG, JENKINSON M, et al. Structural changes of the brain in rheumatoid arthritis[J]. Arthritis Rheum, 2012, 64(2): 371–379. DOI:10.1002/art.33326 |
| [9] | BARTOLINI M, CANDELA M, BRUGNI M, et al. Are behaviour and motor performances of rheumatoid arthritis patients influenced by subclinical cognitive impairments? A clinical and neuroimaging study[J]. Clin Exp Rheumatol, 2002, 20(4): 491–497. |
| [10] | MAKRIS N, BIEDERMAN J, VALERA EM, et al. Cortical thinning of the attention and executive function networks in adults with attention-deficit/hyperactivity disorder[J]. Cereb Cortex, 2007, 17(6): 1364–1375. DOI:10.1093/cercor/bhl047 |
| [11] | FUNAHASHI S, ANDREAU J M. Prefrontal cortex and neural mechanisms of executive function[J]. J Physiol Paris, 2013, 107(6): 471–482. DOI:10.1016/j.jphysparis.2013.05.001 |
| [12] | BALCONI M. Dorsolateral prefrontal cortex, working memory and episodic memory processes: insight through transcranial magnetic stim-ulationtechniques[J]. Neurosci Bull, 2013, 29(3): 381–389. DOI:10.1007/s12264-013-1309-z |
| [13] | MILLER E K, COHEN J D. An integrative theory of prefrontal cortex function[J]. Ann Rev Neurosci, 2001, 24(1): 167–202. DOI:10.1146/annurev.neuro.24.1.167 |
| [14] | KOENIGS M, GRAFMAN J. The functional neuroanatomy of depression: distinct roles for ventromedial and dorsolateral prefrontal cortex[J]. Behav Brain Res, 2009, 201(2): 239–243. DOI:10.1016/j.bbr.2009.03.004 |
| [15] | APKARIAN A V, SOSA Y, SONTY S, et al. Chronic back pain is associated with decreased prefrontal and thalamic gray matter density[J]. J Neurosci, 2004, 24(46): 10410–10415. DOI:10.1523/JNEUROSCI.2541-04.2004 |
| [16] | PAMUK O N, KISACIK B, PAMUK G E, et al. Do impaired memory, cognitive dysfunction and distress play a role in methotrexate-related neutropenia in rheumatoid arthritis patients? A comparative study[J]. Rheumatol Int, 2013, 33(10): 2631–2635. DOI:10.1007/s00296-013-2792-2 |
| [17] | BARKER G R, BANKS P J, SCOTT H, et al. Separate elements of episodic memory subserved by distinct hippocampal-prefrontal connections[J]. Nat Neurosci, 2017, 20(2): 242–250. DOI:10.1038/nn.4472 |
| [18] | AFSHARI N A, AFSHARI M A, FOSTER C S. Inflammatory conditions of the eye associated with rheumatic diseases[J]. Curr Rheumatol Rep, 2001, 3(5): 453–458. DOI:10.1007/s11926-996-0017-3 |



