2. 400038 重庆,陆军军医大学(第三军医大学):基础医学院生物化学与分子生物学教研室
2. Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是一种肝代谢综合征,其发病及演变机制较复杂,由多种因素共同参与,以肝脏中的脂肪积累过剩,即肝细胞脂肪变性为主要特征,其中关键影响因素之一是甘油三酯(triglyceride, TG)合成显著增加[2]。对于此疾病目前临床上尚无有效的药物治疗方案[1]。固醇调节元件结合蛋白1c(sterol regulatory element-binding protein-1c,SREBP-1c)是一种位于内质网上的膜连接蛋白,是调节脂肪合成的主要转录因子[3]。研究表明,在肥胖小鼠体内,由于肝细胞线粒体活性氧(reactive oxygen species,ROS)产生增加,促进内质网应激[4],使SREBP-1c表达增加,进而增加肝细胞脂肪酸合成代谢,在肥胖小鼠NAFLD的发生中起重要作用[5-6]。由于线粒体ROS过度产生和线粒体功能紊乱在脂代谢以及NAFLD发生中起重要作用[7],因此通过调节线粒体功能来改善脂代谢,减少体内脂肪沉积,为防治NAFLD提供了新途径[8-9]。我们课题组在前期研究中通过对七甲川花菁近红外荧光小分子进行化学结构修饰,合成了一系列新的荧光小分子,并从中筛选出一种线粒体靶向荧光小分子(IR-61),通过Nrf2和PI3K/Akt信号通路发挥改善线粒体功能、增加线粒体抗氧化能力的作用[10]。本研究通过构建高脂饮食诱导的小鼠NAFLD模型,检测肝脏TG含量以及SREBP-1c表达来验证IR-61在体内是否具有调节脂肪代谢、改善NAFLD的作用。
1 材料与方法 1.1 主要试剂TRIzol(CW0580S CWBIO)、反转录试剂盒(K1622,Thermo)、荧光定量试剂盒(RR820A,TaKaRa)、甘油三酯测试盒(A110-1,南京建成生物工程研究所)、磷酸缓冲盐溶液PBS(ZLI-9061,中杉金桥),PCR引物序列由英潍捷基(上海)贸易有限公司合成。SREBP-1c、ACC1、PPARa、CPT1抗体均为兔抗购于武汉三鹰(Proteintech)。IR-61由本实验室合成和纯化,合成方法和分子结构同前期发表文献[10]。
1.2 实验动物及分组20只6周龄雄性C57BL/6J小鼠购于第三军医大学实验动物中心,饲养于复合伤研究所实验室动物房,动物房保持22~24 ℃,白天黑夜交替节律。小鼠随机分为4组,即CD+PBS组、CD+IR-61组、HFD+PBS组、HFD+IR-61组,每组5只。前两组给予普通饮食(CD:D12450B饲料),后两组给予高脂饮食(HFD:D12492饲料),每只小鼠做独立标记。普通饮食和高脂饮食分别为含有10%脂肪热能和60%脂肪热能的啮齿动物饲料。CD+PBS组和HFD+PBS组腹腔注射PBS(11.74 g/L,pH 7.3),CD+IR-61组和HFD+IR-61组腹腔注射IR-61(于注射前用PBS稀释至100 μmol/L),按照25 μL/g剂量,每只小鼠每周注射1次,连续给药18周。所有动物饲养和实验操作遵循第三军医大学实验动物使用和照顾协会规定。
1.3 组织学检查在治疗18周时处死小鼠,取肝脏固定于4%多聚甲醛,24 h后脱水,石蜡包埋,切成3 μm厚的组织切片,按照操作规程进行HE染色,光学显微镜下观察。
1.4 肝脏和血TG检测在IR-61治疗18周后处死小鼠,称取90~110 mg肝脏于乙醇中冰浴匀浆,采用甘油三酯测试盒测量TG,操作按说明书进行,使用酶标仪(Spectrophotometer 1510),测量吸光度并计算TG浓度,并根据样本质量计算肝脏组织中TG浓度。小鼠断头取血,4 ℃过夜,1 000×g离心15 min,取上清,每个样本取2.5 μL血清加入250 μL测试液,37 ℃孵育10 min。用酶标仪测吸光度并计算血甘油三酯浓度。
1.5 Real-time PCR检测在IR-61治疗18周后处死小鼠,取肝脏,用TRIzol冰浴匀浆后提取总RNA,用反转录试剂盒于DNA合成仪(T100 Thermal Cycle, BIO-RAD)合成cDNA,用荧光定量试剂盒于PCR仪器(CFX Connect Optics Module, BIO-RAD)进行Real-time PCR测量,所有操作按照各试剂盒说明书进行。用于qRT-PCR的引物序列见表 1。亲环素蛋白A(CyclophilinA,CYC)被用作内参基因,目的基因的相对表达量用2-△△CT分析。
| 引物 | 上游引物((5′→3′) | 下游引物((5′→3′) | 片段大小(bp) |
| SREBP-1c | CTGGCACTAAGTGCCCTCAAC | GCCACATAGATCTCTGCCAGTGT | 80 |
| CyclophilinA | GCATACAGGTCCTGGCATCT | ATCCAGCCATTCAGTCTTGG | 97 |
| ACC1 | GACAGACTGATCGCAGAGAAAG | TGGAGAGCCCCACACACA | 74 |
| CPT1 | TCGGTGAGCCTGGCCT | TTGAGTGGTGACCGAGTCTG | 85 |
| PPARα | AGAGGGCTGAGCGTAGGTAA | CCTCCGATCACCCCCATTTC | 95 |
1.6 Western blot检测
IR-61治疗18周后牺牲小鼠,取肝脏提取总蛋白,用BCA法测定蛋白浓度。配平后沸水浴10 min使蛋白变性,取60 μg蛋白样品于10% SDS-PAGE凝胶中,电泳1.5 h后经转膜至PVDF膜上。常温封闭用快速封闭液封闭30 min,抗体SREBF1(SREBP-1c)、ACC1、CPT1A(CPT1)、PPARα(1 :500),β-actin (1 :1 000)于4 ℃孵育一抗过夜。TBST洗膜3次,10 min/次,于TBST中,按照1 :1 000加入二抗孵育1 h。TBST洗膜4次,15 min/次, ECL显影成像。Image J扫描灰度值,各组结果与β-actin进行比较。
1.7 统计分析采用SPSS 17.0统计软件,计量资料数据以x±s表示,采用双因素方差分析,组间两两比较用SNK法,检验水准:α=0.05。
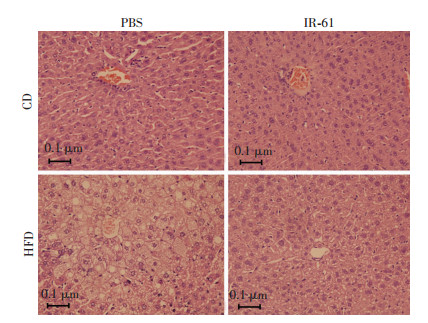
2 结果 2.1 IR-61改善肝脏的脂肪变性脂肪肝在肝组织形态学有显著变化,为明确高脂饮食是否成功构建小鼠脂肪肝模型以及IR-61是否能改善脂肪肝,取小鼠肝脏做组织切片,行HE染色。如图 1所示,肝组织切片HE染色发现CD+PBS组和CD+IR-61组小鼠肝小叶结构完整,肝细胞排列紧密成条索状,未见明显脂滴,而HFD+PBS组肝小叶不清,肝细胞重度脂肪变性,脂肪空泡成片出现,细胞质内的脂滴多为大泡型,细胞核受脂肪空泡挤压移至肝细胞边缘,符合NAFLD表现。HFD+IR-61组肝小叶结构清晰,肝细胞脂肪样变性较HFD+PBS组明显减轻,表现为少量脂肪沉积。通过切片HE染色发现IR-61可显著改善高脂饮食诱导的NAFLD。
|
| 图 1 光镜观察各组肝细胞病理变化 (HE) |
2.2 IR-61改善肝脏的TG沉积和降低血TG浓度
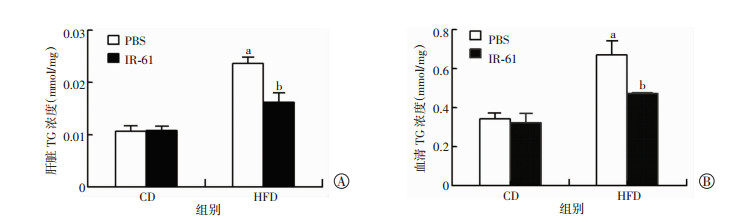
肝脏组织TG浓度是评价脂肪肝的重要指标,为进一步验证IR-61改善高脂饮食诱导的脂肪肝,取肝脏组织测量TG浓度。如图 2A所示,CD+PBS组、CD+ IR-61组、HFD+PBS组、HFD+IR-61组肝脏TG浓度分别为(0.011±0.002)、(0.011±0.002)、(0.024±0.003)、(0.016±0.004)mmol/mg,HFD+PBS组肝脏TG浓度较CD+PBS组显著升高,HFD+IR-61组较HFD+PBS组显著降低(P < 0.05),表明IR-61可以抑制高脂诱导的肝脏TG沉积。如图 2B所示,HFD+PBS组血TG浓度较CD+PBS组显著升高,HFD+IR-61组较HFD+PBS组显著降低(P < 0.05),表明IR-61可以改善高脂诱导的血TG浓度升高。
|
| a:P < 0.05,与CD+PBS组比较;b:P < 0.05,与HFD+PBS组比较 图 2 PBS或IR-61治疗18周后小鼠肝脏(A)和血清(B)TG浓度比较 (n=5) |
2.3 IR-61抑制肝脏脂肪合成
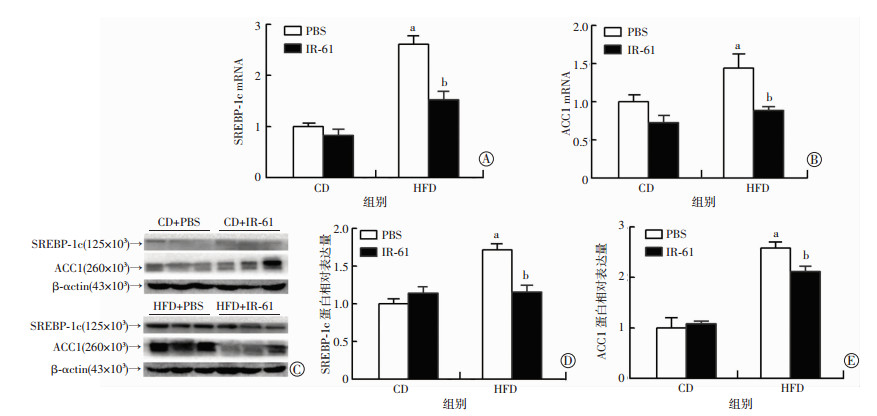
高脂饮食喂养小鼠,肝细胞脂肪合成代谢增强是导致肝脏TG过度沉积以及脂肪肝的重要原因。为探索IR-61减少肝脏TG沉积的机制,取小鼠肝脏组织检测脂肪合成相关转录因子和脂肪合成相关酶。如图 3所示,通过对脂肪合成相关转录因子SREBP-1c及脂肪合成相关酶ACC1进行Real-time PCR和Western blot检测,HFD+PBS组较CD+PBS组SREBP-1c、ACC1转录水平显著升高,而HFD+IR-61组较HFD+PBS组显著降低;说明IR-61显著降低高脂饮食诱导的SREBP-1c和ACC1表达增加,从而抑制肝脏脂肪合成(P < 0.05)。
|
|
a:P < 0.05,与CD+PBS组比较;b:P < 0.05,与HFD+PBS组比较 Real-time PCR检测肝脏脂肪合成基因SREBP-1c (A)和ACC1(B)的mRNA表达水平;Western blot检测肝脏SREBP-1c和ACC1的蛋白表达水平(C)以及SREBP-1c(D)、ACC1(E)相对β-actin表达量 图 3 Real-time PCR和Western blot检测肝脏脂肪合成基因SREBP-1c和ACC1的mRNA和蛋白表达水平 |
2.4 IR-61促进肝脏脂肪氧化
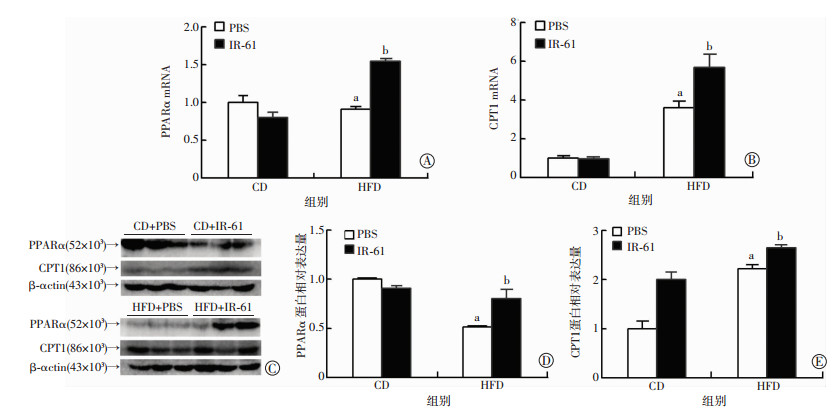
肝脏TG浓度取决于肝脏TG合成和分解,通过实验发现IR-61可抑制高脂喂养小鼠肝脏TG合成,为探索IR-61是否影响肝脏TG分解,取肝脏组织检测脂肪氧化分解相关基因。如图 4所示,通过对肝脏线粒体生成调控转录因子PPARα和脂肪氧化限速酶CPT1基因表达进行Real-time PCR和Western blot检测,HFD+IR-61组较HFD+PBS组PPARα转录水平显著升高,表明IR-61可促进高脂喂养小鼠肝脏线粒体生成。HFD+PBS组较CD+PBS组CPT1表达量显著升高,而HFD+IR-61组较HFD+PBS组更高,表明高脂喂养条件下肝脏脂肪氧化增强,IR-61进一步增强高脂喂养小鼠肝脏脂肪氧化能力(P < 0.05)。
|
|
a:P < 0.05,与CD+PBS组比较;b:P < 0.05,与HFD+PBS组比较 Real-time PCR检测肝脏线粒体生成基因PPARa(A)和脂肪氧化基因CPT1(B)的mRNA表达水平;Western blot检测PPARa和CPT1蛋白表达量(C)以及PPARa(D)和CPT1(E)相对β-actin表达量 图 4 Real-time PCR和Western blot检测肝脏线粒体生成和脂肪氧化基因PPARα和CPT1的mRNA和蛋白表达水平 |
3 讨论
近年来肥胖人数逐年增多,肥胖患者常常伴发NAFLD,严重威胁患者健康,但目前尚无有效药物防治NAFLD,因此研究治疗和改善NAFLD药物具有重要的作用和意义。已有研究表明,肥胖状态或高脂饮食下,肝细胞游离脂肪酸增多,刺激ROS产生和诱导内质网应激,进而过度激活SREBP-1c/ACC1通路,促进脂肪合成,导致肝脏脂肪沉积,造成非酒精性脂肪肝[11-13]。前期研究表明IR-61具有靶向线粒体,发挥抗氧化效应,从而减少ROS产生[10]。本实验发现在小鼠高脂模型中,肝脏脂肪酸合成相关基因SREBP-1c/ACC1的表达显著增加,与文献[3]报道一致,SREBP-1c/ACC1表达显著增加导致肝脏脂肪合成增强,是NAFLD发生的重要原因[13]。而IR-61可以有效抑制高脂诱导的SREBP-1c/ACC1的表达增加,从而抑制高脂喂养小鼠肝脏脂肪合成。
已有研究表明PPARα可调控线粒体功能,肥胖状态下肝脏PPARα表达降低与NAFLD的发生密切相关[14]。本实验发现IR-61可以显著改善高脂喂养小鼠肝脏PPARα表达降低,增加线粒体生成。CPT1是脂肪酸β氧化的限速酶,可反映肝脏脂肪酸氧化代谢水平[15],IR-61还可以促进高脂喂养小鼠CPT1表达,增加脂肪在肝脏氧化。实验表明,IR-61通过增强高脂状态下肝脏线粒体生成和脂肪酸氧化,促进肝脏脂质分解。
由于TG合成增强、分解减少,导致肝脏脂质代谢失衡、TG过度沉积,进而引发NAFLD[16]。本实验发现,IR-61可以降低高脂饮食诱导的TG过度沉积,HE染色证实IR-61可以改善高脂诱导的小鼠NAFLD。
本实验通过对高脂饮食构建的NAFLD模型小鼠进行药物干预,发现新型线粒体靶向小分子IR-61具有通过抑制肝脏脂肪合成,增强肝脏的脂肪氧化,减少肝脏TG沉积及血TG含量,改善NAFLD的作用。然而,IR-61如何调控线粒体,进而影响脂代谢的机制有待进一步研究,IR-61长期使用对机体的毒副作用有待研究。
| [1] | TOWNSEND S A, NEWSOME P N. Review article: new treatments in non-alcoholic fatty liver disease[J]. Aliment Pharmacol Ther, 2017, 46(5): 494–507. DOI:10.1111/apt.14210 |
| [2] | GAN L X, XIANG W, XIE B, et al. Molecular mechanisms of fatty liver in obesity[J]. Front Med, 2015, 9(3): 275–287. DOI:10.1007/s11684-015-0410-2 |
| [3] |
房殿亮, 宁波, 沈薇, 等. SCAP-SREBP-1c-ACC1在内质网应激状态下肝细胞脂肪变性中的作用[J].
中国生物制品学杂志, 2013, 26(10): 1409–1412.
FANG D L, NING B, SHEN W, et al. SCAP-SREBP-1c-ACC1 involves in steatosis under endoplasmic reticulum stress in hepatocytes[J]. Chin J Biol, 2013, 26(10): 1409–1412. |
| [4] | PARK J W, CHOI W G, LEE P J, et al. The novel resveratrol derivative 3, 5-diethoxy-3', 4'-dihydroxy-trans-stilbene induces mitochondrial ROS-mediated ER stress and cell death in human hepatoma cells in vitro[J]. Acta Pharmacol Sin, 2017, 38(11): 1486–1500. DOI:10.1038/aps.2017.106 |
| [5] | HERNÁNDEZ-RODAS M C, VALENZUELA R, ECHEVERRÍA F, et al. Supplementation with docosahexaenoic acid and extra virgin olive oil prevents liver steatosis induced by a high-fat diet in mice through PPAR-α and Nrf2 upregulation with concomitant SREBP-1c and NF-kB downregulation[J]. Mol Nutr Food Res, 2017, Sep 21. [Epub]. DOI: 10.1002/mnfr.201700479. |
| [6] | LIU Q, PAN R, DING L, et al. Rutin exhibits hepatoprotective effects in a mouse model of non-alcoholic fatty liver disease by reducing hepatic lipid levels and mitigating lipid-induced oxidative injuries[J]. Int Immunopharmacol, 2017, 49: 132–141. DOI:10.1016/j.intimp.2017.05.026 |
| [7] | OJO B, SIMENSON A J, O'HARA C. Wheat germ supplementation alleviates insulin resistance and cardiac mitochondrial dysfunction in an animal model of diet-induced obesity[J]. Br J Nutr, 2017, 118(4): 241–249. DOI:10.1017/S0007114517002082 |
| [8] | SAMUEL V T, SHULMAN G I. Nonalcoholic fatty liver disease as a nexus of metabolic and hepatic diseases[J]. Cell Metab, 2017, pii: S1550-4131(17): 30487–4. DOI:10.1016/j.cmet.2017.08.002 |
| [9] | FERRAMOSCA A, DI GIACOMO M, ZARA V. Antioxidant dietary approach in treatment of fatty liver: New insights and updates[J]. World J Gastroenterol, 2017, 23(23): 4146–4157. DOI:10.3748/wjg.v23.i23.4146 |
| [10] | WANG X, CHEN Z L, LUO S L, et al. Development of therapeutic small-molecule fluorophore for cell transplantation[J]. Adv Funct Mater, 2016, 26(46): 8397–8407. DOI:10.1002/adfm.201600996 |
| [11] | ENGIN A. Non-alcoholic fatty liver disease[J]. Adv Exp Med Biol, 2017, 960: 443–467. DOI:10.1007/978-3-319-48382-5_19 |
| [12] | SHARMA M, MITNALA S, VISHNUBHOTLA R K, et al. The riddle of nonalcoholic fatty liver disease: progression from nonalcoholic fatty liver to nonalcoholic steatohepatitis[J]. J Clin Exp Hepatol, 2015, 5(2): 147–158. DOI:10.1016/j.jceh.2015.02.002 |
| [13] | GUEBRE-EGZIABHER F, ALIX P M, KOPPE L, et al. Ectopic lipid accumulation: a potential cause for metabolic disturbances and a contributor to the alteration of kidney function[J]. Biochimie, 2013, 95(11): 1971–1979. DOI:10.1016/j.biochi.2013.07.017 |
| [14] | TANAKA N, AOYAMA T, KIMURA S, et al. Targeting nuclear receptors for the treatment of fatty liver disease[J]. Pharmacol Ther, 2017, 179: 142–157. DOI:10.1016/j.pharmthera.2017.05.011 |
| [15] | XU B, SHEN T, CHEN L, et al. The effect of sitagliptin on lipid metabolism of fatty liver mice and related mechanisms[J]. Med Sci Monit, 2017, 23: 1363–1370. DOI:10.12659/MSM.900033 |
| [16] | VALTOLINA C, FAVIER R P. Feline hepatic lipidosis[J]. Vet Clin North Am Small Anim Pract, 2017, 47(3): 683–702. DOI:10.1016/j.cvsm.2016.11.014 |



