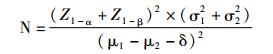儿童过敏性哮喘是儿童呼吸系统常见疾病,哮喘的发生多起始于儿童,儿童基本特点为生长与发育,体内过敏与免疫耐受均可能随着年龄的增加、环境的变化而变化,而目前儿童过敏性哮喘发病机制尚不十分透彻,对于其发病机制的研究也一直是国内外研究热点。吲哚胺2, 3双加氧酶(indoleamine 2, 3-dioxygenase, IDO)是色氨酸分解代谢途径的限速酶,IDO介导的色氨酸分解可能在过敏性疾病比如过敏性哮喘(成人)发生中起重要作用[1]。呼出气一氧化氮浓度(fractional exhaled nitric oxide, FeNO)在临床上广泛用作反映气道过敏性炎症的生物标志物。有报道显示NO可以抑制IDO的表达导致高色氨酸水平[2]。因此,本研究旨在研究IDO介导的色氨酸分解是否在儿童期的哮喘患者发病机制中就已经开始发挥了作用?其与患儿病情严重程度和FeNO水平之间是否存在联系?IDO是否能与FeNO联合检测作为临床上辅助诊断儿童过敏性哮喘的生物学标志?
1 材料与方法该研究已在中国临床试验注册中心注册通过,注册号为ChiCTR-COC-15006080;并通过西南医院伦理委员会会议审查[2014年科研第(25)号]; 入组患儿家属均签署知情同意书。
1.1 研究对象 1.1.1 样本量计算观察组从2015-2016年西南医院儿科门诊患儿中产生,总计入组5岁以上33例(该例数为通过预期差异显著性推算出)过敏性哮喘患儿(根据病情严重程度进行回顾性分级),并纳入33例同期健康体检的年龄、性别匹配的正常对照组儿童。选取患儿及对照组研究对象时考虑患儿年龄,性别等的代表性和普遍性,减少偏移,分布尽量呈正态。两组临床资料具有可比性。试验例数的选择按照两组平行对照随机区组设计两样本均数比较优效性检验计算公式计算样本量如下:
本研究观察指标为IDO活性,根据国外相关研究发现:试验组IDO活性表征值—犬尿酸含量与色氨酸含量的比值,实验组为12.8,对照组7.3(单位:%)。因此,α=0.025, β=0.1,μ1=12.8,μ2=7.3,σ12=42,σ22=12,临床及经验认为δ=3才有意义,计算得出各组样本量为29例。拟考虑到临床试验过程中病例脱落等干扰因素,本方案各组病例数定为33例。
1.1.2 入选标准 1.1.2.1 观察组患者纳入标准① 年龄大于5周岁; ②初次诊断和既往虽然被诊断但尚未按哮喘规范治疗; ③2周内未接受吸入性糖皮质激素、白三烯受体拮抗剂等治疗; ④门诊治疗随访半年后根据全球哮喘防治创议(global initiative for asthma, GINA)2016年儿童支气管哮喘诊断与防治指南中按病情严重程度分级。
1.1.2.2 哮喘诊断标准① 反复发作喘息、咳嗽、气促、胸闷,多以接触变应原、冷空气、物理、化学性刺激、呼吸道感染以及运动等有关,常在夜间和(或)清晨发作或加剧; ②发作时在双肺可闻及散在或弥漫性,以呼气相为主的哮鸣音,呼气相延长; ③上述症状和体征经抗哮喘治疗有效或自行缓解; ④除外其他疾病所引起的喘息、咳嗽、气促和胸闷; ⑤临床表现不典型者(如无明显喘息或哮鸣音),应至少具备以下1项:支气管激发试验或运动激发试验阳性; 证实存在可逆性气流受限:a支气管舒张试验阳性:吸入速效β2受体激动剂硫酸沙丁胺醇后15 min第一秒用力呼气量(FEV1)增加>12%;最大呼气流量(PEF)每日变异率(连续监测1-2周)20%。符合第1~4条或第4、5条者,可以诊断为哮喘。
1.1.2.3 儿童哮喘的严重程度分级[3]哮喘病情严重程度应依据达到哮喘控制所需的治疗级别进行回顾性评估分级,通常在控制药物规范治疗数月后进行评估。轻度持续哮喘(1分):第1级或第2级阶梯治疗方案治疗能达到良好控制的哮喘; 中度持续哮喘(2分):使用第3级阶梯治疗方案治疗能达到良好控制的哮喘。重度持续哮喘(3分):需要第4级或第5级阶梯治疗方案治疗的哮喘。
1.1.2.4 对照组入选标准同期募集儿科门诊体检的健康儿童33例,年龄和性别等均有较好的分布和代表性。排除标准:①近2周口服或静脉使用过糖皮质激素或免疫调节剂; ②合并其他免疫性疾病如结核病、系统性红斑狼疮、幼年性特发性关节炎等; ③发病4周内曾患感染性疾病,如上呼吸道感染,肺炎等; ④心肺功能衰竭者。
1.2 方法对受试对象进行完整的病史采集、肺功能检查、皮肤点刺过敏源检测、嗜酸性细胞计数(eosinophil count, EC); 外周静脉血检测。
外周血检测:①标本采集:采集受试者静脉血4 mL(肝素抗凝)。全血离心后收集血浆-80 ℃冻存。Ficoll密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell, PBMC)。②指标检测:高效色谱液相法(high performance liquid chromatography, HPLC)检测; 用犬尿氨酸浓度(μmol/L)/色氨酸浓度(μmol/L)来反映IDO活性水平。
诱导痰检测:①标本采集:采集受试者诱导痰液1次,3%高渗盐水(1.5 mL 10% Nacl+2.5 Ml 0.9% Nacl)雾化后吸痰; 诱导痰上清液保存于-70 ℃; ②指标检测:HPLC检测; 用犬尿氨酸浓度(μmol/L)/色氨酸浓度(μmol/L)来反映IDO活性水平。
FeNO测定:对受试者进行测定方法符合ATS/ERS《一氧化氮呼气测定指南》。受试者取端坐位,平静呼吸后,通过一次性滤器用嘴吸入不含一氧化氮气体(NO<5 ppb)至接近肺总量,然后立即以50 mL/s的流速匀速呼气,12岁以下儿童呼气时间为6 s,12岁以上儿童为10 s。详细讲解方法及观看演示录像后,反复测试9次仍不能完成则认为检查失败。儿童的FeNO测量均在肺功能检查之前。
1.3 统计学分析采用SPSS 18.0统计软件,多组比较前先进行正态分布检验(Kolmogorov-Smirnov和Shapiro-Wilk检验)和方差齐性检验(Levene检验),对于满足正态分布和方差齐性的组间比较资料采用独立样本t检验,实验结果用均值(95%置信区间)表示; 对于不满足正态分布的资料,计量资料均值比较采用非参数统计分析中的Mann-Whitney U检验,计数资料率的比较采用χ2检验,实验结果用中位数(四分位数间距)表示; 对于分析多组间的相关性采用多元线性回归分析中的逐步法,剔除无统计学意义自变量; 以P < 0.05认为差异有统计学意义。
2 结果 2.1 观察组及对照组临床及实验室检查特征纳入观察组的患儿共33例(5~13岁儿童,男性18例,女性15例)以及年龄及性别匹配的33名健康儿童。入组对象的临床特征见表 1。与正常对照组相比,观察组皮肤点刺试验阳性率显著升高(P < 0.001),血中嗜酸性细胞计数显著升高(P < 0.001),肺功能指标FEV 1.0/FVC%显著下降(P < 0.001),FeNO也显著升高(P < 0.001)。
| 组别 | 年龄(岁, 中位数) | 性别(男/女) | 过敏源(阳性/阴性) | 嗜酸性粒细胞 [%,均值(95%CI)] |
严重度评分 (分,中位数) |
| 观察组 | 7.4(5~9.1) | 18/15 | 23/10 | 2.97(2.662~3.285) | 1(1~1.25) |
| 对照组 | 7.0(5.75~11) | 15/18 | 7/26 | 2.20(2.03~2.38) | - |
| P值 | 0.760 | 0.606 | <0.001 | <0.001 | - |
2.2 观察组诱导痰及血中IDO活性表达均较对照组降低
过敏性哮喘患儿痰液中IDO活性水平较对照组相比有显著性降低(P < 0.001);外周血中IDO活性水平较对照组相比亦有显著性降低(P=0.001,表 1)。
2.3 诱导痰液及血中的IDO水平与FeNO水平呈负相关性诱导痰液中及血中的IDO水平均与年龄、性别、血中的嗜酸性细胞计数、哮喘严重程度之间没有显著相关性(表 2、3),与FeNO水平呈现出显著负相关关系(P < 0.05)。
| 组别 | FEV1.0/FVC [%,x±s] |
诱导痰IDO [%,均值(95%CI)] |
外周血IDO [%,均值(95%CI)] |
FeNO [均值(95%CI)] |
| 观察组 | 75.3±12.03 | 5.438(4.945~5.935) | 3.136(2.787~3.485) | 37.2(34.1~41.0) |
| 对照组 | 91.2±8.76 | 8.90(8.37~9.43) | 4.12(3.64~4.61) | 24.2(23.0~26.1) |
| P值 | <0.001 | <0.001 | 0.001 | <0.001 |
| a:过敏源阳性被定义为在12种常见的吸入性变应原中有一种以上的皮肤阳性反应,比如2种类型的尘螨,花粉,猫毛,狗毛,交链孢霉,曲霉等 | ||||
| 变量 | B | t | P值 | |
| 剔除变量 | 年龄 | -0.156 | -1.397 | 0.168 |
| 性别 | 0.035 | 0.310 | 0.758 | |
| 过敏源 | 0.101 | 0.842 | 0.403 | |
| 嗜酸性粒细胞 | 0.025 | 0.207 | 0.837 | |
| 剩余变量 | FeNO | -0.517 | -4.600 | <0.05 |
| 变量分析 | F值 | 21.160 | ||
| P值 | <0.05 | |||
| R2 | 0.267 | |||
| 调整R2 | 0.255 |
2.4 诱导痰液中IDO活性单独或联合FeNO对儿童过敏性哮喘均有预测价值
通过受试者工作特征曲线分析(表 4、图 1),我们发现单独FeNO、单独IDO以及IDO联合FeNO对儿童过敏性哮喘均有预测价值。其中IDO联合FeNO对预测儿童过敏性哮喘的敏感性和特异性均最高。
| 项目 | FeNO(ppb) | IDO (诱导痰) | FeNO联合IDO |
| 区间(95%CI) | 0.899(0.820~0.908) | 0.969(0.932~1.000) | 0.977(0.937~1.000) |
| 约登指数 | 0.667 | 0.833 | 0.900 |
| 最佳临界值 | 33.000 | 7.280 | (7.590, 28.500) |
| 真阳性率(敏感度) | 0.700 | 0.933 | 0.967 |
| 真阴性率(特异性) | 0.967 | 0.900 | 0.933 |

|
| 图 1 用单独IDO、单独FeNO、IDO与FeNO联合诊断儿童过敏性哮喘价值的ROC曲线 |
3 讨论
过敏性哮喘(哮喘)是一种以气道高反应性为特征的变态反应性炎症性疾病,Th1/Th2失衡是哮喘发病机制中的关键环节,尤其是Th2细胞发挥了重要的作用。然而近年来发现Th17及调节性T细胞(Treg)在哮喘发病中也占有重要地位[4]。
色氨酸是一种必需氨基酸,它是被人体许多细胞利用的重要氨基酸底物。越来越多的证据表明色氨酸代谢过程在变态反应疾病发生中起重要作用[1]。CIPRANDI等[5]研究证实花粉过敏患者中血浆色氨酸及代谢产物浓度较健康献血对照者明显升高; KOSITA等[6]证实在花粉过敏患者发现高基础色氨酸浓度与花粉提取物进行特异性免疫治疗低反应性相关。特异性免疫治疗的关键机制是免疫耐受,因此,有人认为色氨酸的分解代谢是免疫耐受形成重要机制之一[7]。
IDO是色氨酸分解代谢途径的限速酶,在机体免疫豁免器官大量表达,在外周免疫耐受中有重要作用,其在妊娠、器官移植及肿瘤免疫耐受的作用已成为近年研究热点。一项临床研究显示过敏症患者中血浆IDO活性明显低于正常健康个体[8]。另一项临床研究发现:在气源性致敏原暴露的哮喘患者中,没有临床症状的过敏患者血浆IDO活性比有症状的过敏患者及健康个体明显增高[9]。MANEECHOTESUWAN等[10]在轻度间歇及轻中度持续哮喘患者的诱导痰中IDO活性较低较健康人群低,但吸入糖皮质激素治疗活性明显增高,提示糖皮质激素至少部分通过上调IDO活性发挥其抗炎症作用。因此,IDO介导的色氨酸分解可能控制着过敏性疾病的发生及发展起重要作用[11]。那么,IDO介导的色氨酸分解是否在儿童期的哮喘患者发病机制中就已经开始发挥作用了尚未探明。故本研究作了大胆的尝试,结果发现外周血及诱导痰液中IDO水平在儿童哮喘患者中明显低于年龄、性别相匹配的健康儿童。提示IDO活性可抑制气道过敏反应,在儿童过敏性哮喘发病机制中可能发挥作用。
有趣的是美国胸科协会(ATS)推荐临床常用无创监测气道过敏性炎症的标志物FeNO,与IDO有密切的联系。研究早已证实NO代谢在也过敏性疾病中发挥重要作用[12]。在哮喘患者研究发现气道上皮和炎症细胞中iNOS明显增多。在非花粉与健康对照组相比,过敏性鼻炎或哮喘患者的呼出的气息已被证明含有较高的NO水平。在非花粉季节过敏性鼻炎患者呼出的NO显著升高,而在花粉季节呼出的NO将进一步增加[13]。因此IDO与FeNO均为反映气道过敏性炎症的指标,在哮喘和过敏性鼻炎患者中已有报道NO与IDO的特异性相互作用非常重要[11]。在有症状的过敏患者中,NO的产生可以抑制IDO的表达和活化[14-15]。
NO代谢在过敏性疾病中发挥重要作用已得到广泛报道。NO可能跟过敏性气道阻塞与炎症有关,有报道在过敏性哮喘患者中,一氧化氮合酶(iNOS)在气道上皮细胞及炎症细胞中表达增多。FeNO作为最为广泛用于反映气道炎症的生物标志物,在哮喘患者中的表达相较健康对照组明显升高[13]。本研究结果也证实儿童哮喘患者FeNO水平较正常对照组明显升高。有研究显示花粉过敏症患者在花粉季节外仍有高色氨酸浓度的原因尚不十分明确,但NO与IDO之间具体的相互作用可以在一定程度上解释这一现象[2]。NO可以通过结合活化的血红素位点可逆的抑制IDO活性[14]。因此,当NO合成增加,随之而来的是对IDO的抑制,最终导致绝对的色氨酸浓度增加[2]。IDO与iNOS都是由IFN-γ诱导产生的。通过减少NO的产生,iNOS抑制剂可以减轻NO对IDO的抑制作用。也就是说,iNOS抑制剂限制NO的产生并因此提高IDO活性[16]。本研究结果显示IDO水平与年龄、性别、血中的嗜酸性细胞计数、哮喘严重程度并没有显著的相关性,而仅与FeNO水平呈现出显著负相关关系。FeNO水平越高的患儿IDO活性越低,这也证实了在儿童过敏性哮喘患者的气道中也存在NO与IDO的相互作用,NO的产生可抑制IDO活性从而加重气道过敏性炎症。
本研究也显示,痰液中IDO活性水平可能是5岁以上过敏性哮喘患儿具有诊断价值的生物标志,且利用痰液IDO联合FeNO可提高儿童过敏性哮喘的诊断价值。因此,该研究为儿童过敏性哮喘的诊断提供了有力的补充。普遍认为,哮喘严重程度与血清总IgE和过敏源特异性IgE相关,本研究IDO水平与哮喘严重程度无显著相关性,可能由于IDO介导的抗过敏通路与色氨酸代谢相关,与IgE介导的过敏通路不同所致; 也可能由于本研究存在很多不足之处,比如由于临床标本收集的困难导致入组病例例数偏少样本量不足有关; 另外,本研究针对5岁以上哮喘患儿,而对学龄前喘息患儿特点研究不足; 作为临床试验对IDO与NO相互作用机制研究也不够深入,需要进一步的体外试验研究作为有力的补充。
综上所述,儿童过敏性哮喘患者气道及血中IDO活性较健康儿童明显降低,其水平与年龄、性别、血中的嗜酸性细胞计数、哮喘严重程度分级并没有显著的相关性,而与FeNO水平呈现出显著负相关关系。提示IDO可能在儿童过敏性哮喘发病机制中发挥作用,并与NO之间存在密切的相互作用,与FeNO联合检测可作为临床上辅助诊断儿童过敏性哮喘的生物学标志。
| [1] | GOSTNER J M, BECKER K, KOFLER H, et al. Tryptophan Metabolism in Allergic Disorders[J]. Int Arch Allergy Immunol, 2016, 169(4): 203–215. DOI:10.1159/000445500 |
| [2] | CIPRANDI G, FUCHS D. Tryptophan, neopterin, and nitrite in allergy[J]. Allergy, 2012, 67(8): 1083. DOI:10.1111/j.1398-9995.2012.02862.x |
| [3] |
中华医学会呼吸研究科, 中华人民共和国编辑委员会儿科杂志. 儿童支气管哮喘的诊断和预防指南(2016版)[J]. 中华儿科杂志, 2016, 54(3): 167-181. DOI: 10.3760/cma.j.issn.0578-1310.Respiratory
Research Section of Chinese Medical Association, Editorial Board of Chinese Journal of Pediatrics. Guidelines for the diagnosis and prevention of bronchial asthma in children(2016 Edition)[J]. Chin J Pediatr, 2016, 54(3): 167-181. DOI: 10.3760/cma.j.issn.0578-1310. |
| [4] | BURCHELL J T, STRICKLAND D H, STUMBLES P A. The role of dendritic cells and regulatory T cells in the regulation of allergic asthma[J]. Pharmacol Ther, 2010, 125(1): 1–10. DOI:10.1016/j.pharmthera.2009.06.015 |
| [5] | CIPRANDI G, DE AMICI M, TOSCA M, et al. Tryptophan metabolism in allergic rhinitis: the effect of pollen allergen exposure[J]. Hum Immunol, 2010, 71: 911–915. DOI:10.1016/j.humimm.2010.05.017 |
| [6] | KOSITA C, SCHROECKSNADEL K, GRANDER G, et al. High serum tryptophan concentration in pollinosis patients is associated with unresponsiveness to pollen extract therapy[J]. Int Arch Allergy Immunol, 2008, 147(1): 35–40. DOI:10.1159/000128584 |
| [7] | REFAAT M M, ABDEL REHIM A S, EL-SAYED H M, et al. Serum indolamine 2, 3 dioxygenase as a marker in the evaluation of allergic rhinitis[J]. Am J Rhinol Allergy, 2015, 29(5): 329–333. DOI:10.2500/ajra.2015.29.4210 |
| [8] | RAITALA A, KARJALAINEN J, OJA S S, et al. Indoleamine 2, 3-dioxygenase (IDO) activity is lower in atopic than in non-atopic individuals and is enhanced by environmental factors protecting from atopy[J]. Mol Immunol, 2006, 43: 1054–1056. DOI:10.1016/j.molimm.2005.06.022 |
| [9] | VON BUBNOFF D, FIMMERS R, BOGDANOW M, et al. Asymptomatic atopy is associated with increased indoleamine 2, 3-dioxygenase activity and interleukin-10 production during seasonal allergen exposure[J]. Clin Exp Allergy, 2004, 34(7): 1056–1063. DOI:10.1111/j.1365-2222.2004.01984.x |
| [10] | MANEECHOTESUWAN K, SUPAWITA S, KASETSINSOMBAT K, et al. Sputum indoleamine-2, 3-dioxygenase activity is increased in asthmatic airways by using inhaled corticosteroids[J]. J Allergy Clin Immunol, 2008, 121(1): 43–50. DOI:10.1016/j.jaci.2007.10.011 |
| [11] | VON BUBNOFF D, BIEBER T. The indoleamine 2, 3-dioxygenase (IDO) pathway controls allergy[J]. .Allergy, 2012, 67(6): 718–725. DOI:10.1111/j.1398-9995.2012.02830.x |
| [12] | GOSTNER J M, BECKER K, KOFLER H, et al. Tryptophan Metabolism in Allergic Disorders[J]. Int Arch Allergy Immunol, 2016, 169(4): 203–215. DOI:10.1159/000445500 |
| [13] | STEWART L, KATIAL R K. Exhaled nitric oxide[J]. Immunol Allergy Clin North Am, 2012, 32(3): 347–362. DOI:10.1016/j.iac.2012.06.005 |
| [14] | THOMAS S R, TERENTIS A C, CAI H, et al. Post-translational regulation of human indoleamine 2, 3-dioxygenase activity by nitric oxide[J]. J Biol Chem, 2007, 282(33): 23778–23787. DOI:10.1074/jbc.M700669200 |
| [15] | SAMELSON-JONES B J, YEH S R. Interactions between nitric oxide and indoleamine 2, 3-dioxygenase[J]. Biochemistry, 2006, 45(28): 8527–8538. DOI:10.1021/bi060143j |
| [16] | Ciprandi G, Tosca M, Fuchs D. Nitric oxide metabolites in allergic rhinitis: the effect of pollen allergen exposure[J]. Allergol Immunopathol (Madr), 2011, 39(6): 326–329. DOI:10.1016/j.aller.2011.01.001 |