新生儿期严重炎症反应和菌血症可导致新生儿脑白质损伤,其机制与少突胶质细胞成熟障碍有关[1]。研究发现在SD大鼠新生期腹腔注射LPS,会引起全身炎症反应,激活小胶质细胞,抑制少突胶质祖细胞(oligodendrocyte progenitor cell,OPC)成熟,从而导致脑白质轴突低髓鞘化,造成新生鼠脑白质损伤[2-3]。微RNA(microRNA, miRNA)治疗是目前的研究热点,已有多项研究显示侧脑室注射miRNAs激动剂或抑制剂对脑损伤有治疗作用[4-5]。其中, 研究最多的是miR-219,研究发现其可促进少突胶质祖细胞向少突胶质细胞分化[6],但miR-219对炎症所致新生儿脑白质损伤的作用,目前尚不清楚。本研究拟在新生SD大鼠全身炎症反应模型上进行侧脑室注射miR-219激动剂,探索miR-219激动剂对LPS所致的新生大鼠少突胶质细胞成熟障碍的治疗效果,旨在为早产儿脑白质损伤的药物治疗提供新的线索。
1 材料与方法 1.1 材料SPF级健康新生SD大鼠60只,购于重庆医科大学实验动物中心。细菌脂多糖(北京索莱宝科技有限公司,北京),miR-219激动剂(广州市锐博生物科技有限公司,广州),miRNA RT-qPCR试剂盒(广州市锐博生物科技有限公司,广州), Trizol(Invitrogen, 美国),全蛋白提取试剂盒(江苏凯基生物技术股份有限公司,南京),β-actin兔多克隆抗体(北京博奥森生物技术有限公司,北京),MBP兔多克隆抗体(Cell Signaling Technology,美国),SOX6兔多克隆抗体(武汉三鹰生物有限公司,武汉),辣根过氧化物酶标记的山羊抗兔IgG二抗(北京义翘神州科技有限公司,北京),免疫组化试剂盒(北京中杉金桥生物技术有限公司,北京),PrimeScript RT reagent Kit(TaKaRa Bio,大连),SYBR Green(TaKaRa Bio,大连),光学显微镜及成像系统(Nikon, 日本),荧光定量PCR仪(Bio-Rad,美国),荧光化学发光凝胶成像系统(GENE,中国香港)。
1.2 方法 1.2.1 腹腔注射LPS将SPF级新生2 d的SD大鼠60只随机分为4组:对照组、脂多糖组(LPS组)、miR-219激动剂组(miR-219组)、LPS加miR-219激动剂组(LPS+miR-219组)。LPS组和LPS+miR-219组给予腹腔注射0.25 mg/kg LPS,对照组和miR-219组给予腹腔注射等体积的生理盐水。
1.2.2 新生大鼠侧脑室注射miRNA激动剂在腹腔注射24 h后,对照组和LPS组给予侧脑室注射2 μL(10 pmol/μL)的miRNA阴性对照,miR-219组和LPS+miR-219组给予侧脑室注射2 μL(10 pmol/μL)的miR-219激动剂。本研究中采用的miR-219激动剂为miR-219 agomir,miRNA agomir经过特殊化学修饰的miRNA的激动剂。
1.2.3 标本的采集及处理新生SD大鼠分别于P8、P12用水合氯醛麻醉。在P8,每组各取4只处死,于冰上快速分离脑组织后与Trizol充分匀浆,冻存于-80 ℃冰箱,用于RT-qPCR检测脑组织内miR-219和MBP mRNA的表达;在P12,每组各取5只处死,冰上快速分离脑组织,置于-80 ℃冰箱,用于Western blot检测脑组织内MBP和Sox6蛋白表达;每组剩余6只大鼠分别在P8和P12各取3只,心脏灌注PBS后,再灌注4%多聚甲醛固定脑组织,统一脱水,石蜡包埋,冷却后使用石蜡切片机制作成4 μm的石蜡切片,用于HE染色观察运动皮质区脑白质形态学改变及免疫组化检测胼胝体附近的脑白质内成熟少突胶质细胞。
1.2.4 miRNA RT-qPCR为验证miR-219激动剂的有效性,本研究将miR-219组和对照组的脑组织匀浆,采用Trizol法提总RNA。使用特定的引物(广州市锐博生物科技有限公司,广州),按照miRNA RT-qPCR试剂盒说明书逆转录为cDNA,以cDNA为模板,按照说明书进行PCR扩增检测miR-219的水平。反应条件:95 ℃预变性10 min;变性95 ℃ 2 s, 退火60 ℃ 20 s, 延伸70 ℃ 10 s, 40个循环。测定miR-219和U6的Ct值,以U6为内参,采用2-△△Ct法计算miR-219的相对表达量。
1.2.5 RT-qPCR将各处理组脑组织匀浆,采用Trizol法提总RNA,按PrimeScript RT reagent Kit说明书逆转录成cDNA,以cDNA为模板,按照说明书进行PCR扩增,检测MBP和β-actin的mRNA水平的表达量。本文所用引物由生工生物工程(上海)股份有限公司合成,MBP上游引物序列:5′-CCTCAGAGTCCGACGAGCTT-3′;MBP下游引物序列:5′-ACTTGGATCCGTGTCGCTGT-3′;β-actin上游引物序列:5′-CTGAACCCTAAGGCCAACCGTG-3′;β-actin下游引物序列:5′-CAGAGGCATACAGGGACAAC-3′。扩增程序:95 ℃预变性3 min;95 ℃变性5 s,60 ℃退火40 s,40个循环。测定MBP和β-actin的Ct值,以β-actin为内参,采用2-△△Ct法计算MBP mRNA的相对表达量。
1.2.6 HE染色为观察各处理组脑白质区域细胞形态学改变,本研究采用HE染色进行观察。将石蜡切片置于二甲苯中脱蜡,梯度酒精水化,自来水冲洗1 min,苏木精染色5 min(根据染色情况调整时间), 自来水冲洗1 min,盐酸酒精分色5 s,自来水冲洗1 min, 饱和碳酸锂返蓝15 s,75%酒精2 min,5%伊红染色2 min(根据染色情况调整时间), 梯度酒精脱水,晾干后用中性树脂封片,Nikon 55I光学显微镜下观察并拍照。
1.2.7 免疫组化将石蜡切片置于二甲苯中脱蜡;梯度酒精水化,PBS冲洗;使用枸橼酸盐抗原修复液进行微波加热抗原修复,冷却至室温后,磷酸盐缓冲液(phosphate buffer,PBS)洗3次,每次5 min;3% H2O2去离子水阻断内源性过氧化物酶;山羊血清工作液封闭15 min;一抗(MBP1 :200),阴性对照用PBS代替一抗,4 ℃孵育过夜,PBS洗3次,每次5 min;生物素标记山羊抗兔IgG聚合物室温孵育15 min,PBS洗3次,每次5 min;辣根酶标记链霉卵白素工作液室温孵育15 min,PBS洗3次,每次5 min;DAB显色,自来水冲洗;苏木素复染1 min(根据染色情况调整时间), 自来水冲洗1 min,盐酸酒精分色5 s,自来水冲洗1 min, 饱和碳酸锂返蓝15 s;梯度酒精脱水,晾干后用中性树脂封片;Nikon 55I光学显微镜下观察并对胼胝体附近的脑白质进行拍照, 采用Image-Pro Plus软件分析积分光密度值。
1.2.8 Western blot按照说明书提取脑组织全蛋白,采用二喹啉甲酸(bicinchoninic acid,BCA)法测蛋白浓度;取80 μg,SDS-PAGE电泳分离后,将目标蛋白的条带湿转至PVDF膜上(90 V、60 min);5%脱脂奶粉封闭液封闭1 h,洗膜缓冲液(Tris Buffered Saline Tween, TBST)洗3次,每次5 min;一抗(MBP 1 :500、和Sox6 1 :500)4 ℃摇床孵育过夜,TBST洗3次,每次5 min;二抗(1 :5 000)室温孵育1 h,TBST洗3次,每次5 min;在化学发光成像系统中进行ECL显影并拍照,采用Image J软件分析灰度值。
1.3 统计学分析采用SPSS 24.0软件进行统计分析。计量资料用x±s表示,单因素方差分析用于组间两两比较,方差齐时使用LSD检验,方差不齐时使用非参数检验;Western blot条带灰度采用Image J 1.50i软件进行分析;免疫组化积分光密度值采用Image-Pro Plus 6.0软件进行分析;P < 0.05表示差异有统计学意义。
2 结果 2.1 miR-219激动剂的有效性出生后8 d,miR-219在miR-219组内相对表达量为(2.41±0.66),与对照组相比,miR-219组脑组织中miR-219的水平显著增高(P < 0.05),此结果证明侧脑室注射miR-219激动剂能够有效地提高新生SD大鼠脑组织内miR-219的表达。
2.2 RT-qPCR检测脑组织内MBP mRNA的表达MBP mRNA在LPS组内相对表达量为(0.80±0.03),与对照组比较,LPS组MBP mRNA的表达降低(P < 0.05);在LPS+miR-219组内相对表达量为(0.99±0.10),LPS+miR-219组MBP mRNA表达较LPS组增加(P < 0.05),与对照组无明显差异。
2.3 脑白质病理形态改变出生后8 d,HE染色结果显示对照组和miR-219组神经细胞形态、数目正常;LPS组神经细胞萎缩,可见核固缩,细胞突起减少,神经细胞数目明显减少,神经毡疏松水肿;LPS+miR-219组神经细胞形态、数目与对照组比较基本正常,神经组织轻度水肿(图 1)。
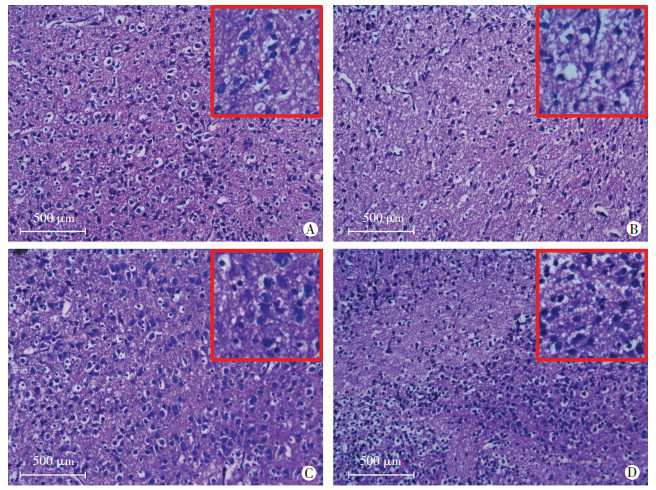
|
| A:对照组;B:LPS组;C:miR-219组;D:LPS+miR-219组 图 1 出生后8神d各组SD大鼠运动皮质区病理学观察 (HE) |
2.4 免疫组化检测脑白质内成熟少突胶质细胞
MBP是成熟少突胶质细胞的标志物。出生后12 d,LPS组大鼠脑白质内MBP蛋白积分光密度值为(31 832.21±21 449.81),与对照组相比,LPS组MBP蛋白表达减少;而LPS+miR-219组大鼠脑白质内MBP蛋白积分光密度值为(15 677.24±88 206.17),与LPS组比较,LPS+miR-219组大鼠脑白质内MBP蛋白的表达增多,与对照组比,LPS+miR-219组脑白质区MBP蛋白表达无明显差异(图 2)。此结果证实LPS组脑白质区成熟少突胶质细胞较对照组显著减少,侧脑室注射miR-219激动剂后,LPS+miR-219组脑白质区成熟少突胶质细胞较LPS组明显增多,与对照组无明显差异。
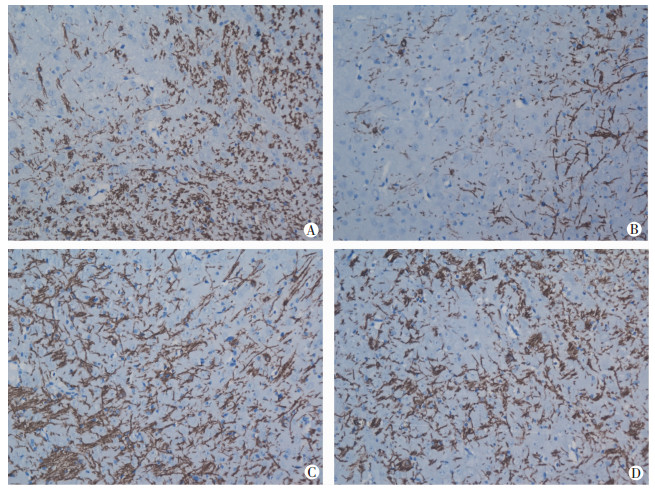
|
| A:对照组;B:LPS组;C:miR-219组;D:LPS+miR-219组 图 2 出生后12 d各处理组大鼠脑白质内MBP标记的成熟少突胶质细胞 (DAB显色×200) |
2.5 Western blot检测脑组织MBP和Sox6的表达
以β-actin为内参,出生后12 d,LPS组MBP蛋白表达为(0.46±0.10),明显低于对照组(P < 0.05);LPS+miR-219组MBP蛋白表达为(0.69±0.13),较LPS组明显增加(P < 0.05),与对照组无明显差异(P>0.05,图 3)。

|
| A:对照组;B:LPS组;C:miR-219组;D:LPS+miR-219组 图 3 出生后12 d各处理组大鼠脑组织内MBP蛋白表达 |
Sox6是少突胶质细胞分化抑制因子。以β-actin为内参,出生后8 d,LPS组Sox6蛋白表达为(1.14±0.07),显著高于对照组(P < 0.05);LPS+miR-219组内Sox6蛋白表达为(0.80±0.06),与LPS组比较,表达明显降低(P < 0.05),与对照组无明显差异(P>0.05,图 4)。

|
| A:对照组;B:LPS组;C:miR-219组;D:LPS+miR-219组 图 4 出生后8 d各处理组大鼠脑组织内Sox6蛋白表达 |
3 讨论
早产儿脑损伤最常见的类型为弥漫性脑白质损伤,而其发生与缺血、感染和炎症反应密切相关[7],有研究证实新生儿期炎症/感染反应是导致未成熟脑白质损伤的重要危险因素[8]。当机体发生全身炎症反应时,炎症因子可通过与中枢神经系统中相应的受体相互作用,介导靶细胞损伤[9-10]。已有研究证实炎症因子会对与少突胶质细胞的增殖、分化相关的多个细胞因子和信号通路产生影响[11]。研究发现在SD大鼠新生期注射LPS,激活小胶质细胞,通过抑制细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)通路从而抑制OPCs成熟,导致脑白质轴突低髓鞘化,造成新生鼠脑白质损伤[2-3]。本研究也发现通过腹腔注射LPS诱导全身炎症反应后,SD大鼠脑白质区组织结构疏松、细胞核固缩。
少突胶质细胞作为大脑白质区的重要组成细胞之一,参与形成髓鞘包绕轴突,保障中枢神经系统信号传导,并通过轴突发挥营养支持作用。有文献指出少突胶质细胞成熟障碍是导致早产儿脑损伤最关键的机制之一[1]。成熟少突胶质细胞分泌合成的MBP是中枢神经系统髓鞘的主要结构蛋白,常作为成熟少突胶质细胞的标志物。在脑白质损伤的动物模型中少突胶质祖细胞发育受阻导致少突胶质细胞成熟障碍,最终导致髓鞘形成障碍[1]。本研究采用免疫组化技术对脑组织内MBP标记的成熟少突胶质细胞进行检测,证实了全身炎症反应导致脑组织内成熟少突胶质细胞大量减少。
少突胶质细胞的分化成熟受多种因子和多条信号通路的调控。其中,Sox6是负性调控少突胶质细胞分化的因子,属于D亚族Sox转录因子,主要表达于少突胶质细胞分化末期的起始阶段,并结合于髓磷脂基因的特定位点,通过募集与Hes5类似的辅阻遏物有效抑制髓磷脂基因的表达激活,在少突胶质细胞的分化发育过程中发挥抑制分化的作用[12]。
多种miRNAs也参与了少突胶质细胞分化发育的调控。目前miRNAs被认为是少突胶质细胞系分化发育的关键调节剂,通过下调各种核受体和蛋白促进少突胶质细胞发育[13]。miRNAs是一类长度为21-23个核苷酸的内源性非编码RNA,成熟miRNA作为沉默复合体的一部分,通过碱基互补配对将其5’端的种子序列与靶mRNA的3’端非翻译区结合(untranslated region, UTR),下调mRNA的表达[14]。有学者通过miRNA芯片研究发现miR -219, 138, 338在少突胶质细胞分化过程中表达量呈10~100倍的增高,其中miR-219是少突胶质细胞特有的miRNA,其表达量在少突胶质细胞分化阶段是达到最高值[15]。miR-219是促进少突胶质细胞分化成熟的充分必要条件,能够改善总miRNA缺失所导致的少突胶质细胞分化发育障碍,在体外实验中miR-219通过直接抑制负性调控少突胶质细胞分化的因子Sox6及促进少突胶质祖细胞增殖的因子受体血小板源性生长因子受体α (platelet-derived growth factor receptor-alpha, PDGFRα)等实现对少突胶质细胞分化成熟的促进作用[3]。
本研究采用侧脑室注射miR-219激动剂提高miR-219在新生SD大鼠脑组织中的表达,侧脑室注射miR-219激动剂后,miR-219激动剂进入脑脊液循环,随脑脊液在脑组织内扩散。本研究发现在腹腔注射LPS后,侧脑室注射miR-219激动剂有效地抑制了Sox6蛋白表达量,提高了MBP的表达量,增加了成熟少突胶质细胞的数量,其MBP的蛋白表达量与对照组无明显差异。
综上所述,SD大鼠新生期腹腔注射LPS所致的全身炎症反应会造成新生鼠少突胶质细胞成熟障碍,而侧脑室注射miR-219激动剂可有效提高脑组织内miR-219的表达,抑制少突胶质细胞分化抑制因子Sox6的表达,促进少突胶质细胞成熟,从而改善全身炎症所致的新生鼠少突胶质细胞成熟障碍。本研究为新生儿脑白质损伤的药物治疗提供了新的线索。
| [1] | VAN TILBORG E, HEIJNEN CJ, BENDERS MJ, et al. Impaired oligodendrocyte maturation in preterm infants: Potential therapeutic targets[J]. Prog Neurobiol, 2016, 136: 28–49. DOI:10.1016/j.pneurobio.2015.11.002 |
| [2] | NOBUTA H, GHIANI CA, PAEZ PM, et al. STAT3-mediated astrogliosis protects myelin development in neonatal brain injury[J]. Ann Neurol, 2012, 72(5): 750–765. DOI:10.1002/ana.23670 |
| [3] |
解迪, 曾红科, 陈纯波, 等. IL-1β对脓毒症新生幼鼠胼胝体内少突胶质细胞前体细胞分化成熟的影响[J].
中国病理生理杂志, 2015, 31(3): 385–391.
XIE D, ZENG H K, CHEN C B, et al. Effects of microglia-derived il-1βon differentiation of opcs in corpus callosum of septic neonatal rats[J]. Chin J Pathophysiol, 2015, 31(3): 385–391. DOI:10.3969/j.issn.1000-4718.2015.03.001.Chinese) |
| [4] | QU Y, WU J, CHEN D, et al. MiR-139-5p inhibits HGTD-P and regulates neuronal apoptosis induced by hypoxia-ischemia in neonatal rats[J]. Neurobiol Dis, 2014, 63: 184–193. DOI:10.1016/j.nbd.2013.11.023 |
| [5] | MA Q, DASGUPTA C, LI Y, et al. Inhibition of microRNA-210 provides neuroprotection in hypoxic-ischemic brain injury in neonatal rats[J]. Neurobiol Dis, 2016, 89: 202–212. DOI:10.1016/j.nbd.2016.02.011 |
| [6] | DUGAS JC, CUELLAR TL, SCHOLZE A, et al. Dicer1 and miR-219 Are required for normal oligodendrocyte differentiation and myelination[J]. Neuron, 2010, 65(5): 597–611. DOI:10.1016/j.neuron.2010.01.027 |
| [7] | BACK S A, MILLER S P. Brain injury in premature neonates: A primary cerebral dysmaturation disorder[J]. Ann Neurol, 2014, 75(4): 469–486. DOI:10.1002/ana.24132.[PubMed |
| [8] |
赵丽珍, 邱吉凤, 柳慧红. 围产期炎症对新生儿脑损伤影响的研究[J].
中国妇幼保健, 2016, 31(21): 4459–4461.
ZHAO L H, QIU J F, LIU H H. Effect of perinatal inflammation on neonatal brain injury[J]. Matern Child Health Care China, 2016, 31(21): 4459–4461. DOI:10.7620/zgfybj.j.issn.1001-4411.2016.21.50.Chinese) |
| [9] | WANG LW, TU YF, HUANG CC, et al. JNK signaling is the shared pathway linking neuroinflammation, blood-brain barrier disruption, and oligodendroglial apoptosis in the white matter injury of the immature brain[J]. J Neuroinflammation, 2012, 9: 175. DOI:10.1186/1742-2094-9-175 |
| [10] | XIE D, SHEN F, HE S, et al. IL-1β induces hypomyelination in the periventricular white matter through inhibition of oligodendrocyte progenitor cell maturation via FYN/MEK/ERK signaling pathway in septic neonatal rats[J]. Glia, 2016, 64(4): 583–602. DOI:10.1002/glia.22950 |
| [11] | FAVRAIS G, VAN DE LOOIJ Y, FLEISS B, et al. Systemic inflammation disrupts the developmental program of white matter[J]. Ann Neurol, 2011, 70(4): 550–565. DOI:10.1002/ana.22489 |
| [12] | STOLT CC, SCHLIERF A, LOMMES P, et al. SoxD proteins influence multiple stages of oligodendrocyte development and modulate SoxE protein function[J]. Dev Cell, 2006, 11(5): 697–709. DOI:10.1016/j.devcel.2006.08.011 |
| [13] | FITZPATRICK JM, ANDERSON RC, MCDERMOTT KW. MicroRNA: Key regulators of oligodendrocyte development and pathobiology[J]. Int J Biochem Cell Biol, 2015, 65: 134–138. DOI:10.1016/j.biocel.2015.05.021 |
| [14] | EULALIO A, HUNTZINGER E, NISHIHARA T, et al. Deadenylation is a widespread effect of miRNA regulation[J]. RNA, 2009, 15(1): 21–32. DOI:10.1261/rna.1399509 |
| [15] | ZHAO X, HE X, HAN X, et al. MicroRNA-mediated control of oligodendrocyte differentiation[J]. Neuron, 2010, 65(5): 612–626. DOI:10.1016/j.neuron.2010.02.018 |



