目前哮喘的治疗主要采取吸入激素治疗,但吸入激素不是一种能治愈哮喘的方法,只能控制哮喘,世界卫生组织及欧洲变态反应与临床免疫学会推荐的变应原特异性免疫治疗(SIT,allergen-specific immuno-therapy)是目前唯一针对病因有效的预防治疗[1],其主要机制是在SIT中可使机体对气道过敏原产生耐受而保持免疫稳态,其中调节性T细胞(regulatory T cell,Treg)产生诱导的免疫耐受是关键环节[2]。
除Treg在哮喘发病的作用外,目前研究认为Th17细胞在哮喘发病中也占有重要地位,Th17细胞以分泌Il-17为特征,IL-17不仅介导了哮喘气道中性粒细胞炎症及与哮喘病情严重度相关,也与气道嗜酸性粒炎症密切相关[2-4]。有趣的是小鼠体内Thl7和可诱导调节性T细胞(iTreg)产生于同一前体细胞-CD4+Foxp3-的T细胞[5]。同时BABAN等报道在IL-6基因敲出的大鼠静脉注射吲哚胺2, 3双加氧酶(Indoleamine 2, 3 dioxygenase,IDO)诱导剂ISS-ODN后,在脾脏发现Treg增多,而皮下注射IDO抑制剂1-MT后可使脾脏pDC表达IL-6,从而使Treg向Th17细胞转化[6]。
IDO是色氨酸分解代谢的限速酶,大多数色氨酸经犬尿氨酸途径代谢[7-8],目前认为IDO介导的色氨酸代谢在过敏性疾病发生起着重要作用。van KF研究发现在过敏性哮喘患者血清中色氨酸代谢物明显降低[9],有研究在气道免疫耐受模型上证实IDO分解色氨酸的代谢物在减轻耐受模型气道炎症反应起重要作用[10-11],但对机制未进一步阐释。鉴于Treg及Th17在哮喘中的作用,Th17、Treg与IDO的关系,以及色氨酸代谢物在过敏性疾病中的作用,同时IDO大量表达在脾脏及肺组织淋巴结的抗原呈递细胞(APC) [12],我们推测在变应原特异性免疫治疗过程中,脾脏及肺组织淋巴结区域的抗原呈递细胞反复受致敏原刺激,呈递抗原至T细胞过程中,表达IDO,引起色氨酸分解代谢,色氨酸分解代谢产物通过调控Treg/Th17分化参与了哮喘SIT的机制。因此本研究以小鼠为研究对象,建立哮喘免疫治疗模型,通过使用IDO抑制剂、色氨酸代谢产物等干预手段,并检测体内Th17、Treg细胞分化及Il-5、IL-10、IL-17的表达情况,研究色氨酸代谢产物调控Th17/Treg分化在小鼠哮喘变应原特异性免疫治疗中的作用及机制,现报告如下。
1 材料与方法 1.1 材料 1.1.1 实验动物清洁级BALB/c雌性小鼠30只,6~8周龄,体质量16~20 g,由北京华阜康生物科技股份有限公司提供,饲养于西南医院SPF级动物房,用完全随机法分成5组:正常对照组、哮喘组、OVA-SIT组、OVA-SIT+1-MT组、OVA-SIT+1-MT+KYN组。每组6只。
1.1.2 主要试剂及设备ELISA相关试剂:LEDGND MAX Mouse IL-10及OVA Specific IgE ELISA,LEGEND MAX Mouse IL-17 ELISA Kit with Pre-coated Plates,Treg流式检测抗体试剂盒(Mouse Treg FlowTM Kit (FOXP3 Alexa Fluor® 488/CD4 APC/CD25 PE)以及IDO免疫组化、免疫荧光一(purified anti-mouse IDO),以上均购自美国Biolegend公司。Th17流式检测抗体试剂盒(Mouse Th17 Cell 4-Color Flow Cytometry Kit)、Th1流式检测抗体试剂盒(Mouse Th1 Cell Multi-Color Flow Cytometry Kit)、Th2流式检测抗体试剂盒(Mouse Th2 Cell Multi-Color Flow Cytometry Kit)均购自美国R&D公司;L-犬尿氨酸标准品购、1-甲基-DL-色氨酸、白蛋白购自美国Sigma公司;色氨酸标准品购自英国LGC。美国BD公司流式细胞仪。
1.2 方法 1.2.1 实验分组及方法实验动物分5组,每组6只。①对照组:小鼠予腹部皮下注射等量生理盐水及生理盐水雾化;②哮喘组:于第0、7天予OVA(Ⅴ级) 10 μg+Al(OH)3 2.25 mg溶于100 μL无菌生理盐水混合液小鼠腹腔内注射,35至41 d予1% OVA雾化激发,50 d予10% OVA加强激发;③OVA-SIT组:21~27 d持续7 d予大剂量OVA(Ⅴ级)皮下注射[含1 mg OVA+Al(OH)3 2mg的生理盐水200 μL],余同哮喘组;④OVA-SIT+1-MT组:21~27 d持续7 d将1-MT 10 mg加入1 mL PBS中予腹腔注射,注射后1 h皮下注射大剂量OVA行免疫治疗,其余同哮喘组;⑤ OVA-SIT+1-MT+KYN组:于14~20 d持续7 d予腹腔注射1-MT (剂量同前),21~27 d予腹腔注射KYN (900 mg/kg),其余同OVA-SIT+1-MT组。
1.2.2 气道高反应性检测各组小鼠在50 d激发后6 h内行气道高反应性检测,通过体积描述法测小鼠自主呼吸,给予待检小鼠浓度逐渐倍增的乙酰甲胆碱(1.56、3.13、6.25、12.5、25 mg/mL)雾化3 min,休息2 min,测定Penh值,再重复检测一次,取平均值。
1.2.3 标本采集与处理各组小鼠测试气道高反应性后,予腹腔注射戊巴比妥钠麻醉,摘除眼球放血收集血清并-80 ℃保存。处死后分离气管,插入留置针,用1 mL PBS反复灌洗5次抽吸支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),将BALF注入离心管中计量,4 ℃、1 500 r/min离心10 min,收集上清液并于-80 ℃保存备用。细胞沉淀后用细胞计数板计数。剩余行HE染色,显微镜下行细胞分类计数。处死小鼠后开胸取肺组织放入4%多聚甲醛瓶中固定,酒精脱水后予石蜡包埋,并切片、行HE染色,显微镜下观察肺组织病理特点。
1.2.4 ELISA检测血清OVA特异性IgE检测BALF中IL-5、IL-10、IL-17(检测参照试剂盒说明书进行)。
1.2.5 流式细胞仪检测脾脏Treg、Th17细胞比率小鼠脾脏:无菌取小鼠脾脏,捣碎,于40 μm金属网过滤,收集细胞用冷RPMI-1640洗涤细胞2次,加入红细胞裂解液,离心, 500 g 2 min,去上清液,用含10%FBS的RPMI-1640培养液(Hyclone:GE Healthcare Life Sciences,Logan,UT,USA).混匀,在37 ℃、5%二氧化碳的环境下培养12 h后,在brefeldin A(布雷非德菌素A)存在前提下,用PMA(丙二醇甲醚醋酸酯)50 ng/mL刺激5 h离心去上清,用含10%的FBS(胎牛血清)的RPMI-1640重悬,再加入FITC标记的抗小鼠CD4抗体、异藻蓝素结合的仓鼠抗CD25抗体及Fc受体阻断剂放置在4 ℃ 30 min后用PBS洗涤后然后完全混匀并,分别加入Foxp3-PE抗体及PE标记的抗鼠RORγt抗体,4℃ 30 min后,上机检测。
1.3 统计学分析采用SPSS 18.0软件对所有数据进行统计学分析。两组样本均数比较采用t检验,多组样本间采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 色氨酸代谢产物对气道高反应性无影响各组小鼠在50 d末次激发后6 h内进行气道反应性检测,结果显示:OVA-SIT组与哮喘组比较,明显抑制气道高反应性,差异有统计学意义(P < 0.05);OVA-SIT组、OVA-SIT+1-MT组以及OVA-SIT+1-MT+ KYN组间比较,在抑制气道高反应性方面差异均无统计学意义(表 1)。
| 组别 | 基线 | 0 mg/mL | 1.56 mg/mL | 3.12 mg/mL | 6.25 mg/mL | 12.5 mg/mL | 25 mg/mL |
| 对照组 | 0.30±0.05 | 0.28±0.03 | 1.04±0.15 | 2.24±0.15 | 3.23±0.10 | 3.64±0.22 | 4.52±0.27 |
| 哮喘组 | 0.29±0.06 | 0.33±0.05 | 1.21±0.08 | 2.90±0.21 | 5.08±0.14 | 7.68±0.22 | 11.00±1.25 |
| OVA-SIT组 | 0.28±0.02 | 0.27±0.02 | 1.06±0.19 | 2.92±0.24 | 3.73±0.17 | 4.34±0.11 | 6.82±0.16 |
| OVA-SIT+1-MT组 | 0.24±0.04 | 0.24±0.03 | 1.09±0.10 | 2.78±0.27 | 3.28±0.13 | 4.18±0.20 | 6.96±0.15 |
| OVA-SIT+1-MT+KYN组 | 0.23±0.04 | 0.23±0.03 | 1.12±0.10 | 2.76±0.38 | 3.57±0.10 | 4.36±0.16 | 7.04±0.17 |
2.2 色氨酸代谢物有助于减轻变应原特异性免疫治疗小鼠肺组织炎症细胞浸润
50 d处死小鼠,取各组小鼠肺组织标本,经处理后后观察各组小鼠肺组织病理改变。哮喘组见肺组织支气管下,血管周围明显炎症改变,肺间质及肺泡管腔内见嗜酸性粒细胞及中性粒细胞,支气管管腔内可见黏液栓,见炎性细胞浸润,血管壁充血水肿改变,上皮细胞坏死脱落;OVA-SIT组炎症反应较哮喘组明显减轻,见嗜酸性粒细胞及中性粒细胞浸润减少。OVA-SIT+1-MT较OVA-SIT组炎症反应加重,而OVA-SIT+1-MT+KYN组较OVA-SIT+1-MT组炎症减轻(图 1)。
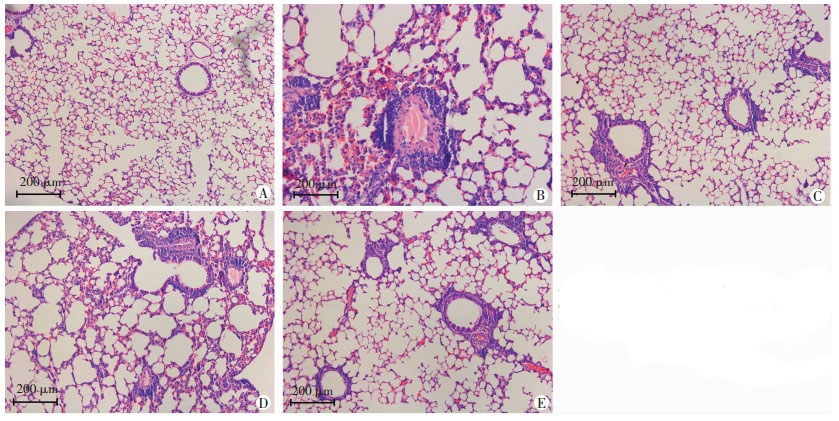
|
| A:对照组;B:哮喘组;C:OVA-SIT组;D:OVA-SIT+1-MT组;E:OVA+1-MT+KYN组 图 1 各组小鼠肺组织病理变化(HE) |
2.3 在变应原特异性免疫治疗过程中,色氨酸代谢产物降低BLAF中嗜酸性粒细胞
OVA-SIT+1-MT+KYN组较OVA-SIT+1-MT组嗜酸性粒细胞降低,差异有统计学意义(P < 0.01);除哮喘组与对照组外,余各组间中性粒细胞差异均无统计学意义(表 2)。
| 组别 | 嗜酸性粒细胞(×106/L) | 中性粒细胞(×106/L) | 淋巴细胞(×103/L) | 细胞总数(×106/L) |
| 对照组 | 26.50±2.81 | 9.00±2.00 | 24.33±8.96 | 75.67±6.65 |
| Asthma组 | 79.33±6.98a | 55.00±6.45a | 100.33±4.84 | 208.17±8.50 |
| OVA-SIT组 | 50.00±3.90b | 53.30±3.50 | 65.67±5.24 | 128.17±11.48 |
| OVA-SIT+1-MT组 | 62.00±3.74c | 53.33±4.27 | 66.33±5.01 | 152.17±8.23 |
| OVA-SIT+1-MT+KYN组 | 50.50±6.25d | 51.67±4.63 | 62.50±4.55 | 127.00±7.54 |
| a:P < 0.01,与对照组比较;b:P < 0.01,与Asthma组比较;c:P < 0.01,与OVA-SIT组比较;d:P < 0.01,与OVA-SIT+1-MT组比较 | ||||
2.4 色氨酸代谢物有助于降低BALF中IL-5、IL-17
OVA-SIT+1-MT+KYN组与OVA-SIT+1-MT组比较,前者BALF中IL-5、IL-17明显降低,差异有统计学意义(P < 0.01)。OVA-SIT组与哮喘组比较,前者IL-10明显高于后者,IgE明显低于后者,差异有统计学意义(P < 0.01),除哮喘组与对照组外,余各组间IL-10及IgE差异无统计学意义(表 3)。
| 组别 | IL-5(pg/mL) | IL-10(pg/mL) | IL-17(pg/mL) | IgE(×103ng/mL) |
| 对照组 | 18.67±4.15 | 165.00±6.45 | 21.03±3.24 | 157.87±13.85 |
| Asthma | 537.57±28.53a | 97.38±9.07a | 87.45±4.20a | 707.73±35.43a |
| OVA-SIT | 73.58±9.15b | 228.83±18.54 | 34.75±4.55b | 422.00±14.11 |
| OVA-SIT+1-MT | 259.65±16.27c | 233.73±10.05 | 59.97±3.76c | 427.92±8.00 |
| OVA-SIT+1-MT+KYN | 83.48±6.02d | 230.75±16.14 | 38.72±4.61d | 429.95±7.13 |
| a:与对照组比较,P < 0.01;b:与Asthma组比较,P < 0.01;c:与OVA-SIT组比较,P < 0.01;d:与OVA-SIT+1-MT组比较,P < 0.01 | ||||
2.5 色氨酸代谢物有助于脾脏TH17/Treg下降
(1) OVA-SIT+1-MT+KYN组与OVA-SIT+1-MT组比较,前者CD4+RORγt+T细胞比率明显低于后者,差异有统计学意义(P < 0.01)。(2)OVA-SIT+1-MT+ KYN组与OVA-SIT+1-MT组比较,前者CD4+Foxp3+T细胞比率明显高于后者,差异有统计学意义(P < 0.01,表 4、图 2、图 3)。
| 组别 | CD25+Foxp3+T细胞/CD4+T细胞(%) | RORγt+T细胞/CD4+T细胞(%) |
| 对照组 | 12.72±1.15 | 1.46±0.12 |
| Asthma | 4.75±0.08a | 6.98±0.20a |
| OVA-SIT | 8.42±0.31b | 2.57±0.24b |
| OVA-SIT+1-MT | 6.33±0.28c | 4.94±0.38c |
| OVA-SIT+1-MT+KYN | 8.36±0.53d | 2.60±0.14d |
| a:与对照组比较,P < 0.01;b:与Asthma组比较,P < 0.01;c:与OVA-SIT组比较,P < 0.01;d:与OVA-SIT+1-MT组比较,P < 0.01 | ||
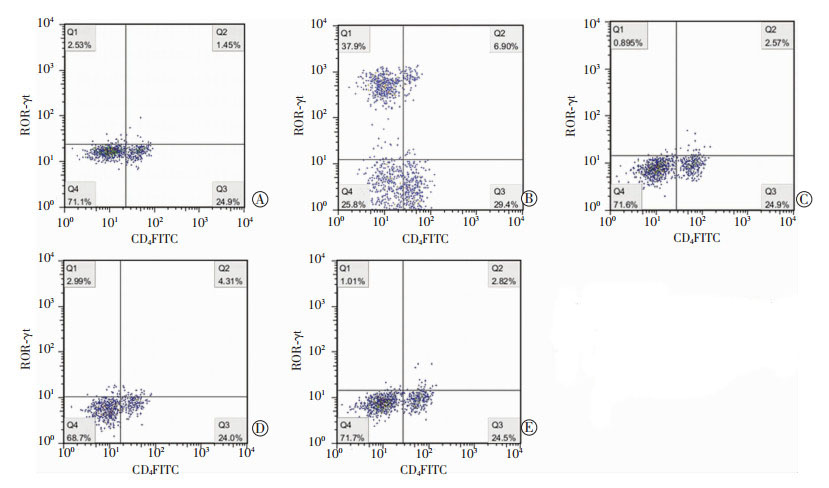
|
| A:对照组;B:哮喘组;C:OVA-SIT组;D:OVA-SIT+1-MT组;E:OVA+1-MT+KYN组 图 2 流式细胞仪检测各组小鼠脾脏CD4+RORγt+T细胞百分率 |
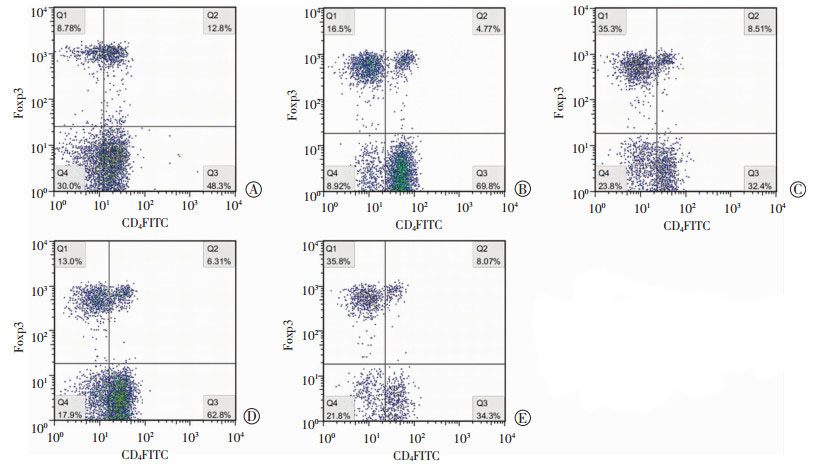
|
| A:对照组;B:哮喘组;C:OVA-SIT组;D:OVA-SIT+1-MT组;E:OVA+1-MT+KYN组 图 3 流式细胞仪检测各组小鼠脾脏CD4+Foxp3+T细胞百分率 |
3 讨论
本研究模拟临床SCIT建立OVA免疫治疗模型,取小鼠脾脏通过流式细胞检测发现OVA-SIT+1-MT组与OVA-SIT比较,CD4+RORγt+T细胞明显增高,CD4+Foxp3+T细胞明显降低;OVA-SIT+1-MT+KYN与OVA-SIT+1-MT组比较,CD4+RORγt+T细胞明显降低,CD4+Foxp3+T细胞明显增高,因此说明色氨酸代谢物(KYN)有助于调节脾脏TH17/Treg下降,在免疫治疗中起重要的作用。
色氨酸除用于合成各种蛋白质外,主要在肝、脑、肾等组织代谢[12]。IDO是色氨酸分解代谢的限速酶,目前认为IDO介导的色氨酸代谢在过敏性疾病发生起着重要作用,而且不同代谢产物可能有不同作用。Odemuyiwa等[10]人的一项研究使用了一个有良好的气道耐受模型来研究IDO的作用,以及两个与之密切相关的色氨酸分解代谢产物KYN和3 -HAA在气道黏膜的耐受性,研究结果表明,从IDO的酶活性中产生的分解代谢产物是维持免疫系统的重要组成部分,并在气道中预防变异性致敏作用[13]。Hayashi T等人的一项研究,发现诱导IDO可抑制卵蛋白诱发的气道炎症[14],这一抑制效应后来被证实是由于IDO介导的通过3-HAA诱导的Th2细胞凋亡[15]。本研究发现IDO介导的色氨酸代谢产物(KYN)是通过调控Th17、Treg比率而有助于免疫耐受形成的,因此色氨酸各代谢产物影响免疫机制可能是通过不同路径来实现的[16]。
Th17与Treg来源于同一前体细胞,在分化功能上相互抑制,IDO在外周免疫耐受中有重要地位,在其他免疫性疾病证实了IDO可能是Th17向Treg转换的分子“开关”。本实验也发现IDO介导的色氨酸代谢产物有助于调节脾脏TH17/Treg下降,说明色氨酸代谢产物抑制Th17细胞生成而向Treg细胞转化。因此我们推测OVA入血后可能在脾脏淋巴结组织被DC(树突状细胞Dendritic cells)捕获,呈递抗原给T细胞,诱导Th0向Treg分换,这种DC分泌表达IDO,降解色氨酸,诱导Treg产生[17],并抑制Th17细胞产生,同时脾脏产生的Treg可能通过血液迁移到肺组织发挥作用
本研究在参照文献[18-21]的基础上设计了实验方案,发现哮喘特异性免疫治疗后,与哮喘组比较BLAF中中性粒细胞百分比无差异,并将哮喘免疫治疗组中加入IDO抑制剂或色氨酸代谢产物后比较中性粒细胞均无差异,说明SIT治疗针对中性粒细胞哮喘效果较差。
本实验表明色氨酸代谢产物有利于减轻气道炎症,但并不降低气道高反应性,虽然气道炎症是气道高反应性重要机制之一,由于气道高反应性不仅限于气道炎症,其他因素比如TNFα与内皮素相互作用在气道高反应性形成上也有重要作用;大剂量OVA免疫治疗致致敏小外周血中IgE降低[17],但本实验表明在特异性免疫治疗后IgE变化与IDO抑制剂及IDO介导的代谢产物无关,进一步说明了SIT影响气道高反应性、IgE水平及气道炎症是通过不同通路及机制实现的[22]。
我们的前期研究证实了IL-10参与了免疫耐受的形成,但本实验中当哮喘特异性免疫治疗模式建立后加入IDO抑制剂或色氨酸代谢产物后比较IL-10无明显差异,说明IL-10变化与IDO及其代谢产物无关,同时本实验证实了IDO介导的色氨酸分解代谢产物有助于CD4+Foxp3+Treg产生,故说明IL-10的产生不是CD4+Foxp3+Treg分泌的,而可能是部分TH2类其他CD4+T细胞分泌的[23-24]。
综上所述,我们通过本项目的研究,阐明了色氨酸代谢产物(KYN)有助于调控Th17、Treg分化,有望通过色氨酸代谢产物在哮喘变应原特异性免疫治疗中抑制Th17细胞分化而使Treg增高,从而诱导免疫耐受发生或逆转免疫耐受缺陷达到防治哮喘目的提供依据。但本研究以小鼠为研究对象,可能不能完全反应色氨酸代谢产物在人类哮喘变应原特异性免疫治疗中的作用及机制,还需进一步进行临床研究。
| [1] | SIMPSON J L, SCOTT R, BOYLE M J, et al. Inflammatory subtypes in asthma: assessment and identification using induced sputum[J]. Respirology, 2006, 11(1): 54–61. DOI:10.1111/j.1440-1843.2006.00784.x |
| [2] | AKDIS C A, AKDIS M. Mechanisms of allergen-specific immunotherapy and immune tolerance to allergens[J]. World Allergy Organiz J, 2015, 8(1): 1–12. DOI:10.1186/s40413-015-0063-2. |
| [3] | WILSON R H, WHITEHEAD G S, NAKANO H, et al. Allergic sensitization through the airway primes Th17-dependent neutrophilia and airway hyperresponsiveness[J]. Am J Respir Crit Care Med, 2009, 180(8): 720–730. DOI:10.1164/rccm.200904-0573OC |
| [4] | CHOY D F, HART K M, BORTHWICK L A, et al. TH2 and TH17 inflammatory pathways are reciprocally regulated in asthma[J]. Sci Transl Med, 2015, 7(301): 301ra129. DOI:10.1126/scitranslmed.aab3142 |
| [5] | ZHAO J, LLOYD C M, NOBLE A. Th17 responses in chronic allergic airway inflammation abrogateregulatory T-cell-mediated tolerance and contribute to airway remodeling[J]. Mucosal Immunol, 2013, 6(2): 335–346. DOI:10.1038/mi.2012.76 |
| [6] | BETTELLI E, CARRIER Y, GAO W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J]. Nature, 2006, 441(7090): 235–238. DOI:10.1038/nature04753 |
| [7] | BABAN B, CHANDLER P R, SHARMA M D, et al. IDO activates regulatory T cells and blocks their conversion into Th17-like T cells[J]. J Immunol, 2009, 183(4): 2475–2483. DOI:10.4049/jimmunol.0900986 |
| [8] | SINGH N, DALAL V, KUMAR P. Structure based mimicking of Phthalic acid esters (PAEs) and inhibition of hACMSD, an important enzyme of the tryptophan kynurenine metabolism pathway[J]. Int J Biol Macromol, 2017, 108: 214–224. DOI:10.1016/j.ijbiomac.2017.12.005 |
| [9] | VAN DER SLUIJS K F, VAN DE POL M A, KULIK W, et al. Systemic tryptophan and kynurenine catabolite levels relate to severity of rhinovirus-induced asthma exacerbation: a prospective study with a parallel-group design[J]. Thorax, 2013(12): 1122–1130. DOI:10.1136/thoraxjnl-2013-203728 |
| [10] | ODEMUYIWA S O, EBELING C, DUTA V, et al. Tryptophan catabolites regulate mucosal sensitization to ovalbumin in respiratory airways[J]. Allergy, 2009, 64(3): 488–492. DOI:10.1111/j.1398-9995.2008.01809.x |
| [11] | BANSI J, KOLIAMITRA C, BLOCH W, et al. Persons with secondary progressive and relapsingremitting multiple sclerosis reveal different responses of tryptophan metabolism to acute endurance exercise and training[J]. J Neuroimmunol, 2018, 314: 101–105. DOI:10.1016/j.jneuroim.2017.12.001 |
| [12] | RAITALA A, KARJALAINEN J, OJA S S, et al. Indoleamine 2, 3-dioxygenase (IDO) activity is lower in atopic than in non-atopic individuals and is enhanced by environmental factors protecting from atopy[J]. Mol Immunol, 2006, 43(7): 1054–1056. DOI:10.1016/j.molimm.2005.06.022 |
| [13] | SCHRÖCKSNADEL K, WIRLEITNER B, WINKLER C, et al. Monitoring tryptophan metabolism inchronic immune activation[J]. Clin Chim Acta, 2006, 364(1-2): 82–90. DOI:10.1016/j.cca.2005.06.013 |
| [14] | HAYASHI T, BECK L, ROSSETTO C, et al. Inhibition of experimental asthma by indoleamine 2, 3-dioxygenase[J]. J Clin Invest, 2004, 114(2): 270–279. DOI:10.1172/JCI21275 |
| [15] | HAYASHI T, MO J H, GONG X, et al. 3-Hydroxyanthranilic acid inhibits PDK1 activation and suppresses experimental asthma by inducing T cell apoptosis[J]. Proc Natl Acad Sci USA, 2007, 104(47): 18619–18624. DOI:10.1073/pnas.0709261104 |
| [16] | YAN Y, ZHANG G X, GRAN B, et al. IDO upregulates regulatory T cells via tryptophan catabolite and suppresses encephalitogenic T cell responses in experimental autoimmune encephalomyelitis[J]. J Immunol, 2010, 185(10): 5953–5961. DOI:10.4049/jimmunol.1001628 |
| [17] | SHARMA M D, BABAN B, CHANDLER P, et al. Plasmacytoid dendritic cells from mouse tumor-draining lymph nodes directly activate mature Tregs via indoleamine 2, 3-dioxygenase[J]. J Clin Invest, 2007, 117(9): 2570–2582. DOI:10.1172/JCI31911 |
| [18] | TAHER Y A, PIAVAUX B J, GRAS R, et al. Indoleamine 2, 3-dioxygenase-dependent tryptophan metabolites contribute to tolerance induction during allergen immunotherapy in a mouse model[J]. J Allergy Clin Immunol, 2008, 121(4): 983–991. DOI:10.1016/j.jaci.2007.11.021 |
| [19] |
胡琦, 钟世民, 汪金玉, 等. 皮下注射大剂量卵白蛋白诱导小鼠哮喘免疫耐受模型的建立及机制初步研究[J].
第三军医大学学报, 2016, 38(12): 1404–1409.
HU Q, ZHONG S M, WANG J Y, et al. Establishment of mouse model of immune tolerance of asthma through subcutaneous injection of high dose of ovalbumin[J]. J Third Mil Med Univ, 2016, 38(12): 1404–1409. DOI:10.16016/j.1000-5404.201602024 |
| [20] | HELLINGS P W, KASRAN A, LIU Z, et al. Interleukin-17 orchestrates the granulocyte influx into airways after allergen inhalation in a mouse model of allergic asthma[J]. Am J Respir Cell Mol Biol, 2003, 28(1): 42–50. DOI:10.1165/rcmb.4832 |
| [21] | YEH Y C, YEN H R, JIANG R S, et al. Dose-response relationship of specific allergen exposure-induced immunological tolerance: a mouse model[J]. Int Forum Allergy Rhinol, 2015, 5(9): 784–793. DOI:10.1002/alr.21551 |
| [22] | MEHLHOP P D, VAN DE RIJN M, GOLDBERG AB, et al. Allergen-induced bronchial hyperreactivity and eosinophilic inflammation occur in the absence of IgE in a mouse model of asthma[J]. Proc Natl AcadSci USA, 1997, 94(4): 1344–1349. DOI:10.1073/pnas.94.4.1344 |
| [23] | MAAZI H, SHIRINBAK S, WILLART M, et al. Contribution of regulatory T cells to alleviation of experimental allergic asthma after specific immunotherapy[J]. Clin Exp Allergy, 2012, 42(10): 1519–1528. DOI:10.1111/j.1365-2222.2012.04064.x |
| [24] | BÖHM L, MAXEINER J, MEYER-MARTIN H, et al. IL-10 and regulatory T cells cooperate in allergen-specific immunotherapy to ameliorate allergic asthma[J]. J Immunol, 2015, 194(3): 887–897. DOI:10.4049/jimmunol.1401612 |



