2. 210009 南京,东南大学临床医学院;
3. 210029 南京,南京中医药大学附属医院/江苏省中医院核医学科;
4. 210002 南京,南京大学医学院附属金陵医院/南京军区南京总医院医学影像科
2. College of Clinical Medicine, Southeast University, Nanjing, Jiangsu Province, 210009;
3. Department of Nuclear Medicine, Affiliated Hospital of Nanjing University of Traditional Chinese Medicine/Jiangsu Provincial Hospital of Traditional Chinese Medicine, Nanjing, Jiangsu Province, 210029;
4. Department of Medical Imaging, Jinling Hospital, Medical School of Nanjing University/Nanjing General Hospital of Nanjing Military Command, Nanjing, Jiangsu Province, 210002, China
肝细胞癌(hepatocellular carcinoma, HCC)是常见的癌症之一,手术切除仍为首选治疗方法。但手术切除受诸多因素(如:肝癌恶性程度极高,易早期播散和转移,另外相当一部分原发性肝癌为多中心起源等)制约,导致切除率低且复发率高[1]。近年来非手术治疗方法——靶向综合治疗成为提高肝癌疗效的新兴途径[2]。在肝癌的靶向治疗中,改良“弹头”物质是研究的重要方向。单抗与载药纳米粒的结合可提高药物的靶向性,增强药物与靶部位的特异性结合,载药纳米粒系统的缓释作用可防止药物过早释放失活,增加药物在肿瘤部位的持续时间以增强疗效[3]。放射免疫治疗亦是当前中晚期肝癌治疗研究的新方向[4-5]。将单克隆抗体免疫治疗、放射性131I内照射治疗及载药纳米粒缓释化疗这三种方式综合治疗肿瘤的效果如何,目前尚不清楚。本实验将131I标记抗甲胎蛋白单抗导向阿霉素白蛋白免疫毫微球(131I-antiAFP monoclonal antibody-doxorubicin-bovine serum albumin-nanoparticles,131I-antiAFP McAb-DOX-BSA-NP)作用于裸鼠移植瘤,观察其对肝癌细胞的抑制和杀伤作用。
1 材料与方法 1.1 实验仪器及实验动物SPECT:德国西门子公司生产,型号E.CAM9358;放射性活度仪:CAPINIEC CRC-15R,美国;CO2培养箱:REVCO,美国。抗甲胎蛋白单抗导向阿霉素白蛋白免疫毫微球(自制,免疫毫微粒呈圆球形,粒径330~400 nm,大小尚均匀,但分散性欠佳,微粒之间稍聚集,有轻度融合)[6]。
BALB/c-nu裸鼠由南京军区动物中心提供,雄性,鼠龄3~4周,体质量18~22 g,裸鼠在无特殊病原菌(SPF)条件下分笼饲养。
1.2 131I-antiAFP McAb-DOX-BSA-NP制备利用Iodogen方法对纳米颗粒进行131I标记,标记后使用PD10柱进行分离纯化,终产品经TLC方法质控,检测其放射化学纯度。
1.3 培养人肝癌细胞株BEL-7402及建立荷瘤裸鼠模型将复苏的人肝癌BEL-7402细胞体外传代培养至对数生长期,消化、离心,PBS清洗数遍后,反复离心(1 000 r/min,5 min)。最后用生理盐水配制成1×107个/mL的细胞悬液,用1 mL注射器以0.25 mL/只接种于裸鼠右腋皮下。2周后,细胞悬液完全吸收,开始出现米粒大小的肿瘤结节。待肿瘤长到100 mm3时基本成模。
1.4 实验动物分组及处理方法将成瘤裸鼠模型按随机数字表法分为5组(每组6只)。A组:空白对照组,生理盐水0.2 mL/只;B组:单纯131I核素治疗组,Na131I 0.2 mCi/只(1 mCi=3.7×107Bq);C组:核素131I-antiAFP McAb治疗组,Na131I-antiAFP 0.2 mCi/只;D组:核素131I-antiAFP McAb-DOX-BSA-NP治疗组,Na131I-antiAFP 0.2 mCi/只;E组:antiAFP McAb-DOX-BSA-NP治疗组,等量的DOX-BSA-NP 0.2 mL/只。各组裸鼠瘤周注射治疗, DOX剂量为40 μg/只。注射体积为0.2 mL/只(体积不足以生理盐水补足)。各组瘤体治疗前体积大致相同,差异无统计学意义(P>0.05)。B、C、D组均采取1%碘化钾0.2 mL灌胃封闭甲状腺。
1.5 实验观测指标 1.5.1 131I-antiAFP McAb-DOX-BSA-NP的鉴定采用TLC检测方法,支持物为硅胶浸渍玻璃纤维条;展开剂为85%甲醇溶液;取样后点在距离层析条1 cm的样品线上,然后将纤维条放入盛有展开剂的试管中展开,待展开剂前沿到达7 cm处时,取出层析条干燥后用Bio scan扫描仪扫描,扫描距离为8 cm。
1.5.2 肿瘤生长曲线观察各组裸鼠及移植瘤随时间的变化,并记录4、9、14、20 d瘤体体积,绘制肿瘤生长曲线,计算肿瘤生长抑制率。
肿瘤生长抑制率=(1-治疗组治疗前后瘤体积差/对照组瘤体积差)×100%
1.5.3 放射性计数在24、48、96、168 h对放射治疗组(B、C、D组)裸鼠进行SPECT检查,勾画感兴趣区,比较放射性计数。
1.6 统计学方法采用SPSS 19.0统计软件,计量资料以x±s表示,采用t检验。P<0.05为差异有统计学意义。
2 结果 2.1 131I-antiAFP McAb-DOX-BSA-NP质控结果标记产物性状呈澄清溶液,pH值=7.4,放射性化学纯度>99%。TLC检测结果显示游离131I的Rf=0.7~0.9,131I-antiAFP McAb-DOX-BSA-NP滞留在原点(Rf=0.1~0.2),故以此分析样品的放射性化学纯度,质控图见图 1。其活度浓度3.91 mCi/mL;总活度2.74 mCi;总体积0.7 mL。标记产物131I纳米颗粒在0.2 mol/L PB缓冲液中1、2、4 h的放射性化学纯度分别为97.17%、97.10%、95.22%,TLC分析显示标记产物体外稳定性较好(图 2)。
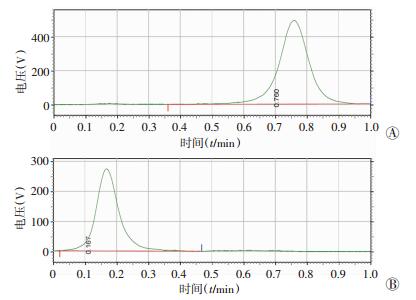
|
| A:游离131I TLC图谱;B:标记产物131I-antiAFP McAb-DOX-BSA-NP TLC图谱 图 1 标记产物131I-antiAFP McAb-DOX-BSA-NP质控图 |

|
| A:1 h;B:2 h;C:4 h 图 2 标记产物131I-antiAFP McAb-DOX-BSA-NP体外稳定性检测TLC图 |
2.2 裸鼠一般状况
裸鼠成瘤后15 d各组小鼠右侧腋部皮下移植瘤开始突出体表,成结节瘤块,瘤体表面皮肤如常。结节逐渐长成理想大小,超声显像示瘤体结节的形态及大小,表明人肝癌移植瘤模型种植成功。治疗后对照组及各实验组裸鼠肿瘤体积逐渐增大,随时间延长裸鼠食欲进行性下降、体形开始消瘦,但以生理盐水组肿瘤体积增大最显著,各治疗组瘤体不同程度增大,增长速度均较对照组慢,其中,131I-antiAFP McAb-DOX-BSA-NP治疗组瘤体增长最慢。
2.3 各组裸鼠治疗后肿瘤体积变化及生长抑制率比较A组较B、C、D、E治疗组肿瘤体积明显增大(P<0.05,图 3),说明对照组肿瘤体积生长最快,各治疗组瘤体生长均受到不同程度抑制。各治疗组在肿瘤生长抑制率方面:与B、C、E组比较,D组肿瘤生长抑制率(0.63±0.14)最强,差异有统计学意义(P<0.05),说明D组抑制肿瘤生长效果最好,瘤结节生长抑制最显著;C组(0.46±0.10)及E组(0.38±0.12)的肿瘤生长抑制率均强于B组(0.23±0.09),差异有统计学意义(P<0.05);但C组与E组比较,瘤体生长抑制差异无统计学意义(P>0.05)。

|
| a:P<0.05,与A组比较 图 3 各组裸鼠肿瘤生长曲线 |
2.4 SPECT检查结果
核素相关治疗组SPECT检查结果见图 4、表 1。24 h时,B、C、D组瘤区放射性计数值差异无统计学意义(P>0.05);48、96、168 h时,D组及C组的放射性计数值均高于B组(P<0.05),且随时间延长其差异性越来越显著,说明放射性核素与单抗连接之后核素在肿瘤区滞留延长;而D组与C组比较,虽然放射性计数值D组高于C组,但差异无统计学意义(P>0.05)。

|
| 图 4 放射性核素相关治疗组不同时间瘤区SPECT表现 |
| 时间 | B组 | C组 | D组 | F值 | P值 |
| 24 h | 1 509.7±106.1 | 1 527.8±53.2 | 1 493.5±103.9 | 0.096 | 0.909 |
| 48 h | 735.2±79.3 | 876.0±50.4 | 818.7±69.2 | 6.627 | 0.009 |
| 96 h | 356.5±48.4 | 479.0±46.1 | 484.7±62.5 | 11.284 | 0.001 |
| 168 h | 188.0±17.6 | 271.2±40.1 | 298.8±40.3 | 16.934 | <0.001 |
3 讨论
临床上对于不能手术切除的中晚期肝癌,肝动脉化疗性栓塞被公认为最有效的首选方法[7]。此法对肝动脉供血的肿瘤作用较为明显,但对肝静脉或门静脉供血的肿瘤作用有限,而靶向治疗不受此限制。将肿瘤特异性抗体结合到载阿霉素纳米粒上,使其具有肿瘤特异性,一方面增加载阿霉素纳米粒在肿瘤部位的聚集,减少其在非肿瘤部位的分布[8];另一方面通过载阿霉素纳米粒的缓释作用增加阿霉素在肿瘤部位的持续时间[9]。这两方面在提高抗癌效果的同时大大减轻毒副作用。在此基础上再加上放射性131I的内放射治疗[10],进一步增强抗癌效果。
瘤体给药亦是肝癌临床治疗的重要途径[11],一些抗体介导的免疫微球经瘤内注射显示出良好的疗效[12]。本实验因制备的单抗导向的免疫毫微球粒径较大,略有聚集,恐难以透过毛细血管,同时加上标记131I,进一步扩大颗粒直径,故采用瘤体给药评价131I免疫毫微球的抗瘤活性。SPECT检查结果显示,放射性核素绝大多数分布于瘤体内,随时间延长C、D组较B组表现出具有更多的瘤体滞留量。因为白蛋白纳米粒直径比毛细血管或者肝窦直径小,一般不会聚集造成血管栓塞,可能是131I-antiAFP McAb治疗组(C组)和131I-antiAFP McAb-DOX-BSA-NP治疗组(D组)放射性计数差异无统计学意义的原因。尽管131I免疫毫微球经瘤体注射失去了抗体的导向性,但是经抗体介导可以更加牢固地结合在肿瘤细胞上延长在靶区的作用时间,从而增加了对肿瘤的杀伤力[13]。
B组在治疗后的第4天表现出最小体积,可能是由于游离的放射性131I体积较小,在瘤体内扩散更容易,显示出较强抑瘤作用,但随着时间的延长,由于没有抗体的特异性结合,游离的放射性131I也更容易脱离瘤体,因此在治疗后的第20天其体积仅比对照组低。C、D、E组的瘤体的生长曲线基本平稳,间接反映抑瘤作用相对稳定。C组与E组抑瘤率差异无统计学意义,说明在抗体介导下的放射性131I内照射治疗与载药纳米粒缓释化疗作用差异不显著。D组综合了单克隆抗体免疫治疗、放射性131I内照射治疗[10]及载药纳米粒缓释化疗[14]这三种治疗,表现出最强抑瘤作用。本实验结果提示,同等药物剂量联合放射性核素治疗组比单独用普通载药纳米免疫毫微球、核素及核素标记单抗治疗组有着显著的优越性。
综上所述,单克隆抗体免疫治疗、放射性131I内照射治疗及载药纳米粒缓释化疗联合运用结合成一种新型的治疗方法,其有显著抗癌效果,为临床治疗肿瘤提供新的思路。另外,本实验并未行生存分析,此为本次实验的一大遗憾,下一步将扩大样本量,兼顾生存分析,进一步完善疗效研究。
| [1] | GBOLAHAN O B, SCHACHT M A, BECKLEY E W, et al. Locoregional and systemic therapy for hepatocellular carcinoma[J]. J Gastrointest Oncol, 2017, 8(2): 215–228. DOI:10.21037/jgo.2017.03.13 |
| [2] | BEST J, SCHOTTEN C, THEYSOHN J M, et al. Novel implications in the treatment of hepatocellular carcinoma[J]. Ann Gastroenterol, 2017, 30(1): 23–32. DOI:10.20524/aog.2016.0092 |
| [3] |
宋晓斌, 李晨玉, 方晓白, 等. 探讨键合表阿霉素纳米胶束对肝癌Walker-256细胞周期的影响[J].
中国实验诊断学, 2017, 21(2): 313–315.
SONG X B, LI C Y, FANG X B, et al. Effect on key BHB adriamycin nano micelle Walker-256 hepatumor cells cycle[J]. Chin J Lab Diagn, 2017, 21(2): 313–315. |
| [4] | LIN M, HUANG J, ZHANG D, et al. Hepatoma-targeted radionuclide immune albumin nanospheres: 131I-antiAFPMcAb-GCV-BSA-NPs[J]. Anal Cell Pathol (Amst), 2016, 2016: 9142198. DOI:10.1155/2016/9142198 |
| [5] | LI W, LIU Z, LI C, et al. Radionuclide therapy using 131I-labeled anti-epidermal growth factor receptor-targeted nano-particles suppresses cancer cell growth caused by EGFR over-expression[J]. J Cancer Res Clin Oncol, 2016, 142(3): 619–632. DOI:10.1007/s00432-015-2067-2 |
| [6] |
戚宁, 杜明华, 张东生, 等. 制备单抗偶联载阿霉素白蛋白免疫毫微球的初步研究[J].
东南大学学报(医学版), 2012, 31(4): 393–397.
QI Ning, DU Minghua, ZHANG Dongsheng, et al. Preliminary study on preparation of doxorubicin-loaded bovine serum albumin targeted at antiAFP immuno-nanoparticle[J]. J Southeast Univ (Med Sci Edi), 2012, 31(4): 393–397. DOI:10.3969/j.issn.1671-6264.2012.04.002.issn.1671-6264.2012.04.002 |
| [7] | LI J, ZHOU M, LIU F, et al. Hepatocellular carcinoma: intra-arterial delivery of doxorubicin-loaded hollow gold nanospheres for photothermal ablation-chemoembolization therapy in rats[J]. Radiology, 2016, 281(2): 427–435. DOI:10.1148/radiol.2016152510 |
| [8] | QIN J M, YIN P H, LI Q, et al. Anti-tumor effects of brucine immuno-nanoparticles on hepatocellular carcinoma[J]. Int J Nanomedicine, 2012, 7: 369–379. DOI:10.2147/IJN.S27226 |
| [9] | DANGI R, HURKAT P, JAIN A, et al. Targeting liver cancer via ASGP receptor using 5-FU-loaded surface-modified PLGA nanoparticles[J]. J Microencapsul, 2014, 31(5): 479–487. DOI:10.3109/02652048.2013.879929 |
| [10] |
谢志君, 李立, 尤真明, 等. 基于人体有效半减期计算131I投入量对治疗Graves'甲亢转归的影响[J].
第三军医大学学报, 2017, 39(21): 2131–2134.
XIE Z J, LI L, YOU Z M, et al. Impact of 131I given dose based on individual effective half-life on Graces disease outcome: a clinical study of 201 cases[J]. J Third Mil Med Univ, 2017, 39(21): 2131–2134. DOI:10.16016/j.1000-5404.201706068 |
| [11] | CHI J L, LI C C, XIA C Q, et al. Effect of 131I gelatin microspheres on hepatocellular carcinoma in nude mice and its distribution after intratumoral injection[J]. Radiat Res, 2014, 181(4): 416–424. DOI:10.1667/RR13539.1 |
| [12] |
李佳. 不可切除的大肠癌肝转移多学科综合治疗进展(附3例病例讨论)[D]. 汕头: 汕头大学, 2011.
LI J. Advances in multidisciplinary synthetic therapy for unresectable liver metastasis of colorectal cancer (Three cases discussion)[D]. Shantou: Shantou University, 2011. |
| [13] |
赵文思, 周寒静, 罗弋. ABCG2特异性肺腺癌单链抗体的裸鼠体内放免显像及其抑瘤作用[J].
第三军医大学学报, 2016, 38(24): 2600–2605.
ZHAO W S, ZHOU H J, LUO Y. Radioimmunoimaging and anti-tumor effect of anti-ABCG2 single-chain antibody in nude mice with lung adenocarcinoma transplantation[J]. J Third Mil Med Univ, 2016, 38(24): 2600–2605. DOI:10.16016/j.1000-5404.201606125 |
| [14] |
殷香保, 邬林泉, 黄长文, 等. 阿霉素纳米-VEGFR2单抗交联物的抗肝癌作用[J].
广东医学, 2014, 35(19): 2972–2975.
YIN X B, WU L Q, HUANG C W, et al. The effect of adriamycin nanoparticles-VEGFR2 monoclonal antibody on hepatic carcinoma[J]. Guangdong Med J, 2014, 35(19): 2972–2975. DOI:10.13820/j.cnki.gdyx.2014.19.002 |



