非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指除酒精和其他明确因素所致的以肝实质细胞脂肪变性和脂肪贮积为主要特征的临床病理综合征[1]。慢性肝损伤到后期几乎都会发展为肝纤维化,若纤维化进程得不到有效控制或逆转则可发展为各种终末期肝病(如肝硬化、原发性肝癌等),严重影响患者的生存质量和预后。目前NAFLD肝纤维化的发病机制尚不十分清楚,亦缺乏有效的防治措施。研究表明,肝纤维化发生发展的核心环节是肝星状细胞(hepatic stellate cells,HSC)的活化[2]。活化的HSC通过增殖和分泌大量细胞外基质(extracellular matrix,ECM)而促进肝纤维化。近年来研究发现,Smad家族蛋白是肝纤维化过程中关键的分子,转化生长因子β(transforming growth factor beta,TGF-β)作为肝内重要的细胞因子,能够通过影响Smad家族蛋白分子如Smad2/3、Smad4、Smad7等表达或活性,调控HSC活化和ECM的分泌,最终影响NAFLD肝纤维化进程[3-5]。
二氢杨梅素(dihydromyricetin, DHM),又名蛇葡萄素(ampelopsin),属于多酚类中的黄酮类化合物,具有抗氧化、降血脂、保肝等诸多功效[6]。本课题组前期研究发现,DHM能够有效改善NAFLD人群的糖脂代谢紊乱、减轻炎性反应,并在重要的代谢组织骨骼肌和脂肪组织具有潜在效应靶点[7-9]。本课题组在研究DHM对长期高脂饮食诱导的NAFLD小鼠肝脏脂质沉积和炎性反应影响的过程中,意外发现DHM可明显减轻肝纤维化,但作用机制尚不清楚[10]。本研究利用体外培养的大鼠HSC细胞株,观察DHM对HSC活化的影响及活化相关基因表达,初步探讨TGF-β/Smad信号通路在介导DHM抑制HSC细胞活化中的作用机制。
1 材料与方法 1.1 细胞与主要试剂大鼠肝星状细胞株HSC-T6购自中国科学院昆明细胞库。DHM购自成都曼思特生物科技有限公司,纯度为99.57%。DMEM培养基、胎牛血清和胰蛋白酶(美国HyClone公司),大鼠重组TGF-β1(美国Peprotech公司),CCK-8试剂盒(日本Dojindo公司),Annexin V-FITC凋亡检测试剂盒和细胞周期检测试剂盒(碧云天生物科技有限公司),MMP-1、TIMP-1和COL-ⅠELISA检测试剂盒(北京诚林生物科技有限公司),总RNA提取试剂盒和SYBR Premix Ex TaqTM试剂盒(TaKaRa公司), AMPK抑制剂Compound C(上海碧云天公司), 兔抗鼠AMPK、p-AMPK、Smad2/3、p-Smad2/3、Smad7、α-SMA一抗(英国Abcam公司), 兔抗鼠GAPDH一抗(武汉博士德生物工程有限公司), HRP标记的羊抗兔IgG(北京中杉金桥生物公司), 所有引物由上海生物工程有限公司合成。
1.2 细胞培养HSC-T6细胞以含10%胎牛血清的DMEM高糖培养基培养于37 ℃、5% CO2、100%饱和湿度的细胞培养箱内,至80%~90%融合后进行消化传代,取对数生长期细胞进行后续实验。
1.3 方法 1.3.1 CCK-8法检测细胞增殖活力取对数生长期HSC-T6细胞,以4×104/mL接种于96孔板,每孔100 μL,每组设6个复孔。培养24 h后,分别加入不同浓度(终浓度分别为0.1、1.0、5.0、10.0、20.0、40.0、60.0、80.0、100.0 μmol/L)的DHM干预24 h,按照10 μL/孔加入CCK-8试剂,1 h后在波长450 nm测定各孔光密度值。对照组细胞活力设为100%,计算各组相对于对照组的细胞活力。筛选对细胞增殖活力无显著影响的DHM工作浓度。为进一步检测DHM对TGF-β1诱导的HSC-T6增殖活力的影响,HSC-T6细胞以5 ng/mL的TGF-β1处理2 h后,再以不同浓度(0.1、1.0、5.0、10.0、30.0、60.0、80.0、100.0 μmol/L)的DHM继续处理24 h,CCK-8法检测各组细胞活力。
1.3.2 Annexin V-FITC/PI双染及流式细胞术检测细胞凋亡实验分为对照组、TGF-β1处理组、TGF-β1+ DHM 30.0 μmol/L组和单独DHM组(30.0、60.0、90.0 μmol/L)。HSC-T6细胞以5×104接种于12孔板,每组3个复孔。培养24 h后以5 ng/mL的TGF-β1处理2 h后加DHM继续处理24 h。收集各组处理后的HSC-T6细胞,按照Annexin V-FITC/PI凋亡检测试剂盒说明书对细胞进行染色,并用流式细胞仪进行细胞凋亡检测。
1.3.3 流式细胞仪检测细胞周期细胞处理及分组同1.3.2,每组设3个平行样。收集各组处理后的细胞,按照细胞周期检测试剂盒说明书进行染色,并用流式细胞仪进行细胞周期检测,比较各组G0/G1、S、G2/M期的差异。
1.3.4 ELISA法检测培养上清液中MMP-1、TIMP-1和COL-Ⅰ表达通过上述实验筛选出DHM的最适工作浓度为30.0 μmol/L,因此本实验分为4个组:对照组、TGF-β1处理组、TGF-β1+30.0 μmol/L DHM组、30.0 μmol/L DHM组;接种细胞于12孔板中,每组3个复孔。培养24 h后以5 ng/mL的TGF-β1处理2 h后加DHM 30.0 μmol/L继续处理24 h。收集各组处理后的细胞培养液上清液1 mL,在4 ℃、3 000 r/min下离心20 min。按照ELISA试剂盒操作说明分别检测MMP-1、TIMP-1和COL-Ⅰ的浓度。用酶标仪在波长450 nm处读取光密度值,根据各指标的标准曲线计算其含量。
1.3.5 激光共聚焦显微镜检测细胞内α-SMA表达HSC-T6细胞培养于活细胞培养皿中,细胞分组及处理同1.3.4。按照常规方法对细胞进行免疫细胞化学染色,以α-SMA抗体(稀释比例1 :500)4 ℃孵育过夜,FITC标记的二抗(稀释比例为1 :500)室温孵育1 h,激光共聚焦显微镜观察细胞内α-SMA表达。阳性细胞的判断:每个活细胞培养皿随机选取5个视野,每组至少选择3个活细胞培养皿,计算平均荧光强度。
1.3.6 qRT-PCR法检测相关基因mRNA表达使用TRIzol裂解细胞,提取细胞总RNA,将RNA逆转录为cDNA。配置20 μL的PCR反应体系,反应参数为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,40个循环。引物序列如表 1所示,以β-actin为内参,用2-△△Ct法计算各组基因的相对表达量。
| 基因 | 引物序列 | 产物长度(bp) | |
| 正义链 | 反义链 | ||
| COL-Ⅰ | 5′-TACAGCACGCTTGTGGATG-3′ | 5′-TTGAGTTTGGGTTGTTGGTC-3′ | 256 |
| COL-Ⅲ | 5′-GGAACAACTGATGGTGCTACTG-3′ | 5′-CCTAAGAGAGGGGTGAAG-3′ | 148 |
| TIMP-1 | 5′-TGCAACTCGGACCTGGTTAT-3′ | 5′-GAGCAGGGCTCAGATTATGC-3′ | 298 |
| MMP-1 | 5′-CAGGTGCAACAACACCACAT-3′ | 5′-GCTCAGCTTCTGGCATGAAC-3′ | 132 |
| Smad2 | 5′-CCGAGATCTCACCGACTACC-3′ | 5′-TCCAGAGCGACATAGCACA-3′ | 120 |
| Smad3 | 5′-GACGCAGGCTCTCCAAACCT-3′ | 5′-TTGGACAGCAGGCCCAGACA-3′ | 227 |
| Smad4 | 5′-GGTGGCTGGTCGGAAAGGATT-3′ | 5′-TAGGCGGGTGGTGCTGAAGA-3′ | 632 |
| Smad7 | 5′-GGTGCTCAAGAAACTCAAGGAG-3′ | 5′-AGTAAGGAGGAGGGGGAGACT-3′ | 341 |
| β-actin | 5′-ACCAACTGGGACGATATGGAGAAGA-3′ | 5′-ACGACCAGAGGCATACAGGGACAA-3′ | 213 |
1.3.7 Western blot检测相关蛋白表达
提取细胞总蛋白,按每孔50 μg蛋白上样,进行聚丙烯酰胺凝胶电泳。湿转(220 mA,2 h)转移蛋白至PVDF膜上,5%脱脂奶粉封闭2 h,在4 ℃分别用Smad2/3、p-Smad2/3、Smad4、Smad7、AMPK、p-AMPK、GAPDH抗体孵育过夜, 加入相应的辣根过氧化酶标记的山羊抗兔二抗,室温孵育1 h后,采用Fusion FX分子成像仪(Vilber Lourmat)对目的条带进行灰度值分析,比较各组目的蛋白表达差异。
1.4 统计学分析以上每个实验至少重复3次,取平均值。计量资料采用x±s表示,使用GraphPad Prism 6.0软件作图,采用SPSS 17.0统计软件对数据进行统计分析,多个处理组间比较采用双因素方差分析,组间两两比较采用Tukey Post-Hoc检验。P<0.05表示差异有统计学意义。
2 结果 2.1 DHM对HSC-T6细胞增殖活力的影响用不同浓度(0.1~100.0 μmol/L)的DHM作用于HSC-T6细胞24 h后,CCK-8法检测各组细胞活力,结果显示在DHM低剂量(< 40.0 μmol/L)处理时,HSC-T6细胞活力变化不明显(P > 0.05);当DHM作用浓度超过40.0 μmol/L时,细胞活力随DHM处理浓度的增加而显著降低,差异具有统计学意义(P < 0.05,图 1A)。进一步观察DHM对TGF-β1诱导的HSC-T6细胞增殖活力,发现与对照组比较,5 ng/mL TGF-β1对HSC-T6细胞具有明显的增殖促进作用(P < 0.05);而DHM处理后,能够明显抑制活化的HSC-T6细胞的增殖活力(P < 0.05,图 1B)。表明,TGF-β1对HSC-T6细胞具有明显增殖促进作用,而DHM能够明显抑制TGF-β1的作用。
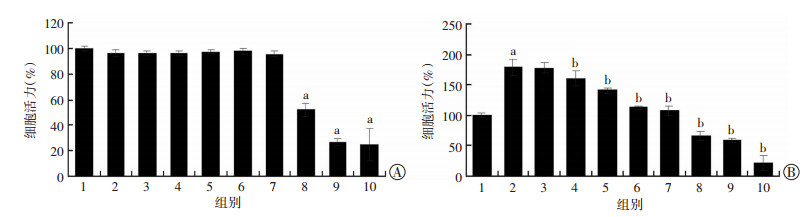
|
| A: CCK-8法检测DHM对HSC-T6细胞活力的影响 1:对照组,2~10:分别为0.1、1.0、5.0、10.0、20.0、40.0、60.0、80.0、100.0 μmol/L的DHM a:P < 0.05,与对照组比较;B: CCK-8法检测DHM对TGF-β1诱导的HSC-T6细胞活力的影响 1:对照组,2:TGF-β1处理组,3~10:分别为TGF-β1(5 ng/mL)处理后,再加不同浓度(0.1、1.0、5.0、10.0、30.0、60.0、80.0、100.0 μmol/L)DHM处理组 a:P < 0.05,与对照组比较,b: P < 0.05,与TGF-β1处理组比较 图 1 CCK-8法检测HSC-T6细胞增殖活力 |
2.2 DHM对TGF-β1诱导的HSC-T6细胞凋亡的影响
Annexin V-FITC/PI细胞凋亡检测结果(表 2)显示:与对照组(未发生凋亡)比较,TGF-β1对细胞凋亡无明显影响,但经30.0 μmol/L DHM干预后,与TGF-β1组比较,早期凋亡率、晚期凋亡率和总凋亡率均显著增加(P < 0.05)。同时,不同浓度的DHM单独处理组与对照组比较,30 μmol/L的DMH对细胞凋亡无显著影响,其他处理浓度有明显的促凋亡作用。表明DHM对HSC-T6细胞有明显促凋亡作用。
| 组别 | 早期凋亡率 | 晚期凋亡率 | 总凋亡率 |
| 对照组 | 0.665±0.671 | 0.239±0.273 | 0.904±0.942 |
| TGF-β1处理组 | 0.799±0.408 | 1.597±0.483a | 2.396±0.801 |
| TGF-β1+DHM 30.0μmol/L组 | 9.743±1.005b | 8.273±1.088b | 18.017±0.764b |
| DHM 30.0 μmol/L | 1.379±0.473 | 1.757±0.629 | 3.163±0.371 |
| DHM 60.0 μmol/L | 19.233±3.177a | 8.850±0.979a | 28.083±2.754a |
| DHM 90.0 μmol/L | 36.367±2.793a | 10.723±1.972a | 47.090±4.695a |
| a: P < 0.05, 与对照组比较;b: P < 0.05, 与TGF-β1组比较 | |||
2.3 DHM对TGF-β1诱导的HSC-T6细胞周期改变的影响
流式细胞仪检测细胞周期(表 3)结果显示:与对照组比较,TGF-β1组G0/G1期比例降低,S期和G2/M期比例增加(P < 0.05)。与TGF-β1组相比较,TGF-β1+ DHM 30.0 μmol/L组G0/G1期比例升高,S期与G2/M比例降低(P < 0.05)。不同浓度的DHM处理后,30.0 μmol/L组对细胞周期影响不明显(P > 0.05),其他处理浓度处理后,随浓度增加G0/G1期比例降低、S期和G2/M期比例增加。提示DHM可明显影响HSC-T6细胞的周期。
| 组别 | G0/G1期 | S期 | G2/M期 |
| 对照组 | 53.85±0.915 | 28.51±1.005 | 16.57±0.439 |
| TGF-β1处理组 | 33.13±1.882a | 37.72±1.072a | 29.20±1.071a |
| TGF-β1+DHM 30.0 μmol/L组 |
45.26±0.921b | 30.35±0.558b | 24.64±0.151b |
| DHM 30.0 μmol/L组 | 52.25±2.299 | 32.78±3.854 | 13.12±5.849 |
| DHM 60.0 μmol/L组 | 44.06±0.263a | 29.45±2.030a | 26.45±0.805a |
| DHM 90.0 μmol/L组 | 33.68±2.005a | 35.72±1.081a | 30.36±1.957a |
| a: P < 0.05,与对照组比较;b: P < 0.05,与TGF-β1处理组比较 | |||
2.4 DHM对TGF-β1诱导的HSC-T6细胞MMP-1、TIMP-1和COL-Ⅰ分泌的影响
与对照组比较,TGF-β1能够使得HSC-T6细胞分泌的细胞外基质TIMP-1和COL-Ⅰ水平增加(P < 0.05),MMP-1水平降低。与TGF-β1处理组比较,TGF-β1+30.0 μmol/L的DHM可以显著升高MMP-1水平并降低TIMP-1和COL-Ⅰ水平(P < 0.05,表 4)。结果表明,DHM能够显著影响活化的HSC-T6细胞MMP-1、TIMP-1和COL-Ⅰ的分泌。
| 组别 | MMP-1(μg/L) | TIMP-1(pg/mL) | COL-Ⅰ(μg/L) |
| 对照组 | 101.46±1.483 | 3 844.56±73.84 | 31.64±1.18 |
| TGF-β1处理组 | 31.93±15.39a | 7 591.27±178.41a | 57.72±1.90a |
| TGF-β1+30.0 μmol/L DHM组 |
260.95±24.78b | 4 589.59±252.36b | 44.27±1.52b |
| 30.0 μmol/LDHM组 | 359.27±21.28a | 2 549.87±73.75a | 21.64±0.77a |
| a: P < 0.05,与对照组比较;b: P < 0.05,与TGF-β1处理组比较 | |||
2.5 DHM对HSC-T6细胞内α-SMA表达的影响
激光共聚焦显微镜观察结果显示,TGF-β1诱导HSC-T6后α-SMA表达较对照组增加(P < 0.05);培养24 h的HSC-T6细胞经TGF-β1诱导后再加入30 μmol/L的DHM处理后,α-SMA表达较TGF-β1处理组明显降低(P < 0.05)。直接加入30 μmol/L的DHM处理24 h后,与对照组相比α-SMA表达降低(P < 0.05,图 2、3)。
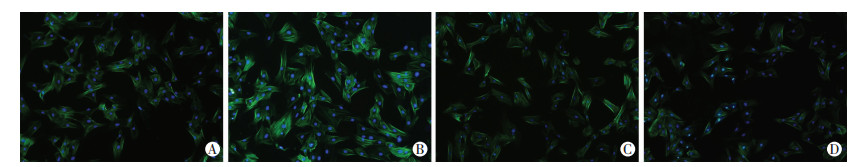
|
|
绿色荧光代表α-SMA,蓝色荧光为细胞核 A:对照组;B: TGF-β1处理组;C: TGF-β1+30.0 μmol/L DHM组;D:30.0 μmol/L DHM组 图 2 激光共聚焦显微镜检测各组细胞内α-SMA的表达 (×400) |

|
|
1:对照组;2: TGF-β1处理组;3: TGF-β1+30.0 μmol/L DHM组;4:30.0 μmol/L DHM组 a: P < 0.05,与对照组比较;b: P < 0.05,与TGF-β1处理组比较 图 3 定量分析各组细胞α-SMA表达的平均荧光强度 |
2.6 DHM对HSC-T6细胞活化相关基因转录水平影响
qRT-PCR检测结果(图 4)显示,与对照组比较,TGF-β1处理组COL-Ⅰ、COL Ⅲ和TIMP-1的mRNA表达水平明显增加(P < 0.05),MMP-1表达水平降低。结果提示,TGF-β1能诱导的HSC-T6细胞COL-Ⅰ、COL-Ⅲ、TIMP-1和MMP-1的mRNA表达。而DHM处理后,COL-Ⅰ、COL-Ⅲ、TIMP-1的mRNA表达与TGF-β1处理组比较明显降低,而MMP-1 mRNA表达明显升高。表明DHM能够明显调节HSC-T6细胞ECM相关因子的转录水平。
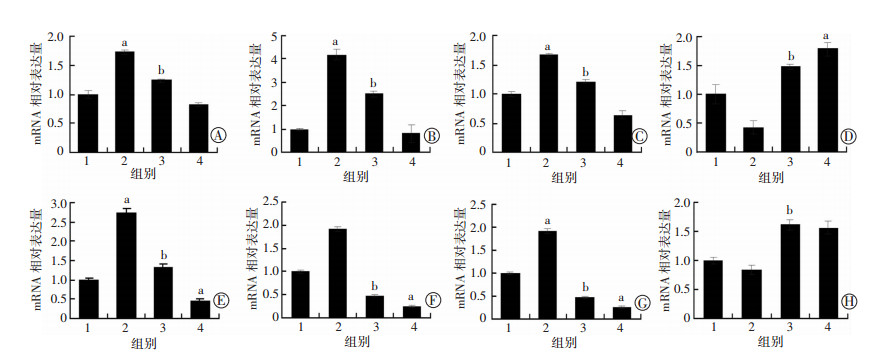
|
|
A:COL-Ⅰ;B:COL-Ⅲ;C:TIMP-1;D:MMP-1;E:Smad2;F:Smad3;G:Smad4;H:Smad7 1:对照组;2:TGF-β1组;3:TGF-β1+30.0 μmol/L DHM组;4:30.0 μmol/L DHM组 a: P < 0.05,与同一基因对照组比较;b: P < 0.05,与同一基因TGF-β1处理组比较 图 4 qRT-PCR检测HSC-T6活化相关基因的mRNA表达 |
与对照组比较,TGF-β1能够增加HSC-T6细胞Smad2、Smad3和Smad4 mRNA表达增加(P < 0.05);DHM处理后,与TGF-β1处理组比较,Smad2、Smad3和Smad4的mRNA表达水平明显下降(P < 0.05),而Smad7 mRNA表达水平则显著升高(P < 0.05)。表明DHM能够显著影响活化的HSC-T6的Smad家族基因的mRNA表达。
2.7 DHM对TGF-β1诱导的HSC-T6细胞活化相关蛋白表达的影响Western blot检测结果(图 5)显示,TGF-β1处理细胞后,AMPK磷酸化降低和Smad2/3磷酸化增加(P < 0.05);使用DHM干预后,AMPK磷酸化增加,而Smad2/3的磷酸化下降(P < 0.05)。使用AMPK抑制剂Compound C预处理后,DHM抑制了TGF-β1诱导的HSC-T6细胞中AMPK和Smad2/3的磷酸化。同时,DHM能够显著促进活化的HSC-T6细胞Smad7表达增加。表明DHM能够显著影响活化的HSC-T6细胞活化相关蛋白表达。
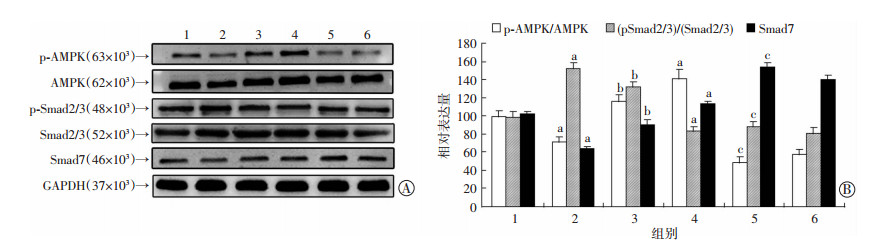
|
| A:Western blot检测蛋白表达水平 1:对照组,2:TGF-β1处理组,3:TGF-β1+30.0 μmol/L DHM组,4:30.0 μmol/L DHM组,5: TGF-β1+Compound C+30.0 μmol/L DHM组,6:Compound C组;B:半定量分析 a:P < 0.05,与对照组比较,b: P < 0.05,与TGF-β1处理组比较,c: P < 0.05,与TGF-β1+30.0 μmol/L DHM组比较 图 5 Western blot检测HSC-T6细胞活化相关蛋白表达 |
3 讨论
本研究发现,DHM对TGF-β1诱导的HSC-T6细胞的活化有显著的抑制作用,能够影响COL-Ⅰ、COL-Ⅲ、TIMP-1和MMP-1等ECM的分泌和表达,可能与其通过磷酸化AMPK进而影响活化相关基因Smad蛋白(主要是Smad2/3、Smad7)表达或活性有关。DHM在药食两用植物藤茶中含量甚高,在嫩茎叶中含量高达30%以上(以干质量计),远远高于藤茶中其他黄酮类化合物(如木樨曹素、槲皮素)。藤茶作为饮品在我国南方地区被民众长期食用,不仅食用安全,而且据报道具有抗氧化、降血脂、保肝等诸多功效[11]。本课题利用体外培养的HSC-T6细胞,研究DHM对肝星状细胞活化的影响及机制,有望为NAFLD肝纤维化患者提供新的膳食营养干预策略,并对开发基于DHM的治疗性药物提供重要实验依据。
HSC活化是NAFLD肝纤维化发生的中心环节,其中α-SMA是活化HSC的特征标志之一。活化的HSC细胞表达特征性抗原α-SMA,分泌多种ECM,主要包括Ⅰ、Ⅲ型胶原,蛋白多糖,糖蛋白等,进而促进肝纤维疤痕的产生[12]。大量研究表明,ECM可与HSC细胞膜上相应受体结合后通过多种信号转导通路调节细胞内基因表达,进一步促进HSC细胞活化。TGF-β1是重要的细胞因子,在各种肝脏疾病中发挥着重要的调节作用[13]。TGF-β1/Smad通路在HSC的活化,ECM合成和降解中发挥着重要作用。TGF-β1通过HSC细胞表面的特异性受体TGFRⅡ促进HSC细胞活化、表型转化及分化。本实验利用外源性的TGF-β1作用于HSC-T6细胞,并观察其对细胞活化、细胞凋亡、细胞周期、ECM分泌等方面的影响,发现TGF-β1对体外培养的HSC-T6细胞有明显的活化作用,而DHM处理后,能够显著抑制TGF-β1诱导的HSC-T6细胞活化。在肝纤维化进程中HSC活化,TGF-β1首先与胞膜上Ⅱ型受体结合,然后传递给Ⅰ型受体,TGF-β1Ⅰ型受体与Smad2/3结合使其磷酸化,磷酸化的Smad2/3与Smad4结合后转位至细胞核,从而与特定DNA序列结合,调控特异性靶基因特别是ECM相关的基因表达。而Smad7可以抑制Smad2/3介导的基因表达[12]。KOBAYASHI等[14]研究发现,在Smad3基因敲除大鼠肝纤维化发生时其肝脏Ⅰ型胶原表达较野生型大鼠降低,但α-SMA无明显变化,表明活化的HSC的胶原合成必须要有Smad3的参与。进一步研究Smad蛋白在DHM抑制TGF-β1诱导的HSC-T6细胞活化中的作用,发现DHM能够显著影响Smad家族蛋白Smad2/3、Smad7的表达和活性,提示DHM可能通过调节Smad家族蛋白表达影响ECM分泌,进而发挥抗肝纤维化作用。近年来研究发现,AMPK在调节细胞多种生物学功能中发挥重要作用。本实验室前期研究提示AMPK可能是DHM在多种细胞内的潜在作用靶点[15]。而本研究提示,DHM能够在肝星状细胞内通过作用于AMPK抑制TGF-β1/Smad通路的信号传导并减少ECM的产生,抑制HSC活化[15]。
本实验研究发现了DHM能抑制HSC-T6细胞的活化和ECM分泌,该作用可能通过促进AMPK磷酸化进而影响TGF-β1/Smad信号通路介导的ECM相关基因表达而实现。本研究为后续开展动物实验进一步观察DHM在体内对HSC的作用奠定了基础。本研究虽然提示DHM可通过活化AMPK进而影响TGF-β1/Smad信号通路,但是DHM如何通过AMPK影响Smad介导的下游转录调控机制,进而减少ECM的分泌尚不明确,有待在体外实验中深入研究。另外,DHM如何调节AMPK的活性,以及有无直接作用靶点还需要通过动物实验进一步阐明。
| [1] | ESLAMPARAST T, TANDON P, RAMAN M. Dietary composition independent of weight loss in the management of non-alcoholic fatty liver disease[J]. Nutrients, 2017, 9(8). DOI:10.3390/nu9080800 |
| [2] | DE OLIVEIRA D S B, RAMOS L F, Moraes K. Molecular interplays in hepatic stellate cells: apoptosis, senescence, and phenotype reversion as cellular connections that modulate liver fibrosis[J]. Cell Biol Int, 2017, 41(9): 946–959. DOI:10.1002/cbin.10790 |
| [3] | YOSHIDA K, MATSUZAKI K. Differential regulation of TGF-beta/Smad signaling in hepatic stellate cells between acute and chronic liver injuries[J]. Front Physiol, 2012, 3: 53. DOI:10.3389/fphys.2012.00053 |
| [4] | YAMANAKA Y, GINGERY A, OKI G, et al. Blocking fibrotic signaling in fibroblasts from patients with carpal tunnel syndrome[J]. J Cell Physiol, 2017. DOI:10.1002/jcp.25901.[Epubaheadofprint |
| [5] |
艾志波, 张荣华, 闫国和, 等. 鳖甲煎改良方对大鼠肝纤维化的作用及其机制研究[J].
第三军医大学学报, 2011, 33(3): 274–277.
AI Z B, ZHANG R H, YAN G H, et al. Effect of modified turtle shell decoction on hepatic fibrosis in rats and its mechanism[J]. J Third Mil Med Univ, 2011, 33(3): 274–277. |
| [6] | HUANG Y, ZHAO J, JIAN W, et al. Effects of verapamil on the pharmacokinetics of dihydromyricetin in rats and its potential mechanism[J]. Xenobiotica, 2017: 1–6. DOI:10.1080/00498254.2017.1366576.[Epubaheadofprint |
| [7] | CHEN S, ZHAO X, WAN J, et al. Dihydromyricetin improves glucose and lipid metabolism and exerts anti-inflammatory effects in nonalcoholic fatty liver disease:A randomized controlled trial[J]. Pharmacol Res, 2015, 99: 74–81. DOI:10.1016/j.phrs.2015.05.009 |
| [8] | SHI L, ZHANG T, ZHOU Y, et al. Dihydromyricetin improves skeletal muscle insulin sensitivity by inducing autophagy via the AMPK-PGC-1alpha-Sirt3 signaling pathway[J]. Endocrine, 2015, 50(2): 378–389. DOI:10.1007/s12020-015-0599-5 |
| [9] | ZHOU Q, CHEN K, LIU P, et al. Dihydromyricetin stimulates irisin secretion partially via the PGC-1alpha pathway[J]. Mol Cell Endocrinol, 2015, 412: 349–357. DOI:10.1016/j.mce.2015.05.036 |
| [10] | CHEN S, ZHAO X, WAN J, et al. Dihydromyricetin improves glucose and lipid metabolism and exerts anti-inflammatory effects in nonalcoholic fatty liver disease:A randomized controlled trial[J]. Pharmacol Res, 2015, 99: 74–81. DOI:10.1016/j.phrs.2015.05.009 |
| [11] | ZHOU B, ZHAO Y, WANG X, et al. Unravelling the inhibitory effect of dihydromyricetin on heterocyclic aromatic amines formation[J]. J Sci Food Agric, 2017. DOI:10.1002/jsfa.8682.[Epubaheadofprint |
| [12] | PERUMAL N, PERUMAL M, HALAGOWDER D, et al. Morin attenuates diethylnitrosamine-induced rat liver fibrosis and hepatic stellate cell activation by co-ordinated regulation of Hippo/Yap and TGF-beta1/Smad signaling[J]. Biochimie, 2017, 140: 10–19. DOI:10.1016/j.biochi.2017.05.017 |
| [13] |
唐静, 戴立里, 呙琳琳, 等. 肝纤维化中丹参素对TGFβ_1/Smads/ERK信号通路的影响及其相互关系[J].
第三军医大学学报, 2011, 33(11): 1159–1164.
TANG J, DAI L L, GUO L L, et al. Tanshinol inhibits TGFβ1/Smads/ERK signaling pathways in rat hepatic stellate cells[J]. J Third Mil Med Univ, 2011, 33(11): 1159–1164. |
| [14] | KOBAYASHI T, KIM H, LIU X, et al. Matrix metalloproteinase-9 activates TGF-beta and stimulates fibroblast contraction of collagen gels[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306(11): L1006–L1015. DOI:10.1152/ajplung.00015.2014 |
| [15] | SHI L, ZHANG T, ZHOU Y, et al. Dihydromyricetin improves skeletal muscle insulin sensitivity by inducing autophagy via the AMPK-PGC-1alpha-Sirt3 signaling pathway[J]. Endocrine, 2015, 50(2): 378–389. DOI:10.1007/s12020-015-0599-5 |



