2. 610021 成都,四川省第四人民医院药剂科;
3. 401331 重庆,重庆医药高等专科学校
2. Fourth People's Hospital of Sichuan Province, Chengdu, Sichuan Province, 610021;
3. Chongqing Medical and Pharmaceutical College, Chongqing, 401331, China
帕金森病(parkinson disease,PD)常发生于中老年人,是以黑质纹状体多巴胺(dopamine,DA)系统变性为主的中枢神经系统变性疾病,其临床症状主要为震颤、运动障碍及肌强直[1]。随着人口的老龄化,帕金森发病率不断提高,我国有260多万帕金森的患者,给社会和经济造成沉重负担[2]。目前临床上常用的药物为多巴胺替代药物,用于改善临床症状,但长期治疗后容易产生开关现象、精神症状及运动障碍等不良反应。贝沙罗汀是美国Ligand制药公司研制的高效抗癌药,用于皮肤T-细胞淋巴瘤的治疗,不良反应比较少,虽然长期使用后会出现血脂异常,但停药后即可恢复。基于这个原因,贝沙罗汀在其他疾病领域的应用成为可能。目前国内外对贝沙罗汀的研究重心从其抗肿瘤作用逐渐转移到神经保护作用,国外已有多篇贝沙罗汀在神经领域的应用的论文在学术界引起较大轰动。有研究[3]证实其能快速消除β-淀粉样蛋白,而这种作用与贝沙罗汀减少β-淀粉样蛋白生成有关,贝沙罗汀有望成为治疗阿尔兹海默症的特效药。然而贝沙罗汀用于帕金森疾病的研究并不多,仅有的研究发现贝沙罗汀能修复帕金森大鼠的多巴胺神经元[4]。本研究将以帕金森大鼠为模型,探讨贝沙罗汀对黑质纹状体神经元的保护作用,以期为贝沙罗汀新的潜在的药理作用奠定理论基础。
1 材料 1.1 实验动物健康成年SD大鼠50只,雄性,3.0~3.5个月,体质量300~350 g,由四川大学实验动物中心提供。
1.2 材料刺五加总苷(纯度≥98%,南京泽朗医药科技有限公司),将刺五加总苷溶解于生理盐水中,配成25 mg/mL的溶液备用;6-羟多巴胺、山羊抗α-SYN抗体、小鼠抗大鼠AKT、p-AKT、GSK-3β、p-GSK-3β、mTOR、p-mTOR、β-actin(Sigma),TUNEL试剂盒(碧云天),DAB显色剂(北京中杉金桥生物科技有限公司)。大鼠脑立体定位仪(KOPF公司),正置荧光显微镜、凝胶成像系统(日本尼康)。
1.3 方法 1.3.1 建立帕金森大鼠模型采用随机数字表法将50只SD大鼠分为5组,用水合氯醛按照400 mg/kg的剂量腹腔注射麻醉,备皮、固定于脑立体定位仪上,切开头皮,暴露前囟,根据脑立体定位图谱找到右侧纹状体的位置,除假手术组以外各组大鼠于硬膜下4.5 mm和5.2 mm两种深度各注射2 μL浓度为3 μg/μL的6-羟多巴胺,注射速度约为1 μL/min,注射完毕后,针头滞留5 min后缓缓拔出。假手术组手术操作步骤一致,仅注射生理盐水。造模后2周,向大鼠腹腔注射浓度为0.01%的阿扑吗啡0.5 mg/kg(apomorphine,APO),于旋转检测仪中观察其旋转,记录30 min内旋转的次数。将恒定向左旋转,并且旋转次数≥7圈/min的大鼠视为帕金森模型造模成功。
1.3.2 给药和分组实验分为假手术组,帕金森模型组,贝沙罗汀高、中、低剂量组。贝沙罗汀高、中、低剂量组于建模后第1天开始分别按照100、50 mg/kg和25 mg/kg的剂量灌胃,每日1次,连续4周。假手术组和模型组仅灌胃相应容积的生理盐水。
1.3.3 行为学检测给药后第4周,再次用APO诱导大鼠向左侧旋转,记录30 min内旋转的次数,并计算大鼠向左旋转平均速度。通过圆筒实验检测大鼠左前肢使用率:观察5 min内大鼠左右侧前肢分别触碰和同时触碰筒壁的次数,左前肢使用率=(左侧次数+0.5×双侧次数)/(右侧次数+左侧次数+双侧次数)×100%。
1.3.4 TUNEL检测黑质神经元的凋亡每组取5只大鼠,经水合氯醛麻醉后,开胸暴露心脏,左心室插管注入生理盐水冲干血液,取出脑组织,放置于固定液中进行4~6 h固定,再用20%和30%的蔗糖液进行梯度脱水。石蜡包埋黑质,制成厚度为7 μm的冠状切片备用。严格按照TUNEL凋亡试剂盒的方法检测黑质神经元的凋亡情况,倒置显微镜下进行观察,TUNEL阳性细胞为深棕褐色。400倍下每张切片随机观察5个非连续的视野,计算其中阳性细胞数量。
1.3.5 免疫组化法检测黑质部位α-SYN的表达严格按照免疫组化试剂盒的要求,对由上一步骤得到的切片进行染色操作,α-SYN一抗滴加浓度为1:500。
1.3.6 Western blot检测mTOR、p-mTOR、AKT、p-AKT、GSK-3β、p-GSK-3β蛋白的表达每组剩余5只大鼠断头取脑,冰袋上迅速分离黑质,放置于-80 ℃液氮中备用。称量后,加入RIPA Lysis Buffer,于4 ℃下用匀浆器充分研磨,12 000 r/min转速离心20 min,取上清液,经BCA蛋白定量,加入5×Loading buffer,于100 ℃条件下煮5 min。配制好10%的SDS-PAGE,取50 μg蛋白进行电泳,转移到PVDF膜上,再用5%的脱脂奶粉于室温下封闭1 h。随后条带移入mTOR、p-mTOR(Ser2448)、AKT、p-AKT(Ser473)、GSK-3β和p-GSK-3β(Ser9)(1:1 000)和小鼠抗β-actin(1:1 000)孵育盒中于4 ℃条件下过夜。复温1 h后,再用含0.05%室温Tween-20的PBST进行3次冲洗,每次10 min;随后加入1:2 500的辣根过氧化物酶标记的二抗,室温孵育1~2 h;再用PBST进行3次冲洗,每次10 min。ECL化学发光法检测GSK-3β和TNF-α蛋白的表达水平。
1.4 统计学分析采用SPSS 20.0统计软件,计量资料以x±s表示,对转圈数、转速、左前肢使用率、凋亡阳性细胞数及各蛋白表达的组间比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 行为学检测结果大鼠转圈数结果显示,造模后2周,假手术组大鼠未出现转圈行为,模型组大鼠和贝沙罗汀高、中、低剂量组均出现恒定向左旋转行为,并且旋转次数≥7圈/min,说明帕金森模型造模成功。模型组转圈数显著高于贝沙罗汀高、中、低剂量组(P < 0.01),贝沙罗汀各组间差异无统计学意义(P > 0.05,表 1)。造模后4周,测量大鼠转速结果显示:与模型组相比,贝沙罗汀高、中、低剂量组转速显著降低(P < 0.01),贝沙罗汀各组间转速差异无统计学意义(P > 0.05)。圆筒实验结果显示:贝沙罗汀高、中、低剂量组左前肢使用率显著高于模型组(P < 0.01),贝沙罗汀各组间左前肢使用率差异无统计学意义(P > 0.05);贝沙罗汀高、中、低剂量组旋转速度显著低于模型组(P < 0.01,表 2)。
| 组别 | 造模后2周 | 造模后4周 |
| 假手术组 | 0 | 0 |
| 模型组 | 220±17 | 235±12 |
| 贝沙罗汀高剂量组 | 120±11a | 106±8a |
| 贝沙罗汀中剂量组 | 133±15a | 128±13a |
| 贝沙罗汀低剂量组 | 146±16a | 142±15a |
| a: P < 0.01,与模型组比较 | ||
| 组别 | 旋转速度(r/min) | 左前肢使用率(%) |
| 假手术组 | 0 | 50.23±2.86b |
| 模型组 | 5.25±1.56 | 22.45±3.37a |
| 贝沙罗汀高剂量组 | 1.44±0.64b | 40.45±3.22ab |
| 贝沙罗汀中剂量组 | 1.87±0.78b | 39.14±2.98ab |
| 贝沙罗汀低剂量组 | 2.03±0.74b | 35.50±2.71ab |
| a: P < 0.01,与假手术组比较;b:P < 0.01,与模型组比较 | ||
2.2 TUNEL检测神经元凋亡结果
凋亡神经元阳性细胞为深棕褐色细胞。与假手术组比较,模型组大鼠和贝沙罗汀高、中、低剂量组阳性细胞表达显著增加(P < 0.01);与模型组比较,贝沙罗汀高、中、低剂量组阳性细胞表达显著降低(P < 0.01),贝沙罗汀各组阳性细胞表达差异无统计学意义(P > 0.05,表 3,图 1)。
| 组别 | 阳性细胞 | α-SYN |
| 假手术组 | 2.12±1.30 | 6.22±1.30 |
| 模型组 | 55.76±6.99a | 48.62±5.34a |
| 贝沙罗汀高剂量组 | 27.04±3.13ab | 30.36±3.53ab |
| 贝沙罗汀中剂量组 | 34.45±5.18ab | 33.55±4.01ab |
| 贝沙罗汀低剂量组 | 37.22±5.05ab | 36.20±3.77ab |
| a: P < 0.01,与假手术组比较;b:P < 0.01,与模型组比较 | ||
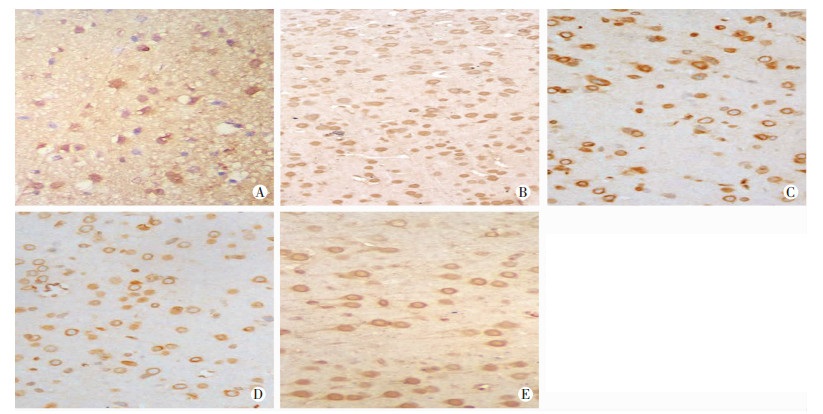
|
| A:假手术组;B:模型组;C:贝沙罗汀高剂量组;D:贝沙罗汀中剂量组;E:贝沙罗汀低剂量组 图 1 TUNEL检测各组大鼠黑质部位α-SYN的表达(免疫组化×200) |
2.3 中脑黑质部位α-SYN的表达结果
黑质神经元细胞内有棕色团状小结的细胞为阳性细胞。与假手术组比较,模型组大鼠和贝沙罗汀高、中、低剂量组α-SYN表达显著增加(P < 0.01);与模型组比较,贝沙罗汀高、中、低剂量组α-SYN表达显著降低(P < 0.01);贝沙罗汀各组间α-SYN表达差异无统计学意义(P > 0.05,表 3,图 1)。
2.4 Western blot检测p-mTOR/mTOR、p-AKT/AKT和p-GSK-3β/GSK-3β蛋白的表达与假手术组比较,模型组和贝沙罗汀高、中、低剂量组mTOR、p-mTOR、AKT、p-AKT、GSK-3β、p-GSK-3β蛋白表达显著增加(P < 0.01);与模型组比较,贝沙罗汀高、中、低剂量组mTOR、p-mTOR、AKT、p-AKT、GSK-3β、p-GSK-3β蛋白表达显著增加(P < 0.01)。与假手术组比较,模型组和贝沙罗汀高、中、低剂量组p-mTOR/mTOR、p-AKT/AKT和p-GSK-3β/GSK-3β值显著增加(P < 0.01);与模型组比较,贝沙罗汀高、中、低剂量组p-mTOR/mTOR、p-AKT/AKT和p-GSK-3β/GSK-3β值显著增加(P < 0.01,表 4、5,图 2)。
| 组别 | mTOR | p-mTOR | AKT | p-AKT | GSK-3β | p-GSK-3β |
| 假手术组 | 0.000 2±0.000 1 | 0.000 2±0.000 2 | 0.000 3±0.000 1 | 0.000 3±0.000 1 | 0.000 4±0.000 2 | 0.000 4±0.000 3 |
| 模型组 | 0.198 2±0.075 8 a | 0.392 4±0.145 6 a | 0.253 2±0.066 8 a | 0.448 2±0.241 1 a | 0.255 0±0.078 7 a | 0.431 0±0.291 9 a |
| 贝沙罗汀高剂量组 | 0.420 5±0.201 0 ab | 2.613 6±0.455 9 ab | 0.578 3±0.314 0 ab | 2.359 4±0.382 0 ab | 0.628 6±0.228 4 ab | 2.457 8±0.447 0 ab |
| 贝沙罗汀中剂量组 | 0.398 4±0.267 7 ab | 2.302 8±0.401 8 ab | 0.439 0±0.2875 5 ab | 1.694 5±0.302 0 ab | 0.567 5±0.296 8 ab | 2.128 1±0.222 5 ab |
| 贝沙罗汀低剂量组 | 0.360 0±0.224 4 ab | 1.980 0±0.339 9 ab | 0.400 1±0.255 3 ab | 1.428 4±0.447 6 ab | 0.524 2±0.277 1 ab | 1.897 6±0.212 8 ab |
| a:P < 0.01,与假手术组比较;b:P < 0.01,与模型组比较 | ||||||
| 组别 | p-mTOR/mTOR | p-AKT/AKT | p-GSK-3β/GSK-3β |
| 假手术组 | 1.01±0.04 | 1.00±0.03 | 1.00±0.06 |
| 模型组 | 1.98±0.72a | 1.77±0.45a | 1.69±0.51a |
| 贝沙罗汀高剂量组 | 6.22±0.83ab | 4.08±0.89ab | 3.91±0.70ab |
| 贝沙罗汀中剂量组 | 5.78±0.75ab | 3.86±0.70ab | 3.75±0.68ab |
| 贝沙罗汀低剂量组 | 5.50±0.71ab | 3.57±0.64ab | 3.62±0.65ab |
| a: P < 0.01,与假手术组比较;b:P < 0.01,与模型组比较 | |||
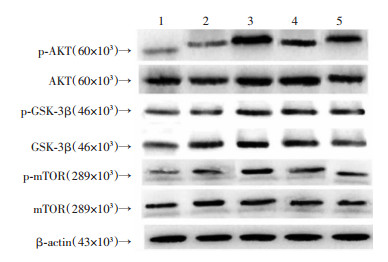
|
| 1:假手术组:2:模型组;3:贝沙罗汀高剂量组;4:贝沙罗汀中剂量组;5:贝沙罗汀低剂量组 图 2 Western blot检测各组大鼠黑质部位mTOR、p-mTOR、AKT、p-AKT、GSK-3β和p-GSK-3β蛋白的表达 |
3 讨论
帕金森是常见的神经退行性疾病,常发生于中老年人,其发病机制与氧化应激、免疫炎症、兴奋性神经毒性及遗传和环境相关[5]。帕金森的主要特征为黑质纹状体病变,6-羟多巴胺可选择性损毁黑质多巴胺神经元,使多巴胺神经元死亡,出现帕金森症状[6]。6-羟多巴胺制备帕金森模型是国内外公认的帕金森模型制备方法之一[7]。通过该方法造模,发现大鼠出现恒定向左旋转行为,左前肢使用率显著减少,说明帕金森大鼠模型制备成功。
帕金森主要病理改变为黑质多巴胺神经元的大量丢失[8],且神经元细胞质中出现了大量嗜酸性包涵体(路易体,LBs),LBs的主要成分为α-SYN[9]。α-SYN过表达也产生神经毒性,α-SYN寡聚体与突触囊泡结合后产生小孔,使得囊泡通透性增加,Ca2+内流,使得多巴胺神经元死亡[10]。因此,α-SYN的表达可以间接反映出多巴胺神经元的损伤情况。本实验发现,与假手术组相比,帕金森模型组大鼠黑质部位神经元凋亡严重,且α-SYN的表达增加(P < 0.01),而贝沙罗汀各剂量组能显著降低神经元的凋亡(P < 0.01),降低α-SYN的表达(P < 0.01),表明对神经元的损伤有一定的保护作用。
mTOR为一种保守的丝氨酸/苏氨酸蛋白激酶,属于磷脂酰肌醇激酶相关蛋白激酶,调节着细胞的存活和凋亡[11-12]。AKT也叫作蛋白激酶B,为一种丝氨酸/苏氨酸蛋白激酶,处于多条信号通路的交叉点,在调节细胞凋亡方面起着重要作用[13]。已有研究表明,AKT与多种神经系统疾病(如脑缺血和帕金森等)的发生和发展密切相关[14], 帕金森患者中黑质部位AKT蛋白磷酸化水平显著降低[15]。GSK-3β是AKT的下游蛋白,传递AKT的重要信息,参与了细胞生成增殖、凋亡等多种过程,在信号的传导中起着重要作用[16]。文献[17]报道帕金森小鼠模型的GSK-3β磷酸化水平显著降低,证明了GSK-3β与帕金森的发生有密切关系。另有研究发现,促进GSK-3β磷酸化可对6-羟多巴胺诱导的神经元凋亡发挥保护作用[18]。本实验发现,与模型组相比,贝沙罗汀各剂量组能显著上调p-mTOR/mTOR、p-AKT/AKT、p-GSK-3β/GSK-3β蛋白的表达,说明贝沙罗汀抗帕金森大鼠黑质神经元凋亡是通过促进mTOR、AKT和GSK-3β磷酸化,激活mTOR/AKT/GSK-3β通路而实现的。
贝沙罗汀在神经系统方面的运用已越来越得到重视,目前贝沙罗汀在抗老年痴呆方面已获得重大进展,而在治疗帕金森方面还需要更多的工作。本研究发现,贝沙罗汀可以显著改善帕金森大鼠神经行为学症状、减少神经元的凋亡、降低黑质α-SYN的表达,表明其对帕金森可能有一定的改善作用,其机制可能与激活AKT/GSK-3β/mTOR通路有关。
| [1] | LAZZARINI M, MARTIN S, MITKOVSKI M, et al. Doxycycline restrains glia and confers neuroprotection in a 6-OHDA Parkinson model[J]. Glia, 2013, 61(7): 1084–1100. DOI:10.1002/glia.22496 |
| [2] | MANOHAR S G, HUSAIN M. Reduced pupillary reward sensitivity in Parkinson's disease[J]. NPJ Parkinsons Dis, 2015, 1: 15026. DOI:10.1038/npjparkd.2015.26 |
| [3] | CRAMER P E, CIRRITO J R, WESSON D W, et al. ApoE-directed therapeutics rapidly clearβ-amyloidand reverse deficits in AD mouse models[J]. Science, 2012, 335(6075): 1503–1506. DOI:10.1126/science.1217697 |
| [4] | MCFARLAND K, SPALDING T A, HUBBARD D, et al. Low dose bexarotene treatment rescues dopamine neurons and restores behavioral function in models of Parkinson's disease[J]. ACS Chem Neurosci, 2013, 4(11): 1430–1438. DOI:10.1021/cn400100f |
| [5] | ALMEIDA L, AHMED B, WALZ R, et al. Symptoms are frequent in atypical parkinsonian disorders[J]. Mov Disord Clin Pract, 2017, 4(2): 191–197. DOI:10.1002/mdc3.12382 |
| [6] | MASTRANGELO L. The Genetics of Parkinson disease[J]. Adv Genet, 2017, 98: 43–62. DOI:10.1016/bs.adgen.2017.08.001 |
| [7] | THIELE S L, WARRE R, NASH J E. Development of a unilaterally-lesioned 6-OHDA mouse model of parkinson's disease[J]. J Vis Exp, 2012, 60(60): e3234–e3234. DOI:10.3791/3234 |
| [8] | ARIZA D, LOPES FNC, CRESTANI C C, et al. Chemoreflex and baroreflex alterations in Parkinsonism induced by 6-OHDA in unanesthetized rats[J]. Neurosci Lett, 2015, 607: 77–82. DOI:10.1016/j.neulet.2015.09.024 |
| [9] | MOLLENHAUER B, TRAUTMANN E, OTTE B, et al. α-Synuclein in human cerebrospinal fluid is principally derived from neurons of the central nervous system[J]. J Neural Transm(Vienna), 2012, 119(7): 739–746. DOI:10.1007/s00702-012-0784-0 |
| [10] | KALIA L V, KALIA S K. α-Synuclein and Lewy pathology in Parkinson's disease[J]. Curr Opin Neurol, 2015, 28(4): 375–381. DOI:10.1097/WCO.0000000000000215 |
| [11] | HERAS-SANDOVAL D, P REZ-ROJAS J M, HERN NDEZ-DAMI N J, et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J]. Cell Signal, 2014, 26(12): 2694–2701. DOI:10.1016/j.cellsig.2014.08.019 |
| [12] |
SADOWSKI K, KOTULSKA-JÓ |
| [13] | PRUSINER S B, WOERMAN A L, MORDES D A, et al. Evidence for α-synuclein prions causing multiple system atrophy in humans with parkinsonism[J]. Proc Natl Acad Sci USA, 2015, 112(38): E5308–E5317. DOI:10.1073/pnas.1514475112 |
| [14] | CHUNG J Y, LEE S J, LEE S H, et al. Direct interaction of α-synuclein and AKT regulates IGF-1 signaling: implication of Parkinson disease[J]. Neurosignals, 2011, 19(2): 86–96. DOI:10.1159/000325028 |
| [15] | HERAS-SANDOVAL D, P REZ-ROJAS J M, HERN NDEZ-DAMI N J, et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J]. Cell Signal, 2014, 26(12): 2694–2701. DOI:10.1016/j.cellsig.2014.08.019 |
| [16] | KHWANRAJ K, MADLAH S, GRATAITONG K, et al. Comparative mRNA expression of eEF1A isoforms and a PI3K/AKT/mTOR pathway in a cellular model of parkinson's disease[J]. Parkinsons Dis, 2016, 2016: 8716016. DOI:10.1155/2016/8716016 |
| [17] | MORALES-GARC A J A, SUS N C, ALONSO-GIL S, et al. Glycogen synthase kinase-3 inhibitors as potent therapeutic agents for the treatment of Parkinson disease[J]. ACS Chemical Neuroscience, 2013, 4(2): 350–360. DOI:10.1021/cn300182g |
| [18] | ARMENTERO M T, SINFORIANI E, GHEZZI C, et al. Peripheral expression of key regulatory kinases in Alzheimer's disease and Parkinson's disease[J]. Neurobiol Aging, 2011, 32(12): 2142–2151. DOI:10.1016/j.neurobiolaging.2010.01.004 |



