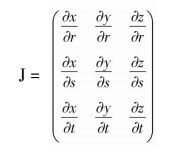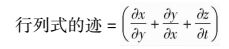轻度认知障碍(mild cognitive impairment,MCI)是一种处于正常状态和阿尔茨海默病(Alzheimer disease,AD)之间的大脑神经认知障碍状态,未来转化为AD的概率较高,年转化率为10%~15%[1]。MCI主要分为稳定型的MCI(stable MCI,SMCI)和进展型的MCI(progressive MCI,PMCI)两种亚型,其中PMCI具有较高的转化为AD的可能性,而SMCI相对较为稳定,患者可能会一直保持MCI状态而不会进展到AD状态。对于MCI的研究可用于AD早期的诊断和干预,有助于了解AD患者前期的发病机制和大脑神经退行模式,从而有利于区分SMCI和PMCI,为早期诊断可能进展为AD的患者提供一些临床辅助。利用MRI结构像研究AD患者的大脑结构变化,可以进一步确定疾病状态下大脑灰质的萎缩情况,有助于通过影像学技术探究AD患者大脑结构特征的影像学标志,为该疾病的临床诊断和临床评估提供影像学支持。
基于张量的形态学测量(tensor-based morphology,TBM)方法可以用于大脑灰质的局部结构改变的检测,其主要理论基础是配准过程中产生的雅克比矩阵包含着大脑结构的局部改变信息,因此对该信息进行新的特征参数提取,比较组间差异,可以用于大脑灰质萎缩规律及特征的研究[2-4]。本研究采用TBM方法可有效地用于大脑灰质萎缩特征的研究,同时根据该方法得到的大脑灰质萎缩差异可用于区分SMCI、PMCI以及正常人大脑结构,从而有助于临床对AD的早期诊断和相关的临床干预。
1 材料与方法 1.1 MRI数据获取我们获取的受试者大脑MRI T1加权数据来自于AD的神经影像(Alzheimer's disease neuroimaging Initiative,ADNI,网址:www.ADNI-info.org)数据库。本研究所获取的数据包括基于3D MRI的T1加权数据,数据采集均采用MP-RAGE协议,同时获取受试者临床痴呆量表(clinical dementia rating,CDR)和简短精神记忆量表(minim mental state examination,MMSE)等临床评估信息(网址:www.ADNI-info.org)。其中,CDR用来评估痴呆的严重程度,只有认知功能缺损时评分才>0;CDR为0.5、1.0、2.0、3.0分别代表可疑、轻度、中度和重度痴呆。MMSE总分为30,文盲、小学、中学文化程度的人群,分别当MMSE≤17、≤20、≤24时认定为认知功能缺损。ADNI数据库中受试者的入组标准:正常人的CDR评分在0~0.5,MMSE评分≥24;MCI患者的CDR评分在0.5~1,MMSE评分≥24;AD患者的CDR评分在1~3之间,MMSE评分<24。根据SMCI与PMCI两种亚型的基本定义,利用CDR结合MMSE评分将MCI患者归入SMCI和PMCI2个亚组。分类标准为首次扫描5年后转化为AD(CDR≥1,MMSE<24)的MCI患者判定为PMCI,反之判定为SMCI。整理后的获取数据见表 1。
| 组别 | n | 年龄(岁,x±s) | 男/女(例) | 首次扫描时间点(月) | 首次扫描 CDR(分) | 首次扫描MMSE (分,x±s) |
| 正常对照组 | 34 | 75±4(70~85) | 19/15 | 6,12,24,36,48,60 | 0 | 29±1 |
| SMCI组 | 22 | 74±7(58~83) | 18/4 | 6,12,18,24,36,48,60 | 0.5 | 28±2 |
| PMCI组 | 20 | 73±9(55~85) | 11/9 | 6,12,18,24,36,48,60 | 0.5 | 27±2 |
1.2 数据预处理
利用SPM8软件对正常对照组、SMCI和PMCI的纵向数据进行了预处理(图 1),首先对每例受试者MRI数据刚体配准到该受试者的平均图像,利用New segment进行所有受试者的MRI图像灰质分割,对于分割后得到的灰质部分,我们首先利用DARTEL配准方法实现每一个受试者的灰质图像个性化灰质模板的创建,再利用所有的个性化模板创建具有群组特异性的灰质模板,最后把该组内的所有灰质数据配准到群组特异性模板,同时得到配准过程中生成的每个图像数据对应的形变场信息。

|
| 图 1 基于TBM方法的大脑MRI结构像的主要分析处理流程 |
1.3 TBM特征参数计算
利用得到的形变场信息,我们可以得到表征局部形变信息的雅克比矩阵。对于原始图像其坐标点表示为Ⅰ(x,y,z),配准后图像对应坐标点表示为Ⅰ(r,s,t),那么对应点的雅克比矩阵计算公式如下:
雅克比矩阵包含了图像在配准前后的局部形态改变的信息,对于雅克比矩阵我们可以求取新的特征参数:行列式的值和迹。行列式的值的计算公式如下:
行列式的值=Det(J)
行列式的迹的计算公式如下:
1.4 统计学分析对于正常对照组、SMCI和PMCI纵向跟踪数据分析,我们采用组内方差分析确定组内差异(P<0.001,未校正),然后采用多重比较配对t检验(P<0.001,未校正)检测相对首次扫描数据,不同跟踪时间点的大脑灰质结构改变的特征,进而得到组内随时间变化的大脑灰质萎缩的规律及组间的差异。
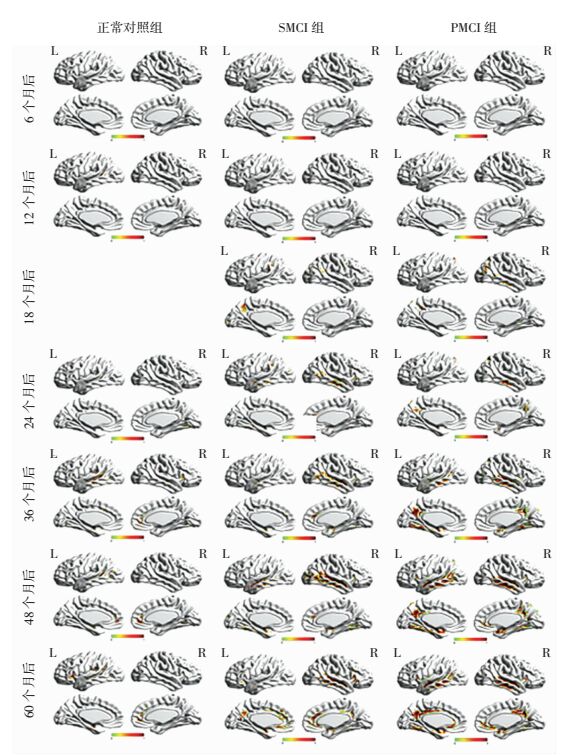
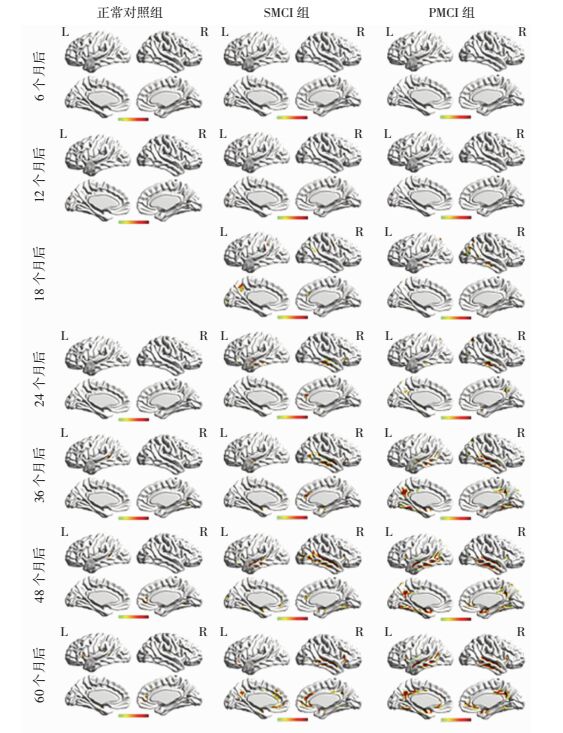
2 结果 2.1 大脑灰质萎缩的皮层映射图采用的新特征参数(行列式的值和行列式的迹)可以有效地用于轻度认知障碍患者大脑灰质结构改变的研究。对正常对照组、MCI、AD的纵向跟踪数据分析,结果见图 2、3。随着时间的推移,大脑灰质萎缩区域逐步扩大,萎缩程度逐步增加。从图 2、3中我们可以发现正常对照组的萎缩情况:利用行列式的值和行列式的迹作为特征参数得到的大脑皮层映射图在6个月和1年后均未发现明显萎缩,此后的12、18、60个月后均发现大脑灰质萎缩,并且随着时间的推移,大脑萎缩的区域逐步扩大,萎缩程度逐步增加。
|
| 颜色条表示归一化后统计分析得t值;每组各时间段上下两幅图代表左(L)右(R)半球内外侧 图 2 采用行列式的值作为特征参数得到的不同时间3组被试大脑灰质萎缩的皮层映射图 |
|
| 颜色条表示归一化后统计分析得t值;每组各时间段上下两幅图代表左(L)右(R)半球内外侧 图 3 采用行列式的迹作为特征参数得到的不同时间3组被试大脑灰质萎缩的皮层映射图 |
2.1.1 SMCI的萎缩情况
利用行列式的值和行列式的迹作为特征参数得到的大脑皮层映射图在6、12个月后均未发现明显萎缩,但是随着时间的推移,18个月及以后大脑区域出现萎缩,相对于PMCI, 脑萎缩区域及萎缩程度较小。
2.1.2 PMCI的萎缩情况利用行列式的值和行列式的迹作为特征参数得到的大脑皮层映射图在6、12个月后均未发现明显萎缩,但是随着时间的推移,18个月及以后大脑区域有明显萎缩,相对于SMCI,大脑萎缩区域逐步扩大,萎缩程度逐步增加,没有稳定的迹象。
2.2 SMCI、PMCI萎缩区域的特征定性结果为了定性比较SMCI、PMCI萎缩区域的特征,我们分别提取正常对照、SMCI、PMCI组纵向数据中6、36、60个月的萎缩区域,进而比较两种特征参数计算分析得到的主要萎缩区域差异以及3组之间的横向和纵向比较差异,结果见表 2。
| 组别 | 值 | 迹 | ||||
| 6个月 | 36个月 | 60个月 | 6个月 | 36个月 | 60个月 | |
| 正常对照组 | 无 | 颞中回、颞上回、额下回、额内侧回、顶下小叶、扣带回、舌回 | 颞中回、额下回、额中回、额下回、额内侧回、顶下小叶、扣带回、海马旁回、脑岛 | 无 | 颞上回、颞中回 | 颞中回、额下回、额内侧回、顶下小叶、扣带回、脑岛 |
| PMCI组 | 无 | 颞上回、颞中回、颞下回、额中回、额下回、额内侧回、海马旁回、梭状回 | 颞上回、颞中回、额中回、额下回、额内侧回、扣带回、海马旁回、楔前叶、梭状回、脑岛、豆状核、壳核 | 无 | 颞上回、颞中回、颞下回、额下回、额内侧回、扣带回、海马旁回、楔前叶、梭状回 | 颞上回、颞下回;额上回、额中回、额下回、额内侧回、扣带回、海马旁回、楔前叶、梭状回、脑岛、豆状核、壳核、屏状核 |
| SMCI组 | 无 | 颞中回、颞下回;枕中回、扣带回、海马旁回、楔前叶、梭状回、脑岛、豆状核、壳核、屏状核、舌回、杏仁核 | 颞上回、颞中回、颞下回、额内侧回、扣带回、海马旁回、楔前叶、梭状回、脑岛、豆状核、壳核、屏状核、舌回、杏仁核 | 无 | 颞上回、颞中回、颞下回、枕中回、扣带回、海马旁回、楔前叶、核梭状回、脑岛、豆状核、壳核、屏状核、舌回、杏仁核 | 颞上回、颞中回、颞下回、额内侧回、扣带回、海马旁回;楔前叶、梭状回、脑岛、豆状核、壳核、屏状核、杏仁核 |
3 讨论
TBM应用于基于MRI成像的MCI患者脑萎缩特征的研究比较少。此类研究结果与MRI数据的预处理以及采用的统计学方法直接相关。已有的研究结合不同形态学测量方法进行对AD患者大脑结构改变的相关研究,从不同方面提取大脑结构改变的形态学参数,从而实现对AD患者大脑萎缩规律的探索[5-6]。
LIU等[7]提出了一个基于张量的方法在确认空间与时间光谱中,直接由小波变换方法构造的多维脑电图来检测运动想象脑电模式,保留了多通道的时变脑电的结构性信息,结果显示在线和离线的识别性能都优于现有的5项传统方法。WANG等[8]提出将体素的形态学测量(voxel-based Morphology,VBM)运用到参数曲面模型中去进行诊断分类,以此识别用于诊断分类的皮质表面特征。文献[9-10]指出多数AD和MCI患者的脑萎缩发生在18个月之内,导致估计的变化速率的整体升高;YOON等[10]对10例AD患者和15例健康受试者的弥散张量成像数据进行统计参数映射来评估微观白质的变化模式,同时基于VBM方法对AD和健康对照组之间的大脑灰质和白质体积变化进行比较。RAJAGOPALAN等[11]描述了一个新的TBM描述子用于与标量TBM相结合来分析局部模式在大脑发育过程中变化的方向性,并提出了一个新的方法来映射变形张量的方向不对称性与大脑发育过程中出现的结构不对称性,结果表明胎儿的大脑发育具有各向异性生长的一个独特的空间格局。LIPOWEZAN等[12]介绍了植物生长的基于张量应用于拟南芥叶的二维计算机模型,这个模型采用张量增长方法与非平稳速度场。HUA等[13]分析了来自AD影像学倡议的第一阶段(ADNI-1)的全MRI数据,并且对追踪结构性脑成像方法大脑变化时可能出现的偏差进行评估,可作为TBM的一种传递途径。
本研究主要采用TBM方法对ADNI数据库中的正常组、SMCI组、PMCI组5年跟踪MRI数据进行分析。在预处理的过程中,利用分段算法进行所有受试者的MRI图像灰质分割,对于分割后得到的灰质部分,我们首先利用DARTEL配准方法实现每例受试者的灰质图像个性化灰质模板的创建,再利用所有的个性化模板创建具有群组特异性的灰质模板,最后把该组内的所有灰质数据配准到群组特异性模板,同时得到配准过程中生成的每个图像数据对应的形变场数据。利用得到的形变场信息,我们可以得到表征局部形变信息的雅克比矩阵,把求取的特征参数进行统计学分析,得到了不同跟踪时间点的大脑灰质结构改变的特征,进而得到组内随时间变化的大脑灰质萎缩的规律及组间的差异。
目前,利用TBM对AD患者大脑结构改变的研究发现,AD患者的皮层萎缩主要出现在双侧海马、扣带回、颞叶,尾状核等区域[14-15]。与SMCI患者大脑皮层的结构改变对比发现,PMCI患者的海马区域大脑的年萎缩率可达到4.5%,而SMCI患者海马区域的年萎缩率不足2.0%[16]。另外,研究表明MCI患者转化为AD患者的过程中存在较为显著的基底前脑萎缩,而相对于SMCI患者,PMCI患者基底前脑萎缩更为明显[17-18]。
本研究得到SMCI患者相对于正常对照组萎缩区域包括颞中回、额下回、额中回、额下回、额内侧回、顶下小叶、扣带回、海马旁回、脑岛。PMCI患者相对于正常对照组萎缩区域包括颞上回、颞中回、颞下回、额内侧回、扣带回、海马旁回、楔前叶、梭状回、脑岛、豆状核、壳核、屏状核、舌回、杏仁核。PMCI患者相对于SMCI患者对比分析中发现颞上回、颞中回、颞下回、枕中回、扣带回、海马旁回、楔前叶、核梭状回、脑岛、豆状核、壳核、屏状核、舌回、杏仁核这些区域是较早出现萎缩的区域,18个月以后,这些区域的萎缩程度逐渐增加。对于同一时间点的PMCI和SMCI,PMCI的萎缩程度更为严重,尤其是在在颞叶、额内侧回、扣带回、海马旁回、楔前叶、梭状回、脑岛等区域。
本研究提取了雅克比矩阵的2个特征参数,用于大脑灰质萎缩的规律和特征的探索。但是基于TBM新特征参数的提取仍需要进一步研究,并且需要与基于体素和大脑皮层的形态学测量方法进行全面比较分析。本研究提供的新定量参数有助于对MCI患者大脑结构改变影像学标志的探索以及AD的早期诊断和临床治疗。
| [1] | WEINER M W, VEITCH D P, AISEN P S, et al. The alzheimer's disease neuroimaging initiative: a review of paperspublished since its inception[J]. Alzheimer Dement, 2012, 8(1): S1–S68. DOI:10.1016/j.jalz.2011.09.172 |
| [2] | SINCHAI T, NIHARIKA G, JIAYU Z, et al. Multi-template tensor-based morphometry: Application to analysis of Alzheimer's disease[J]. Neuroimage, 2011, 56(3): 1134–1144. DOI:10.1016/j.neuroimage.2011.03.029 |
| [3] | SHEN K, FRIPP J, MÉRIAUDEAU F, et al. Detecting global and local hippocampal shape changes in alzheimer's disease using statistical shape models[J]. NeuroImage, 2012, 59(3): 2155–2166. DOI:10.1016/j.neuroimage.2011.10.014 |
| [4] | TESSA C, LUCETTI C, GIANNELLI M, et al. Progressionof brain atrophy in the early stages of Parkinson's disease: alongitudinal tensor-based morphometry study in de novo patients without cognitive impairment[J]. Hum Brain Mapp, 2014, 35(8): 3932–3944. DOI:10.1002/hbm.22449 |
| [5] | SINCHAI T, NIHARIKA G, ZHOU J Y, et al. Feature selective temporal prediction of Alzheimer's disease progression using hippocampus surface morphometry[J]. Brain Behav, 2017, 7: 27–33. DOI:10.1002/brb3.733 |
| [6] | WEILER M, AGOSTA F, CANU E, et al. Following the spreading of brain structural changes in alzheimer's disease: alongitudinal, multimodal MRI study[J]. J Alzheimers Dis, 2015, 47(4): 995–1007. DOI:10.3233/JAD-150196 |
| [7] | LIU Y, LI M, ZHANG H, et al. A tensor-based scheme for stroke patients' motor imagery EEG analysis in BCI-FES rehabilitation training[J]. J Neurosci Methods, 2014, 222: 238–249. DOI:10.1016/j.jneumeth.2013.11.009 |
| [8] | WANG Y, YUAN L, SHI J, et al. Applying tensor-based morphometry to parametric surfaces can improve MRI-based disease diagnosis[J]. Neuro Image, 2013, 74: 209–230. DOI:10.1016/j.neuroimage.2013.02.011 |
| [9] | THOMPSON W K, HOLLAND D. Bias in tensor based morphometry Stat-ROI measures may result in unrealistic power estimates[J]. Neuroimage, 2011, 57(1): 1–4. DOI:10.1016/j.neuroimage.2010.11.092 |
| [10] | YOON B, SHIM Y S, HONG Y J, et al. Comparison of diffusion tensor imaging and voxel-based morphometry to detect white matter damage in Alzheimer's disease[J]. J Neurol Sci, 2011, 302(1): 89–95. DOI:10.1016/j.jns.2010.11.012 |
| [11] | RAJAGOPALAN V, SCOTT J, HABAS P A, et al. Mapping directionality specific volume changes using tensor based morphometry: An application to the study of gyrogenesis and lateralization of the human fetal brain[J]. NeuroImage, 2012, 63(2): 947–958. DOI:10.1016/j.neuroimage.2012.03.092 |
| [12] | LIPOWCZAN M, PIEKARSKA A, ELSNER J, et al. The tensor-based model of plant growth applied to leaves of arabidopsis thaliana: a two-dimensional computer model[J]. C R Biol, 2013, 336(9): 425–432. DOI:10.1016/j.crvi.2013.09.001 |
| [13] | HUA X, GUTMAN B, BOYLE B P, et al. Accurate measurement of brain changes in longitudinal MRI scans using tensor-based morphometry[J]. NeuroImage, 2011, 57(1): 5–14. DOI:10.1016/j.neuroimage.2011.01.079 |
| [14] | YANG J, PAN P, SONG W, et al. Voxelwise meta-analysis of gray matter anomalies in alzheimer's disease and mild cognitive impairment using anatomic likelihood estimation[J]. J Neurol Sci, 2012, 316(1/2): 21–29. DOI:10.1016/j.jns.2012.02.010 |
| [15] | MISRA C, FAN Y, DAVATZIKOS C. Baseline and longitudinal patterns of brain atrophy in MCI patients, and theiruse in prediction of short-term conversion to AD: results from ADNI[J]. NeuroImage, 2009, 44(4): 1415–1422. DOI:10.1016/j.neuroimage.2008.10.031 |
| [16] | RISACHER S L, SHEN L, WEST J D, et al. Longitudinal MRI atrophy biomarkers: relationship to conversion in the ADNI cohort[J]. Neurobiol Aging, 2010, 31(8): 1401–1418. DOI:10.1016/j.neurobiolaging.2010.04.029 |
| [17] | GROTHE M, HEINSEN H, TEIPEL S. Longitudinal measures of cholinergic forebrain atrophy in the transition fromhealthy aging to Alzheimer's disease[J]. Neurobiol Aging, 2013, 34(4): 1210–1220. DOI:10.1016/j.neurobiolaging.2012.10.018 |
| [18] | TONDELLI M, WILCOCK G K, NICHEL P, et al. Structural MRI changes detectable up to ten years before clinicalAlzheimer's disease[J]. Neurobiol Aging, 2012, 33(4): 825–825. DOI:10.1016/j.neurobiolaging.2011.05.018 |