2. 421002 湖南 衡阳,南华大学附属南华医院消化内科
2. Department of Gastroenterology, Affiliated Hospital of University of South China, Hengyang, Hunan Province, 421002, China
慢性乙型病毒性肝炎(chronic hepatitis B,CHB)能够通过血液、母婴、体液、性接触等途径传播[1]。全世界感染过乙型肝炎病毒(hepatitis B virus,HBV)者约20亿,其中3.5亿罹患CHB[2]。我国为HBV感染的中等流行地区,病毒携带者占全球的1/3左右,约有2 000万CHB患者,年发病率达80.63/10万[3],并且未出现下降趋势。这已经成为严重的公共卫生问题。CHB的治疗以抗病毒为主,目前临床上常用的抗病毒药物为核苷、核苷酸类似物、干扰素等,能够有效抑制病毒复制,改善病情,但研究发现,核苷酸类似物的耐药率较高[4],干扰素有较大毒副作用,均对治疗产生不良影响。因此,研发作用靶点多、安全性高的药物成为研究热点。氧化苦参碱为苦参中提取的生物碱,已有体外研究显示,其能有效抑制HepG 2.2.15细胞中HBV-DNA表达量[5]。故本研究进一步探讨氧化苦参碱对HBV转基因小鼠的抗病毒作用及其可能的机制。
1 材料与方法 1.1 材料 1.1.1 研究对象6~8周龄SPF级HBV转基因BALB/c雄性小鼠36只,体质量20~30 g(23.75±2.85)g;6~8周龄SPF级非转基因BALB/c雄性小鼠12只,体质量20~30 (23.27±3.01)g,购自浙江大学实验动物中心,动物许可证号:SYXK(浙)2010-0178。将小鼠适应性饲养,饲养环境安静、通风,温度22~26 ℃,湿度60%~70%,昼夜节律为12 h,小鼠自由饮水与进食。
1.1.2 主要药品与试剂苦参素片,规格:0.1 g/片(国药准字H20090019,山东新华制药股份有限公司);拉米夫定片,规格:0.1 g/片[国药准字H20030581,葛兰素史克制药(苏州)有限公司];0.9%氯化钠注射液,规格:250 mL/瓶(国药准字H33021576,杭州民生药业有限公司);5%水合氯醛溶液,规格:100 mL(货号:R00634,上海经科化学科技有限公司);10%中性甲醛固定液(上海钰博生物科技有限公司);苏木精-伊红(HE)染色试剂盒(沈阳万类生物科技有限公司);小鼠乙肝表面抗原(HBsAg)、干扰素-γ(IFN-γ)、白细胞介素-2(IL-2)、白细胞介素-4(IL-4)ELISA试剂盒购自美国Novus Biologicals公司;乙型肝炎病毒HBV-DNA荧光定量PCR检测试剂盒、Real-time PCR反应液购自安徽达健医学科技有限公司;小鼠CD3+FITC、CD4+PE、CD8+PE抗体购自美国BioLegend公司;1× LYSING SOLUTION购自德国Merck Millipore公司。
1.1.3 主要仪器设备ROTOFIX 32A离心机(德国Hettich公司);M3500石蜡切片机(英国Bright公司);DM3000光学显微镜(德国Leica公司);Freedom EVOlyzer®全自动酶免分析仪(瑞士Tecan公司);Step One PlusTM实时荧光定量PCR系统(美国ABI公司);STOMACHER 400匀浆器(英国SEWARD公司);DxFLEX流式细胞仪(美国Beckman Coulter公司)。
1.2 方法 1.2.1 实验分组将HBV转基因小鼠按照随机数字表法分为模型组、氧化苦参碱组及拉米夫定组各12只,以12只非转基因BALB/c小鼠作为对照组。氧化苦参碱组给予苦参素片0.1 mg/g,溶于0.2 mL生理盐水中,1次/d,灌胃给药;拉米夫定组给予拉米夫定片0.02 mg/g,溶于0.2 mL 0.9%氯化钠注射液中,1次/d,灌胃给药;模型组、对照组分别给予0.9%氯化钠注射液0.2 mL/次,1次/d,灌胃给药。各组小鼠均连续给药30 d。
1.2.2 标本采集与处理最后1次给药后,禁食12 h,采用5%水合氯醛2 μL/g腹腔注射将小鼠麻醉,2~3 min后,打开腹腔,自下腔静脉取血1 mL,其中0.5 mL置于抗凝管中,用于流式细胞术检测;剩余0.5 mL置于EP管内,静置后采用离心机以6 000 r/min离心10 min,获得血清,置于-20 ℃冰箱内保存;取血后,开胸暴露心脏,经左心室行主动脉插管,插管固定后剪开右心耳,采用150 mL生理盐水迅速冲洗血管,之后采用250 mL 10%中性甲醛固定液进行灌注,灌注时间控制在50 min内,速度由快到慢,待肝脏变白即为灌注完成;完整剥取小鼠肝脏,冲洗后,取部分肝脏组织,置于10%中性甲醛固定液内固定,常规脱水、石蜡包埋,采用石蜡切片机制备厚度约为3 μm的肝脏组织石蜡切片;剩余肝脏组织分块后经液氮冷冻,置于-70 ℃冰箱保存,用于RT-PCR检测。
1.2.3 肝脏组织病理观察取肝脏组织石蜡切片,常规采用二甲苯脱蜡,30 min后,梯度浓度酒精(浓度100%-95%-80%-70%-50%)复水,按照染色试剂盒的说明书进行HE染色,之后依次采用梯度浓度酒精(浓度70%-80%-95%-100%-50%)脱水,经二甲苯透明、中性树胶封片后,显微镜下观察肝脏组织病理表现。
1.2.4 血清HBsAg、细胞因子水平及肝脏组织HBsAg水平测定取部分保存的小鼠血清和肝脏组织,经灌注后,肝脏组织经匀浆器匀浆后,离心取上清液,按照HBsAg ELISA试剂盒说明书提供的步骤,采用全自动酶免分析仪,测定血清及肝组织HBsAg水平(以样本吸光度与临界值的比值S/COV表示);按照IFN-γ、IL-2、IL-4 ELISA试剂盒说明书步骤,采用全自动酶免分析仪,测定血清IFN-γ、IL-2、IL-4水平。
1.2.5 实时荧光定量PCR法检测小鼠血清及肝脏组织HBV-DNA水平[6]取部分保存的小鼠血清和肝脏组织,肝脏组织经匀浆器匀浆后,离心取上清液,按照HBV-DNA荧光定量PCR检测试剂盒说明书操作提取DNA,取2 μL样品置于反应管内,滴加PCR反应液28 μL,采用实时荧光定量PCR系统对DNA进行扩增,同时设立阴性对照组,获得标准曲线,计算小鼠血清及肝组织HBV-DNA拷贝数。
1.2.6 流式细胞术检测血液T淋巴细胞亚群水平取经抗凝处理的小鼠血液300 μL,100 μL/支置于试管内,分别加入小鼠CD3+FITC、CD4+PE、CD8+PE抗体3 μL,避光反应20 min,滴加1× LYSING SOLUTION 2 mL,避光反应5 min,洗涤后制备细胞悬液,采用流式细胞仪,测定血液中CD3+、CD4+、CD8+T淋巴细胞及CD4+/CD8+水平。
1.3 统计学分析采用SPSS 17.0统计软件分析,符合正态分布的计量资料以x±s表示,采用单因素方差分析以及独立样本t检验,P<0.05为差异有统计学意义。
2 结果 2.1 各组小鼠肝脏组织病理表现观察肝脏组织病理表现为,对照组可见肝细胞结构正常,无肿胀和脂肪变性,排列整齐(图 1A);模型组肝细胞轻度脂肪变性、水肿,脉管区可见炎症细胞浸润,部分视野中存在Kupffer细胞增生(图 1B)。氧化苦参碱组及拉米夫定组部分切片中脉管区存在轻微炎症细胞浸润,肝细胞中脂肪变性、水肿,未见Kupffer细胞增生(图 1C、D)。
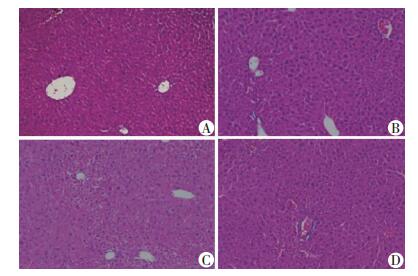
|
| A:对照组;B:模型组;C:氧化苦参碱组;D:拉米夫定组 图 1 各组小鼠肝脏组织病理表现 (HE ×400) |
2.2 各组小鼠治疗前后血清及肝组织HBsAg、HBV-DNA水平比较
与治疗前比较,氧化苦参碱组、拉米夫定组小鼠血清及肝组织HBsAg、HBV-DNA水平较低,差异有统计学意义(P<0.05)。治疗后,与模型组比较,氧化苦参碱组、拉米夫定组小鼠血清及肝组织HBsAg、HBV-DNA水平较低,差异有统计学意义(P<0.05),而氧化苦参碱组与拉米夫定组小鼠血清及肝组织HBsAg、HBV-DNA水平差异无统计学意义(P>0.05,表 1、2)。
| 组别 | 血清 | 肝组织 | |||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| 对照组 | 0 | 0 | 0 | 0 | |
| 模型组 | 20.37±2.42 | 20.64±2.53 | 22.07±3.07 | 22.58±3.05 | |
| 氧化苦参碱组 | 20.53±2.39 | 10.57±1.23ab | 22.24±3.11 | 14.84±2.12ab | |
| 拉米夫定组 | 20.61±2.48 | 9.78±1.14ab | 22.31±3.09 | 13.51±1.53ab | |
| a:P<0.05,与治疗前比较;b: P<0.05, 与模型组比较 | |||||
| 组别 | 血清 | 肝组织 | |||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| 对照组 | 0 | 0 | 0 | 0 | |
| 模型组 | 4.28±0.04 | 4.30±0.05 | 4.73±0.06 | 4.76±0.05 | |
| 氧化苦参碱组 | 4.29±0.05 | 4.17±0.06ab | 4.75±0.04 | 4.63±0.05ab | |
| 拉米夫定组 | 4.31±0.05 | 4.13±0.04ab | 4.74±0.05 | 4.60±0.04ab | |
| a:P<0.05,与治疗前比较;b: P<0.05, 与模型组比较 | |||||
2.3 各组小鼠血液CD3+、CD4+、CD8+T淋巴细胞及CD4+/CD8+水平比较
与对照组比较,模型组及拉米夫定组小鼠血液CD3+、CD4+T淋巴细胞、CD4+/CD8+水平降低,CD8+T淋巴细胞水平升高,差异有统计学意义(P<0.05)。与模型组比较,氧化苦参碱组及拉米夫定组小鼠血液CD3+、CD4+T淋巴细胞、CD4+/CD8+水平较高,且氧化苦参碱组>拉米夫定组;CD8+T淋巴细胞水平较低,且氧化苦参碱组<拉米夫定组,差异有统计学意义(P<0.05,表 3)。
| 组别 | CD3+(%) | CD4+(%) | CD8+(%) | CD4+/CD8+ |
| 对照组 | 21.08±2.46 | 14.18±2.01 | 7.84±1.07 | 1.81±0.25 |
| 模型组 | 13.28±1.53ac | 5.96±0.74ac | 12.28±1.63ac | 0.49±0.07ac |
| 氧化苦参碱组 | 20.84±2.38b | 13.28±1.34b | 8.03±1.02b | 1.65±0.23b |
| 拉米夫定组 | 17.12±2.16abc | 9.26±1.21abc | 10.47±1.23abc | 0.88±0.12abc |
| a:P<0.05,与对照组比较;b:P<0.05,与模型组比较; c: P<0.05, 与氧化苦参碱组比较 | ||||
2.4 各组小鼠血清IFN-γ、IL-2、IL-4水平比较
与对照组比较,模型组小鼠血清IFN-γ、IL-2水平较低,IL-4水平较高,差异有统计学意义(P<0.05)。与模型组比较,氧化苦参碱组及拉米夫定组小鼠血清IFN-γ、IL-2水平较高,且氧化苦参碱组>拉米夫定组;IL-4水平较低,且氧化苦参碱组<拉米夫定组,差异有统计学意义(P<0.05,表 4)。
| 组别 | IFN-γ(pg/mL) | IL-2(pg/mL) | IL-4(pg/mL) |
| 对照组 | 50.38±7.04 | 81.23±11.48 | 8.47±1.17 |
| 模型组 | 21.18±2.88ac | 39.68±5.32ac | 42.37±5.63ac |
| 氧化苦参碱组 | 126.37±14.38ab | 115.73±14.32ab | 12.28±1.65ab |
| 拉米夫定组 | 63.43±12.14abc | 90.47±1.21abc | 20.04±2.43abc |
| a:P<0.05,与对照组比较;b:P<0.05,与模型组比较; c: P<0.05, 与氧化苦参碱组比较 | |||
3 讨论
近年来,随着HBV疫苗接种的广泛,乙型病毒性肝炎的传播在一定程度上受到控制[7]。我国已经从HBV感染的高流行区变为中等流行区,但由于人口基数庞大,HBV感染率仍然较高。HBV感染人体后并不会直接损伤肝细胞,而是在机体内持续复制、感染,激活机体免疫应答,导致免疫损伤,病毒持续感染可诱发乙型病毒性肝炎慢性化[8]。因此,及时清除HBV病毒,改善患者细胞特异性免疫功能在CHB的治疗中有十分重要的作用。拉米夫定、恩替卡韦、阿福韦酯、干扰素等是抗HBV感染的一线药物,但是由于在临床上的应用越来越多,容易产生耐药性,影响治疗效果。中药以其作用靶点多、安全性高、疗效好的优点成为研发新型抗病毒药物的主要来源。氧化苦参碱为中药苦参的提取物,属于喹诺里西啶类生物碱的一种,具有抗炎、抗过敏、抗病毒、抗氧化、抗恶性肿瘤、神经保护、抗肝脏脂肪化和纤维化、抗急性心肌缺血损伤等多种作用,可用于多种疾病的治疗[9-10]。本研究采用HBV转基因小鼠作为研究对象,该类小鼠可表达HBsAg和HBV-DNA,常作为验证抗HBV药物效果的动物模型。本研究结果显示,与模型组比较,氧化苦参碱组、拉米夫定组小鼠血清及肝组织HBsAg、HBV-DNA水平较低(P<0.05),而氧化苦参碱组与拉米夫定组小鼠血清及肝组织HBsAg、HBV-DNA水平差异无统计学意义(P>0.05)。HBsAg为乙肝病毒的外壳蛋白,是感染HBV的标志,HBV-DNA包含病毒的所有遗传信息,其水平与病毒的活跃程度有关[11]。本结果表明氧化苦参碱能够抑制小鼠HBsAg、HBV-DNA水平,抗病毒作用强度与拉米夫定类似。
CHB的慢性化过程与机体免疫系统对HBV的免疫耐受有关。成熟的T淋巴细胞是发挥特异性免疫应答的细胞,主要包括CD3+、CD4+及CD8+T淋巴细胞,CD3+在所有成熟T淋巴细胞表面都有表达,可以反映T淋巴细胞总水平;CD4+为辅助性T细胞(Th细胞),能够释放多种细胞因子,促进病原体的清除,在抗HBV免疫应答中起到关键作用;CD8+则为细胞毒性T淋巴细胞(CTL),能够直接识别被感染的肝细胞,引起肝细胞破坏和凋亡以清除HBV病毒,引发炎症反应[12-13]。在CHB发生过程中,成熟T淋巴细胞及CD4+/CD8+处于较低水平。本研究结果显示,与模型组比较,氧化苦参碱组及拉米夫定组小鼠血液CD3+、CD4+T淋巴细胞、CD4+/CD8+水平较高,且氧化苦参碱组>拉米夫定组;CD8+T淋巴细胞水平较低,且氧化苦参碱组<拉米夫定组(P<0.05),表明氧化苦参碱能够增加成熟T细胞数目,调节T淋巴细胞亚群比例,改善免疫系统对HBV病毒的免疫耐受,有助于机体清除HBV。
除了成熟T淋巴细胞整体水平下调,CHB发生、发展还与HBV感染诱导的Th1、Th2细胞因子平衡失调有关[14]。IFN-γ、IL-2是常见的Th1型细胞因子,IFN-γ具有免疫调节作用,能够上调病毒抗原呈现,降低能感染细胞的HBV数量,促进B淋巴细胞成熟,还能抑制HBV-DNA复制和表达;IL-2能促进T淋巴细胞增殖,增强NK细胞活性,促进HBV清除。IL-4属于Th2细胞释放的细胞因子,虽然能够控制HBV急性感染,但其水平过高能抑制T淋巴细胞成熟,使机体的细胞免疫功能下降,对病毒的清除力减弱,形成持续感染[15]。本研究结果显示,与模型组比较,氧化苦参碱组及拉米夫定组小鼠血清IFN-γ、IL-2水平较高,且氧化苦参碱组>拉米夫定组;IL-4水平较低,且氧化苦参碱组<拉米夫定组(P<0.05),表明氧化苦参碱能够促进IFN-γ、IL-2等Th1型细胞因子释放,抑制IL-4等Th2型细胞因子释放,调节Th1/Th2平衡,改善机体特异性免疫功能,提高抗病毒能力。
综上所述,氧化苦参碱能有效抑制HBV转基因小鼠血清及肝组织HBsAg、HBV-DNA水平,该作用可能与调节T淋巴细胞亚群水平及Th1/Th2细胞因子水平,改善免疫功能有关。
| [1] | BACKES S, JÄGER C, DEMBEK C J, et al. Protein-prime/modified vaccinia virus Ankara vector-boost vaccination overcomes tolerance in high-antigenemic HBV-transgenic mice[J]. Vaccine, 2016, 34(7): 923–932. DOI:10.1016/j.vaccine.2015.12.060 |
| [2] | MACLACHLAN J H, COWIE B C. Hepatitis B virus epidemiology[J]. Cold Spring Harb Perspect Med, 2015, 5(5): a021410. DOI:10.1101/cshperspect.a021410 |
| [3] |
张敏娜, 袁月, 貌盼勇, 等. 中国2004-2013年病毒性肝炎发病与死亡趋势分析[J].
中华流行病学杂志, 2015, 36(2): 144–147.
ZHANG M N, YUAN Y, MAO P Y, et al. Analysis on morbidity and mortality of viral hepatitis in China, 2004-2013[J]. Chin J Epidemiol, 2015, 36(2): 144–147. DOI:10.3760/cma.j.issn.0254-6450.2015.02.010 |
| [4] | BERG T, ZOULIM F, MOELLER B, et al. Long-term efficacy and safety of emtricitabine plus tenofovir DF vs. tenofovir DF monotherapy in adefovir-experienced chronic hepatitis B patients[J]. J Hepatol, 2014, 60(4): 715–722. DOI:10.1016/j.jhep.2013.11.024 |
| [5] | LIU Y, QI X, ZENG Z, et al. CRISPR/Cas9-mediated p53 and Pten dual mutation accelerates hepatocarcinogenesis in adult hepatitis B virus transgenic mice[J]. Sci Rep, 2017, 7(1): 2796. DOI:10.1038/s41598-017-03070-8 |
| [6] | DI SCALA M, OTANO I, GIL-FARIÑA I, et al. Complementary effects of interleukin-15 and alpha interferon induce immunity in hepatitis B virus transgenic mice[J]. J Virol, 2016, 90(19): 8563–8574. DOI:10.1128/JVI.01030-16 |
| [7] | BAO J J, LEE B P, STEPHENS L C, et al. Elevated expression of hepatic proliferative markers during early hepatocarcinogenesis in hepatitis-B virus transgenic mice lacking mdr1a-encoded P-glycoprotein[J]. Mol Carcinog, 2000, 29(2): 103–111. DOI:10.1002/1098-2744(200010)29:2<103::aid-mc7>3.0.co;2-e |
| [8] | GRAUMANN F, CHURIN Y, TSCHUSCHNER A, et al. Genomic methylation inhibits expression of hepatitis B virus envelope protein in transgenic mice: a non-infectious mouse model to study silencing of HBV surface antigen genes[J]. PLoS ONE, 2015, 10(12): e0146099. DOI:10.1371/journal.pone.0146099 |
| [9] | MCFADDEN V C, SHALABY R E, IRAM S, et al. Hepatic deficiency of the pioneer transcription factor FoxA restricts hepatitis B virus biosynthesis by the developmental regulation of viral DNA methylation[J]. PLoS Pathog, 2017, 13(2): e1006239. DOI:10.1371/journal.ppat.1006239 |
| [10] |
吴琴, 高云. 氧化苦参碱药理作用的分子机制研究进展[J].
中国药理学通报, 2015, 31(6): 759–762.
WU Q, GAO Y. Research advances in molecular mechanism of pharmacological actions of oxymatrine[J]. Chin Pharmacol Bull, 2015, 31(6): 759–762. DOI:10.3969/j.issn.1001-1978.2015.06.005 |
| [11] | HUANG F, CAI P, WANG Y, et al. Up-regulation of brain-expressed X-linked 2 is critical for hepatitis B virus X protein-induced hepatocellular carcinoma development[J]. Oncotarget, 2017. DOI:10.18632/oncotarget.19477 |
| [12] | ZHANG T Y, YUAN Q, ZHAO J H, et al. Prolonged suppression of HBV in mice by a novel antibody that targets a unique epitope on hepatitis B surface antigen[J]. Gut, 2016, 65(4): 658–671. DOI:10.1136/gutjnl-2014-308964 |
| [13] | LOGGI E, GAMAL N, BIHL F, et al. Adaptive response in hepatitis B virus infection[J]. J Viral Hepat, 2014, 21(5): 305–313. DOI:10.1111/jvh.12255 |
| [14] | ZHUO M, SONG L, TANG Y, et al. Vaccination with ubiquitin-hepatitis B core antigen-cytoplasmic transduction peptide enhances the hepatitis B virus-specific cytotoxic T-lymphocyte immune response and inhibits hepatitis B virus replication in transgenic mice[J]. Mol Med Rep, 2015, 12(3): 3591–3598. DOI:10.3892/mmr.2015.3834 |
| [15] | DEMBEK C, PROTZER U. Mouse models for therapeutic vaccination against hepatitis B virus[J]. Med Microbiol Immunol, 2015, 204(1): 95–102. DOI:10.1007/s00430-014-0378-6 |



